术前胰岛素水平对非糖尿病胶质细胞瘤预后的预测价值
2018-07-05冯清林范仕兵胡建娥冉住国
冯清林 范仕兵△ 赵 锐 胡建娥 冉住国
重庆三峡中心医院 1)神经外科 2)临床检验科,重庆 404000
脑胶质瘤是中枢神经系统最常见的恶性肿瘤,其中胶质母细胞瘤(GBM)约占50%,男性发病率高于女性,5 a期生存率约5%[1-3]。胶质瘤好发于脑实质内,呈浸润性生长,预后差,病死率、复发率高[4]。研究显示,患者即使接受最新的诊断及治疗方案,预后仍然很差,中位生存期约18个月[5-7]。其原因可能与个体差异、肿瘤生长的机制、临床误诊、治疗方案不标准有关[8-11]。研究表明,2型糖尿病与胶质瘤的预后有关,其机制的研究主要是针对2型糖尿病及代谢综合征患者,可能与高胰岛素血症、胰岛素抵抗以及胰岛素样生长因子-1(IGF-1)增加有关[12-13]。但相关血糖指标(空腹血糖、胰岛素、糖化血红蛋白)的研究存在不一致的结果,可能与选择的队列中有或无糖尿病的胶质瘤患者有关[14-17]。基于假设血清胰岛素与胶质瘤存在相关性,本研究探讨血清胰岛素水平对非糖尿病胶质瘤患者预后的判断价值,以无进展生存时间做前瞻性研究。
1 资料和方法
1.1临床资料选择2010—2017年重庆三峡中心医院治疗的286例胶质瘤患者,其中216例非糖尿病胶质瘤患者纳入研究。患者治疗前测定血糖指标,治疗后随访时间为术后至2017-12。216例胶质母细胞瘤患者行手术治疗,术后行标准辅助治疗。纳入标准:(1)有头晕、头痛、恶心呕吐、癫痫、视力减退、复视、肢体运动障碍、语言功能障碍、面瘫、共济失调、精神症状、视乳头水肿、眼球运动障碍、偏瘫、病理反射阳性等临床症状,临床诊断为胶质瘤;(2)行手术切除,病理检查证实为GBM;(3)即往无重要器官疾病。排除标准:(1)术前急性或慢性肝炎、甲状腺功能异常、肝肾系统疾病、自身免疫性疾病及免疫抑制剂药物治疗史、高血压、心脏疾病史;(2)术前进行过化疗、放疗等。按1:2比例匹配年龄、血脂、体重指数的健康者为对照组,比较2组临床资料及血糖指标。本研究经本院伦理委员会同意,患者及家属签署知情同意书。
1.2随访随访时间终点为疾病进展或死亡,无疾病进展和死亡为删失数据。无进展生存定义为肿瘤患者从接受治疗开始至观察到疾病进展或发生任何原因的死亡。中位随访时间4.16 a。根据美国癌症分期联合委员会临床TNM分期,疾病进展(复发转移)定义为随访中发生局部复发或远处转移。局部复发患者根据病灶切除或穿刺病理检查证实;远处转移主要依据影像学检查结合核医学骨扫描以及随访期间转移病灶情况综合判定。
1.3生化检测研究对象均于治疗前采集血样。入院后晨起空腹安静状态下抽取肘前静脉血,每5 mL置于两管未加抗凝剂的采血管中,-80 ℃保存备用。血糖检测采用日产7600-020全自动生化分析仪进行检测;血清胰岛素采用德国拜尔公司生产的ADVIA Centaur全自动化学发光仪进行检测;糖化血红蛋白采用美国BIO-RAD VARIANTⅡ糖化血红蛋白仪的高效液相色谱法测定;计算胰岛素抵抗指数(HOMA-IRI)=(空腹血糖mmol/L×空腹胰岛素mU/L)/22.5。
1.4血清胰岛素截断值及无进展生存时间分析采用ROC曲线计算血清胰岛素截断值,以胰岛素最佳节点,分为高低2组,比较2组病例因素;Kaplan-Meier分析2组无进展生存时间,比较胰岛素与PFS的关系;COX风险比例模型分析PFS相关因素。

2 结果
2.1临床特征286例胶质瘤患者中30例术前行新辅助化疗,29例诊断为糖尿病,8例肝肾功能异常,3例饮酒及药物滥,均排除出研究。共216例非糖尿病胶质瘤患者纳入研究,患者临床特征与对照组比较,见表1。216例胶质瘤患者均行手术治疗(39%行活检术,61%行肿瘤切除术),术后行标准辅助治疗:(1)标准放疗方案:总剂量54~60 Gy,每次分割剂量1.8~2.0 Gy;(2)化疗为标准的Stupp方案:同步放疗期间,每日口服替莫唑胺(TMZ)75 mg/m2,辅助化疗期间,以5/28标准方案进行,TMZ 150~200 mg/m2,常规6个周期。
2.2 2组血糖指标比较与健康对照组比较,胶质瘤组空腹血糖及胰岛素差异有统计学意义(P<0.05),糖化血红蛋白差异无统计学意义(P>0.05),胰岛素抵抗指数(HOMA-IRI)差异有统计学意义(P<0.05)。见表2。
2.3 ROC截断值216例非糖尿病胶质瘤患者外周血空腹胰岛素水平(9.5±4.6)mU/L,以外周血胰岛素为因素变量,进展状况为状态值,绘制ROC曲线,ROC曲线下面积为0.79,当胰岛素=10.3 mU/L时,其约登指数为最大值0.51,特异性为71.4%,敏感性为80%。本研究采用10.3为截断值。见图1。

表1 胶质瘤患者临床特征与对照组比较

表2 胶质瘤患者与对照组血糖指标比较
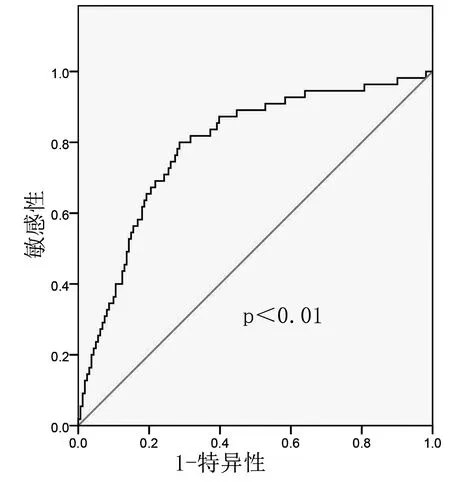
图1 评估患者进展情况的ROC曲线
2.4胰岛素高低2组临床资料及无进展生存时间比较2组比较,性别及年龄比例差异无统计学意义(P>0.05),肿瘤分期、进展与否差异有统计学意义(P<0.05)。见表3。中位随访时间4.16 a,胶质瘤组中55例(25.4%)出现进展(复发)情况,至随访结束因疾病导致死亡13例(6%)。Kaplan-Meier以胰岛素为因素值分析2组无进展时间,生存率组间Log-Rank检验(P<0.05),高胰岛素组预后差。见图2。
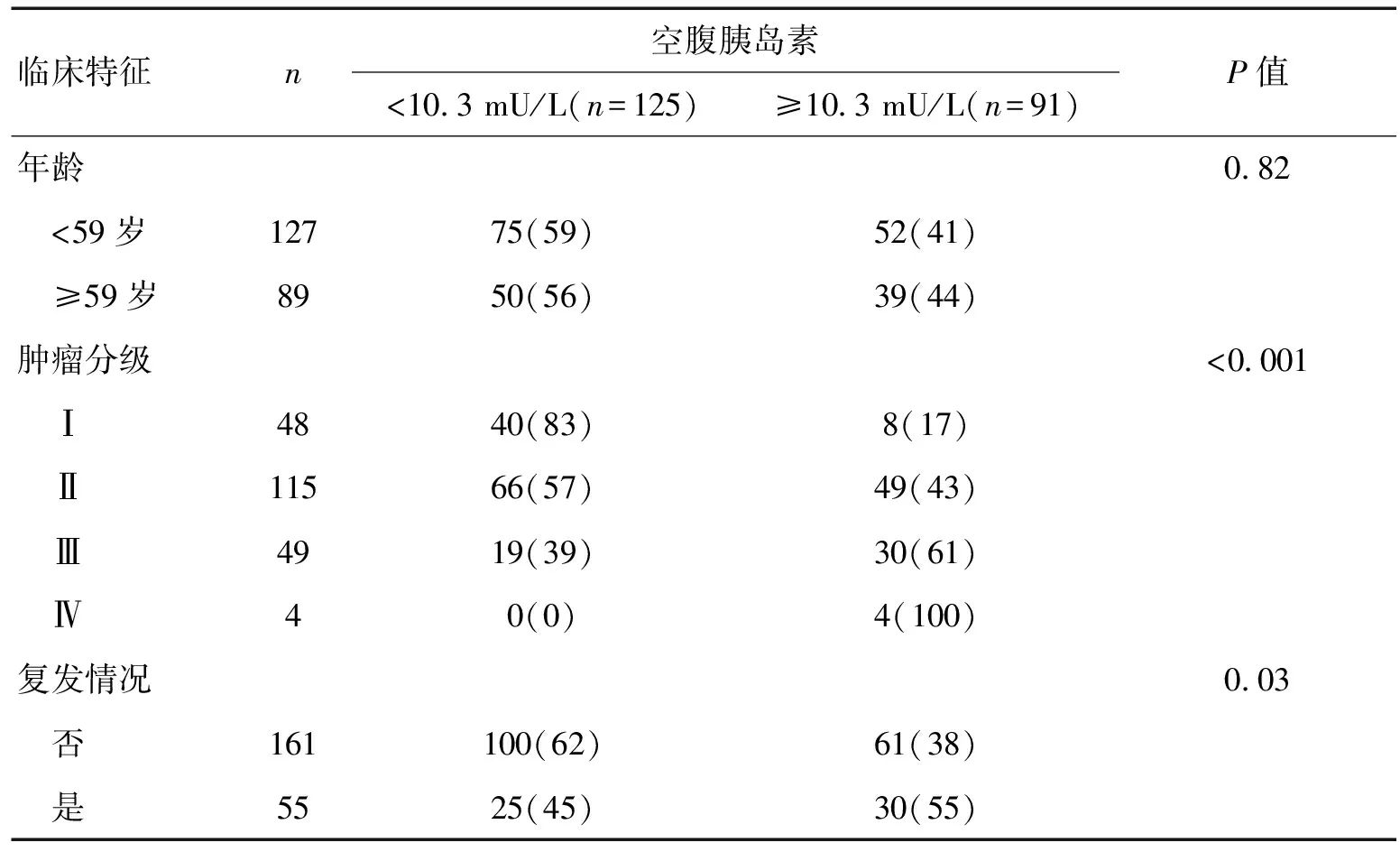
表3 胶质瘤患者空腹胰岛素与临床特征的关系 [n(%)]

图2 术前胰岛素高低2组无进展生存时间比较
2.5影响PFS的单因素及多因素分析COX单因素分析显示,与PFS相关(P<0.05)的有肿瘤分级(HR=1.37,95%CI1.08~1.76)、空腹胰岛素(HR=2.11,95%CI1.19~3.77)。见表4。COX多因素分析显示,与PFS(P<0.05)相关的有肿瘤分级(HR=1.31,95% CI 1.03~1.65)、空腹胰岛素(HR=1.98,95%CI1.06~3.69)。见表5。
3 讨论
胶质瘤是颅内最常见的恶性肿瘤之一,具有复发率高、预后差等的特点,且预后受多个因素影响。研究发现,胰岛素对于肿瘤细胞具有促进细胞增殖的作用,对其机制的研究表明,二甲双胍类降糖药通过降低胰岛素水平,改善胰岛素抵抗,有效改善肿瘤患者的预后[18-20]。目前,相关文献大部分集中其与糖代谢之间的关系,而研究非糖尿病胶质瘤患者和糖代谢之间的关系极少[21]。因此,本研究探讨血清胰岛素水平为非糖尿病胶质瘤患者的独立预后因素,进一步证实血清胰岛素对胶质瘤的影响,为胶质瘤的治疗提供指导。
本研究中血糖指标的检测表明,216例胶质瘤组与对照组具有可比性,符合我们研究的标准,二者空腹血糖及胰岛素比较差异有统计学意义,糖化血红蛋白差异无统计学意义,胰岛素抵抗指数(HOMA-IRI)差异有统计学意义,表明胶质瘤组空腹血糖、胰岛素高于对照组;术前高空腹血糖及胰岛素导致HOMA-IRI增加,与相关研究相符[22]。由于缺乏与胶质瘤的关联,与对照组比较差异无统计学意义,糖化血红蛋白水平被排除在随后的分析中;血糖对胶质瘤预后的影响报道较少,本研究血糖水平主要用来筛除纳入的研究对象,我们对空腹胰岛素水平作进一步的研究。胰岛素是一种生长因子,促进DNA合成,引起上皮细胞增生,促进肿瘤生长的作用[23]。胰岛素水平的升高,能降低胰岛素样生长因子结合蛋白的合成,使游离IGF-I增加,从而抑制细胞的凋亡,刺激细胞增殖,导致肿瘤生长[24-25]。本研究通过ROC曲线计算术前胰岛素水平对非糖尿病胶质瘤患者无进展生存时间的截断值,胰岛素=10.3 mU/L为最佳节点,以截断值分为高低2组,2组性别及年龄差异无统计学意义(P>0.05),患者的肿瘤分期、进展与否差异有统计学意义(P<0.05);Kaplan-Meier以胰岛素为因素分析2组无进展时间,高胰岛素组30例(34%)进展,低胰岛素组25例(20%)进展;生存率组间Log-Rank检验表明,胰岛素水平对胶质瘤的发生及发展有明显关系,胰岛素越高,胶质瘤恶性程度越高,进展越快,预后越差。COX单因素分析显示,与PFS相关的有肿瘤分级、空腹胰岛素;COX多因素分析显示,与PFS相关的有肿瘤分级、空腹胰岛素,表明空腹胰岛素水平为术前非糖尿病胶质瘤患者的独立预后危险因素。

表4 COX风险比例模型单因素临床病例变量对胶质瘤患者无进展生存率分析 [n(%)]

表5 COX风险比例模型多因素临床病例变量对胶质瘤患者无进展生存率的分析
术前胰岛素水平与胶质瘤患者的预后相关,合理的生活方式或胰岛素靶向药物的干预可能成为提高胶质瘤治疗效果的策略。但本研究样本量不足,导致统计效应的减弱,因此,建立以胰岛素作为胶质瘤预后的最终指标,需要更多的前瞻性研究以及详细的实验性检查。本研究初步探讨了术前胰岛素水平对胶质瘤预后的判断价值,为下一步的研究提供了重要的依据。
[1] 方艳伟,刘力强,邱文娜,等.EphA2及其配体EphrinA1在恶性脑胶质瘤中的表达与血管生成的关系[J].中国肿瘤临床,2013,40(18):1 111-1 115.
[2] SZOPA W,BURLEY T A,KRAMER-MAREK G,et al.Diagnostic and therapeutic biomarkers in glioblasto-ma:Current Status and Future Perspectives[J].Biomed Res lnt,2017,2017:8013575.
[3] 张倩,徐文茂.荜茇酰胺对胶质瘤细胞的影响[J].临床检验杂志,2017,6(1):61-64.
[4] LI Y,HOU M,LU G,et al.The Prognosis of anti-Angiogenesis treatments combined with standard therapy for newly diagnosed glioblastoma:A Meta-Analysis of Randomized Controlled Trials[J].PLoS One,2016,11(12):1 682-1 686.
[5] ZHAO S,CAI J,LI J,et al.Bioinformatic profiling identifies a glucose-related risk signature for the malignancy of glioma and the survival of patients[J].Mol Neurobiol,2016,11(12):632-637.
[6] ALKAN A,KOKSOY E B,UTKAN G.Albumin to globulin ratio,a predictor or a misleader[J].Ann Oncol,2015,26(2):443-444.
[7] KUHNT D,BECKER A,GANSLANDT O,et al.Correlation of the extent of tumor volume resection and patient survival in surgery of glioblastoma multiforme with high-field in surgery of glioblastoma multifotme with high-field intraoperative MRI guidance[J].Neuro Oncol,2011,13(12):1 339-1 348.
[8] LEE Y J,KIM W R,HAN J,et al.Prognostic Impact of immunonutritional status changes during preoperative chemoradiation in patients with rectal cancer[J].Ann Coloprotol,2016,32(6):208-214.
[9] PRIETO I,MONTERMUINO S,LUNA J,et al.The role of immunonutritional support in cancer treatment:Current evidence[J].Clin Nutr,2017,36(6):1 457-1 464.
[10] AZAB B,KEDIA S,SHAH N,et al.The value of the pretreatment albumin/globulin ration in predicting the long-term survival in colorectal cancer[J].Int J Colorectal Dis,2013,28(12):1 629-1 636.
[11] 李越.多种生化指标检验在脂肪肝诊断中的应用价值[J].临床检验杂志,2017,6(1):141-142.
[12] WEI X,GAOJ,ZHAN C,et al.Liposome-based glioma targeted drug delivery enabled by stable peptide ligands[J].J Control Release,2015,218:13-21.
[13] SHIEH F K,WANG S C,YEN C L,et al.Imparting functionality to biocatalysts via embedding enzymes into nanoporous materials by a de novo approach:size-selective sheltering of catalase in metal-organic framework microcrystals[J].Am Chem Soc,2015,137(13):4 276-4 279.
[14] TAGHAVI S,NIA A H,ABNOUS K,et al.Polyethylenimine-functionalized carbon nanotubes tagged with AS1411 aptamer for combination gene and drug delivery into human gastric cancer cells[J].Int J Pharm,2017,516(12):301-312.
[15] JALOTA A,KUMAR M,DAS B C,et al.A drug combination targeting hypoxia induced chemoresistance and stemness in glioma cells[J].Oncotarget,2018,9(26):18 351-18 366.
[16] RAHMAN M,REYNER K,DELEYROLLE L,et al.Neurosphere and adherent culture conditions are equivalent for malignant glioma stem cell lines[J].Anat Cell Biol,2015,48(17):2 501-2 505.
[17] MELLMAN I,COUKOS G,DRANOFF G,et al.Cancer immunotherapy comes of age[J].Nature,2011,480(7378):480-489.
[18] SHOJI F,MORODOMI Y,AKAMINE T,et al.Predictive impact for postoperative recurrence using the preoperative prognostic nutritional index in pathological stage I non-small cell lung cancer[J].Lung Cancer,2016,98(3):15-21.
[19] HO A L,KOCH M J,TANAKA S,et al.Impact of histopathological transform and overall survival in patients with progressive anaplastic glioma[J].J Clin Neurosci,2016,31:99-105.
[20] PUCKO E,MATYJA E,KORONKIEWICZ M,et al.Potent Antitumour Effects of Novel Pentabromobenzylisothioureas Studied on Human Glial-derived Tumour Cell Lines[J].Anticancer Res,2018,38(5):2 691-2 705.
[21] TOMS S A,TAPINOS N.Recent advances in the treatment of gliomas-comprehensive brain tumor center[J].R I Med J,2017,100:43-46.
[22] PEREZ-BETETA J,MARTINEZ-GONZALEZ A,MOLONA D,et al.Glioblastoma:does the pre-treatment geometry matter? A postcontrast T1 MRI-based study[J].Eur Radiol,2017,27(3):1 096-1 104.
[23] TOBERT C M,HAMITON-REEVES J M,NORIAN L A,et al.The Emerging Impact of Malnutrition on Surgical Patients:Literature Review and Potential Implications on Cystectomy for Bladder Cancer[J].J Urol,2017,198(3):511-519.
[24] HUNG A L,GARZON-MUVDI T,LIM M.Biomark-ers and immunotherapeutic Ttargets in Glioblastoma[J].World Neurosurg,2017,102(16):494-506.
[25] NOBLE F,HOPKINS J,CURTIS N,et al.The role of systemic inflammatory and nutritional blood-borne markers in predicting response to neoadjuvant chemotherapy and survival in esophagogastric cancer[J].Med Oncol,2013,30(3):596-605.
