不同EGFR突变位点晚期非小细胞肺癌的临床特征及对靶向药物治疗反应分析
2018-07-05孙晓远刘斌蒋捍东吴学玲
孙晓远 刘斌 蒋捍东 吴学玲
肺癌是我国发病率和病死率最高的恶性肿瘤, 发病率为73.3/10万,标化病死率为39.81/10万[1-2]。85%~90%的肺癌是由于主动或被动吸烟所致,非小细胞肺癌( non-small cell lung cancer, NSCLC)为主要病理类型,其中吸烟者以鳞癌为主,而非吸烟者以腺癌为主[3]。早期手术切除的肺癌患者预后较好, 但许多NSCLC患者就诊时已属晚期,无手术机会,其放、化疗的疾病缓解率极低。
近年来以表皮生长因子受体酪氨酸激酶抑制剂(epidermal growth factor receptor-tyrosinekinase inhibitor, EGFR-TKI )为代表的靶向治疗药物已成为NSCLC不可或缺的治疗方法,而且是目前EGFR突变阳性晚期NSCLC患者的首选治疗。该治疗针对性强、有效率高、缓解期长, 不良反应小。吉非替尼(Gefitinib, 易瑞沙)和厄洛替尼(Erlotinib, 特罗凯)作为最常用的EGFR-TKI, 能通过选择性地抑制ATP与EGFR酪氨酸激酶的结合, 抑制其自身磷酸化阻断EGFR的信号传递,从而抑制肿瘤的生长。泰瑞沙是T790M突变阳性患者可选用的EGFR-TKI[4]。
EGFR外显子的突变状态不同导致NSCLC患者EGFR-TKI的疗效差异。2009年艾瑞莎泛亚研究(Iressa Pan-Asia Study, IPASS) 结果显示,相较于化疗,接受吉非替尼治疗的EGFR突变阳性肺腺癌患者具有更高的无进展生存期(progression-free survival, PFS)及与健康相关的生活质量等[5]。有研究已将其应用扩大范围至所有NSCLC患者[6-7]。外显子18、19、20、21是EGFR的敏感突变点,其中最常见的是19外显子缺失(19-Del)突变及21外显子L858R(21-L858R)点突变。有研究发现含有EGFR外显子19-Del的NSCLC较含有EGFR外显子21-L858R的NSCLC对EGFR-TKI的亲和力更高且解离速度更慢[8]。研究显示在NSCLC中外显子19-Del突变者的总生存期及中位生存期均长于外显子21-L858R突变者 (分别为38vs. 17个月,P=0.04及34vs. 8个月,P=0.01)[9-10]。但也有研究显示不同EGFR突变位点患者其PFS并无差异[6]。目前国内对于EGFR突变位点与EGFR-TKI疗效关系及临床特征的相关研究较少。本研究收集上海交通大学医学院附属仁济医院具有外显子19-Del突变及外显子21-L858R突变,且接受EGFR-TKI(吉非替尼或厄洛替尼)治疗的晚期NSCLC患者进行回顾性分析,旨在探讨不同EGFR基因突变位点NSCLC患者的临床特征及其对靶向药物治疗反应的差异。
材料与方法
一、临床资料
收集2014年1月至2017年12月就诊于上海交通大学医学院附属仁济医院,具有外显子19-Del突变及外显子21-L858R突变且接受EGFR-TKI(吉非替尼或厄洛替尼)治疗的晚期NSCLC患者,采集其临床资料。入组标准:①18~100岁;②治疗前进行相关标本的EGFR基因检测;③具有至少1个可测量靶病灶;④接受EGFR-TKI治疗直至疾病进展的晚期NSCLC。排除标准:①临床资料不完整;②接受EGFR-TKI治疗同时接受放化疗等其他抗肿瘤治疗者;③合并其他部位肿瘤者。
二、研究方法
1. EGFR检测方法: 病变组织来源包括经支气管镜活检、经淋巴结及肺穿刺活检组织或胸水脱落细胞蜡块。所有标本均以10%福尔马林固定, 常规石蜡包埋封存。EGFR检测均在EGFR-TKI使用前完成。检测时,首先评估检测样本保证检测所需要的肿瘤细胞的数量和比例, 符合要求后使用OMEGA(美国)E.Z.N.A.FFPE DNA KIT从石蜡组织中提取DNA,用ARMS-PCR方法检测EGFR外显子突变情况。
2. 疗效评价方法: 按RECIST标准评价疾病进展(progressive disease, PD)、病情稳定(stable disease, SD)、部分缓解(partial response, PR)、完全缓解 (complete response, CR)[11]。定义PFS为首次应用分子靶向药物至明确疾病进展的时间。客观缓解率(objective response rate, ORR)=(CR+PR)/总例数×100%。疾病控制率 (disease control rate, DCR)=(CR+PR+SD)/总例数×100%。
三、统计学方法
采用SPSS 24软件对数据进行统计学分析。EGFR不同突变位点的晚期NSCLC患者临床特征及疗效差异的单变量分析用χ2检验,两组肿瘤无进展生存分布用Kaplan-Meier法进行生存分析,用Log-rank检验生存分布是否相同。应用单因素Cox回归分析及多因素Cox回归分析评估各因素对PFS的影响,以HR值估测。P<0.05表示有统计学意义。
结 果
一、患者的一般特征
2014年1月至2017年12月有42例晚期NSCLC患者通过ARMS方法检测到EGFR突变为外显子19-Del突变和外显子21-L858R突变并接受EGFR-TKI治疗。结果显示外显子19-Del突变24例(57%),外显子21-L858R突变18例(43%)。其平均年龄为62.02岁,年龄最小者36岁,年龄最大者82岁,女性17例(40%),非吸烟26例(62%),腺癌40例(95%)。38例(90%)接受吉非替尼治疗,4例(10%)接受厄洛替尼治疗。EGFR外显子21- L858R突变患者中39%为脑转移患者,而EGFR外显子19-Del突变者中4%为脑转移患者(χ2=8.042,P=0.005)。除此以外,两组患者其余临床及病理特征均无显著差异,见表1。
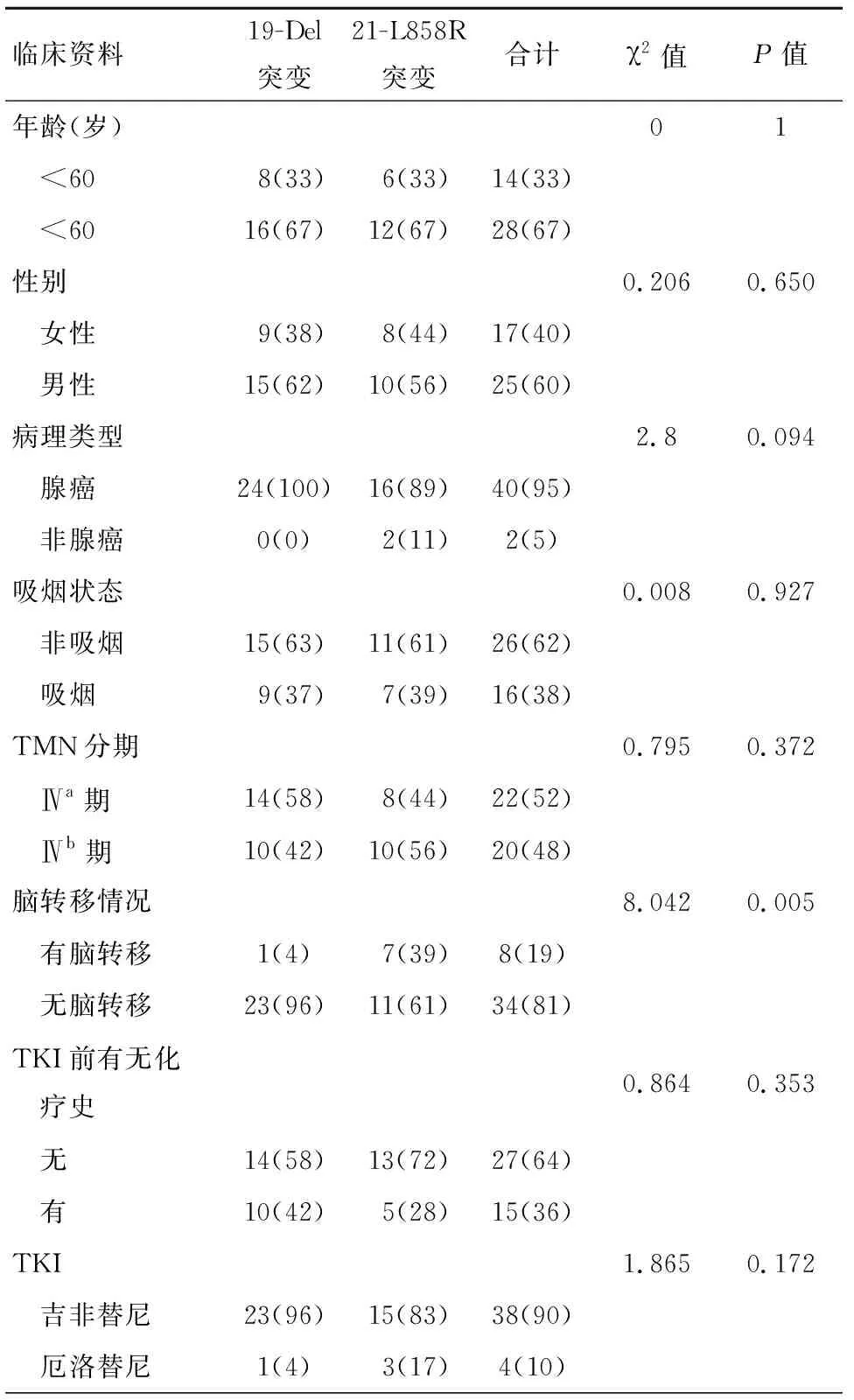
表1 患者临床特征[n(%)]
二、不同EGFR突变位点的晚期NSCLC患者对靶向药物治疗反应差异评价
1. EGFR突变与临床治疗效果: 使用EGFR-TKI后55%患者呈PR,36%患者呈SD,9%患者疗效不佳呈PD,疾病控制率为90.48%。外显子19-Del突变组与外显子21-L858R突变组对EGFR-TKI的总体治疗效果无显著差异(χ2=0.803,P=0.669),两组患者ORR及DCR均无显著差异(χ2=0.513,P=0.474;χ2=0.576,P=0.448)。在众多临床、病理特征中,有吸烟史的两组不同突变位点晚期NSCLC患者对EGFR的治疗效果有显著差异(χ2=7.467,P=0.024),外显子19-Del突变组疗效优于外显子21-L858R突变组。其余在两组患者中,无论TKI前有无化疗、有无脑转移,与有吸烟史的患者一样,其对EGFR-TKI的疗效无显著差异,见表2。
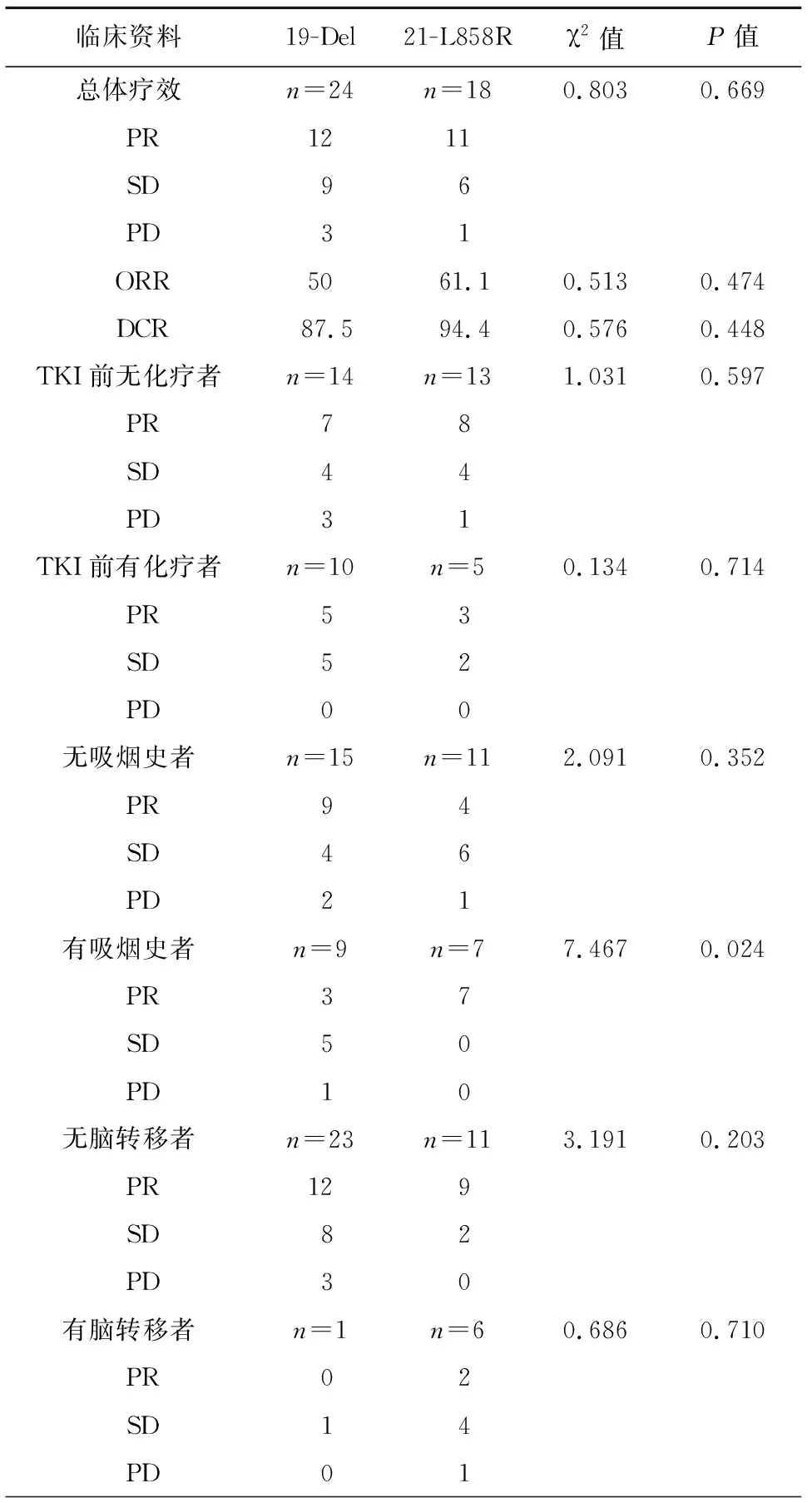
表2 EGFR突变与临床治疗效果[n(%)]
2. EGFR突变与中位PFS: 外显子19-Del突变患者最小PFS为2个月,最大PFS为40个月,中位PFS为16个月(95%CI: 8.318~23.682个月)。外显子21-L858R突变患者最小PFS为2个月,最大PFS为29个月,中位PFS为9月(95%CI: 6.934~11.066个月)。外显子19-Del突变患者中位PFS长于外显子21-L858R突变患者,二者中位PFS差异有统计学意义(log-rankP=0.030)。两组患者总体平均中位PFS为12个月(95%CI: 5.649~18.351个月),见图1。
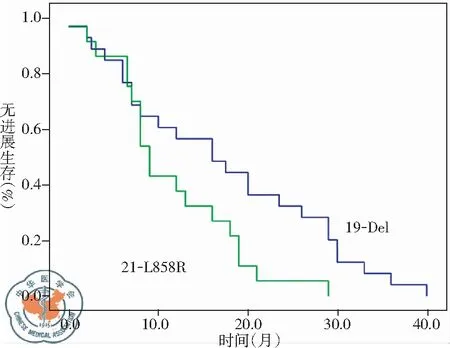
图1 外显子19-Del与外显子21-L858R突变患者的生存曲线
3. 肿瘤无进展生存相关影响因素: 单因素Cox回归分析显示EGFR外显子19-Del突变及肿瘤病理类型腺癌为较长PFS的预测因素(P=0.039,P=0.007)。然而多因素Cox回归分析显示EGFR外显子19-Del突变并非较长PFS的独立预测因素(P=0.152),但病理类型腺癌仍为较长PFS的独立预测因素(P=0.031),见表3。
讨 论
EGFR属于人表皮生长因子受体家族中的一个跨膜的酪氨酸激酶受体,EGFR突变或过表达均可能引发肿瘤的发生。其编码的酪氨酸激酶受体可以分为三个区域,包括细胞外配体结合区、跨膜区以及细胞内酪氨酸激酶活性区。当配体和细胞外的配体结合区结合形成二聚体,激活酪氨酸激酶区域,引发下游包括磷酸肌醇3激酶在内的一系列信号通路的激活,从而促进细胞生长、分化。EGFR过度表达和突变导致EGFR通路失调,参与肿瘤细胞的增殖、转移、血管生成、抑制凋亡及药物抵抗[12-13]。
国外NSCLC患者中EGFR突变率为10%,而30%亚洲NSCLC人群存在EGFR突变。通常EGFR突变发生率在腺癌中高于其它病理类型,女性高于男性,不吸烟者高于吸烟者[14]。有研究发现NSCLC患者EGFR突变90%发生在外显子18~21中, 且主要集中在19外显子缺失突变和21外显子L858R错义突变[15],而本研究发现EGFR突变分布结果与文献报道相似。

表3 PFS相关影响因素
多项多中心大规模随机对照前瞻性临床研究均揭示EGFR突变阳性患者可从EGFR-TKI中获益[16-18]。尽管免疫治疗正受到越来越多科研人员及临床医师的关注,但EGFR-TKI目前仍是是EGFR敏感突变NSCLC人群的重要治疗手段。亚洲人NSCLC患者EGFR突变率远高于其他人种,并对TKI治疗敏感性更高,总生存更长,故EGFR-TKI其地位目前仍不可撼动。
EGFR-TKI的疗效不仅与EGFR是否突变相关,而且与突变位点相关。研究发现其疗效亦与EGFR基因突变位点相关[19]。EGFR外显子19-Del突变时ATP受体结合囊角度改变,外显子21-L858R突变时周围DFG序列提高了A-LOOP的稳定性,导致肿瘤细胞对TKI亲和力或敏感性增加[20]。研究显示接受一线EGFR-TKI治疗的晚期NSCLC患者中19-Del突变组PFS长于21-L858R组PFS(HR=0.59,95%CI: 0.38~0.92,P=0.019)[21],但并非所有研究结论一致。姚晓燕等[22]研究发现接受TKI治疗的肺癌患者中19缺失突变的中位PFS为7.0个月,反而略短于21点突变的7.7个月, 二者间无显著性差异。本研究结果显示EGFR19-Del突变组与EGFR21-L858R突变组其总体疗效无显著差异(χ2=0.803,P=0.669),两组患者ORR及DCR亦均无显著差异(χ2=0.513,P=0.474;χ2=0.576,P=0.448)。但外显子19-Del突变患者中位PFS为16个月(95%CI: 8.318~23.682个月),长于外显子21-L858R突变患者的中位PFS的9个月(95%CI: 6.934~11.066个月), 二者差异有统计学意义( log-rankP=0.030)。这一结果与姜海英等[23]报道的两组患者中位PFS结果相近(13.2vs. 10.8个月,χ2=4.7,P=0.030)。
众多研究者正不断探索两种突变对EGFR-TKI临床疗效差异的深层次原因。有研究显示在117例EGFR敏感突变的NSCLC患者中,19-Del突变组吸烟者占59.3%,而21-L858R突变组吸烟者为76.2%,两者有明显统计学差异(P=0.0496)[24]。众所周知,非吸烟NSCLC对EGFR-TKI获益多于吸烟者。故两种不同突变组间吸烟患者比例的差异曾多次被推测为EGFR19-Del突变组较EGFR21-L858R突变组具有更长PFS的原因。但本研究通过单因素Cox回归分析发现吸烟状态并非较长PFS的预测因素(P=0.443),而是EGFR外显子19-Del突变及肿瘤病理类型腺癌(P=0.039,P=0.007)的预测因素。然而经多因素Cox回归分析进一步研究发现仅病理类型腺癌为较长PFS的独立预测因素(P=0.031),而EGFR19-Del突变并非较长PFS的独立预测因素,这与Jackman 等[9]的研究结论相同。有研究纳入了61例EGFR外显子19-Del突变及26例EGFR外显子21-L858R突变的晚期NSCLC患者,单因素Cox回归虽然同样否定了吸烟状态对较长PFS的影响,但多因素Cox回归发现EGFR外显子19-Del突变及肿瘤患者一般状况良好为较长PFS的独立预测因素[25]。此外,研究发现吉非替尼对EGFR外显子19-Del突变者EGFR Tyr-1173及1045位点酪氨酸磷酸化的抑制作用较对EGFR外显子21-L858R突变者更强[26]。相较于EGFR外显子21-L858R突变者,EGFR外显子19-Del突变者中c-Cbl衔接蛋白磷酸化状态因受到一定程度的修饰而与EGFR Tyr-1045残基的结合减少,可导致其EGFR降解减少[27]。Shc衔接蛋白磷酸化水平的下降而与EGFR Tyr-1173残基结合减少,从而导致RAS通路的活化下降[28]。推测上述两种不同突变位点的不同酪氨酸蛋白磷酸化方式可能与其对EGFR-TKI的临床疗效差异有关。
综上所述,EGFR外显子19缺失突变和EGFR外显子21点突变的晚期NSCLC患者TKI治疗的中位PFS之间有差异,但因本研究样本量有限,尚需扩大样本量进一步验证。
参 考 文 献
1 Zou X, Jia M, Wang X, et al. Changing Epidemic of Lung Cancer & Tobacco and Situation of Tobacco Control in China[J]. Zhongguo Fei Ai Za Zhi, 2017, 20(8): 505-510.
2 Lan L, Zhao F, Cai Y, et al. Epidemiological analysis on mortality of cancer in China, 2015[J]. Zhonghua Liu Xing Bing Xue Za Zhi, 2018, 39(1): 32-34.
3 Zhi XY, Zou XN, Hu M, et al. Increased lung cancer mortality rates in the Chinese population from 1973-1975 to 2004-2005: An adverse health effect from exposure to smoking[J]. Cancer, 2015, 121 (Suppl17): 3107-3112.
4 张卉, 张树才. 非小细胞肺癌EGFR基因靶向治疗研究进展[J]. 中国肺癌杂志, 2017, 20(1): 61-65.
5 Mok TS, Wu YL, Thongprasert S, et al. Gefitinib or carboplatin-paclitaxel in pulmonary adenocarcinoma[J]. N Engl J Med, 2009, 361(10): 947-957.
6 Maemondo M, Inoue A, Kobayashi K, et al. Gefitinib or chemotherapy for non-small-cell lung cancer with mutated EGFR[J]. N Engl J Med, 2010, 362 (25): 2380-2388.
7 Mitsudomi T, Morita S, Yatabe Y, et al. Gefitinib versus cisplatin plus docetaxel in patients with non-small-cell lung cancer harbouring mutations of the epidermal growth factor receptor (WJTOG3405): an open label, randomised phase 3 trial[J]. Lancet Oncol, 2010, 11(2): 121-128.
8 Carey KD, Garton AJ, Romero MS, et al. Kinetic analysis of epidermal growth factor receptor somatic mutant proteins shows increased sensitivity to the epidermal growth factor receptor tyrosine kinase inhibitor, erlotinib[J]. Cancer Res, 2006, 66(16): 8163-8171.
9 Jackman DM, Yeap BY, Sequist LV, et al. Exon 19 deletion mutations of epidermal growth factor receptor are associated with prolonged survival in non-small cell lung cancer patients treated with gefitinib or erlotinib[J]. Clin Cancer Res, 2006, 12(13): 3908-3914.
10 Riely GJ, Pao W, Pham D, et al. Clinical course of patients with non-small cell lung cancer and epidermal growth factor receptor exon 19 and exon 21 mutations treated with gefitinib or erlotinib[J]. Clin Cancer Res, 2006, 12 (3 Pt 1): 839-844.
11 Eisenhauer EA, Therasse P, Bogaerts J, et al. New response evaluation criteria in solid tumours: revised RECIST guideline (version 1.1) [J]. Eur J Cancer, 2009, 45(2): 228-247.
12 Dutta PR, Maity A. Cellular responses to EGFR inhibitors and their relevance to cancer therapy[J]. Cancer Lett, 2007, 254(2): 165-177.
13 Irmer D, Funk JA, Blaukat A. EGFR kinase domain mutations-functional impact and relevance for lung cancer therapy[J]. Oncogene, 2007, 26(39): 5693-5701.
14 Rosell R, Moran T, Queralt C, et al. Screening for epidermal growth factor receptor mutations in lung cancer[J]. N Engl J Med, 2009, 361(10): 958-967.
15 Qin BM, Chen X, Zhu JD, et al. Identification of EGFR kinase domain mutations among lung cancer patients in China: implication for targeted cancer therapy[J]. Cell Res, 2005,15(3):212-217.
16 Mok TS, Wu YL, Thongprasert S, et al. Gefitinib or carboplatin-paclitaxel in pulmonary adenocarcinoma[J]. N Engl J Med, 2009, 361(10): 947-957.
17 Fukuoka M, Wu YL, Thongprasert S, et al. Biomarker analyses and final overall survival results from a phase Ⅲ, randomized, open-label, first-line study of gefitinib versus carboplatin/paclitaxel in clinically selected patients with advanced non-small-cell lung cancer in Asia (IPASS)[J]. J Clin Oncol, 2011, 29(21): 2866-2874.
18 Wang Z, Wu YL, Zhang GC, et al. EGFR/KRAS mutations and gefitinib therapy in Chinese NSCLC patients[J]. Onkologie, 2008, 31(4): 174-178.
19 Lynch TJ, Bell DW, Sordella R, et al. Activating mutations in the epidermal growth factor receptor underlying responsiveness of non-small-cell lung cancer to gefitinib[J]. N Engl J Med, 2004, 350(21): 2129-2139.
20 Mitsudomi T, Yatabe Y. Mutations of the epidermal growth factor receptor gene and related genes as determinants of epidermal growth factor receptor tyrosine kinase inhibitors sensitivity in lung cancer[J]. Cancer Sci, 2007, 98(12): 1817-1824.
21 Zhang Y, Sheng J, Kang S, et al. Patients with exon 19 deletion were associated with longer progression-free survival compared to those with L858R mutation after first-line EGFR-TKIs for advanced non-small cell lung cancer: a Meta-analysis[J]. PLoS One, 2014, 9(9): e107161.
22 姚晓燕, 申淑景, 王晔, 等. EGFR突变与非小细胞肺癌临床病理和TKI治疗疗效预测相关性分析[J]. 中华肿瘤防治杂志, 2016, 23(6): 369-372.
23 姜海英, 李艳芳, 朱梅, 等. EGFR-TKI一线治疗不同EGFR突变状态晚期非小细胞肺癌疗效分析[J]. 国际肿瘤学杂志, 2017, 44(1): 19-23.
24 Sasaki H, Endo K, Takada M, et al. L858R EGFR mutation status correlated with clinico-pathological features of Japanese lung cancer[J]. Lung Cancer, 2006, 54(1): 103-108.
25 Won YW, Han JY, Lee GK, et al. Comparison of clinical outcome of patients with non-small-cell lung cancer harbouring epidermal growth factor receptor exon 19 or exon 21 mutations[J]. J Clin Pathol, 2011, 64(11): 947-952.
26 Zhu JQ, Zhong WZ, Zhang GC, et al. Better survival with EGFR exon 19 than exon 21 mutations in gefitinib-treated non-small cell lung cancer patients is due to differential inhibition of downstream signals[J]. Cancer Lett, 2008, 265(2): 307-317.
27 Hosaka T, Inoue F, Ando K, et al. Mutant epidermal growth factor receptor undergoes less protein degradation due to diminished binding to c-Cbl[J]. Anticancer Res, 2007, 27(4B): 2253-2563.
28 Okabe T, Okamoto I, Tamura K, et al. Differential constitutive activation of the epidermal growth factor receptor in non-small cell lung cancer cells bearing EGFR gene mutation and amplification[J]. Cancer Res, 2007, 67(5): 2046-2053.
