大孔吸附树脂纯化锥栗壳色素的工艺研究
2018-07-04黄艳黄晓菲吴琳珊李烨罗德赟
黄艳,黄晓菲,吴琳珊,李烨,罗德赟
(1.武夷学院茶与食品学院,福建武夷山354300;2.福建农林大学食品科学学院,福建福州350002)
锥栗(Castanea henryi Rehd.et Wils.),别称毛榛、尖栗、棒栗,山毛榉目,壳斗科栗属[1]。我国锥栗栽培已有1800多年历史,栽培面积在不断地扩大,主要分布于浙、赣、湘、闽等地区,其中较为著名的当属“名特优经济林锥栗之乡”的福建建瓯市[2-3],其栽培的品种、面积、产量均居全国首位[4-5]。据统计[6],目前建瓯锥栗的年产量达3.3万吨,产值达4.61亿元,而每年由于锥栗果实加工产生的锥栗壳也逐年上涨,年产量达1.74万吨。锥栗果实的开发利用一直备受关注,但锥栗壳废弃物的利用研究较少,目前除被用作制造活性炭之外,大部分被作为废渣焚烧或废弃[7],不仅造成资源浪费,且对环境造成污染。锥栗壳中含有一定的色素物质,主要为棕色色素,笔者已应用恒温-回流法从锥栗壳中提取色素,最佳得率可达17%左右[7]。伴随我国锥栗种植面积的增加,锥栗壳废弃物亦逐年增加,这为开发利用安全性高的锥栗壳天然棕色素提供原料保障。
目前采用有机溶剂提取、碱提等方法[8]获得的天然色素普遍存在杂质多、色素纯度较低的问题。大孔树脂是一类不带离子交换基团的多孔型交联聚合物[9],具有良好的选择吸附特性[10],经大孔树脂处理后,可有效地去除粗提液中大量的糖类、蛋白质等成分,使色素成分高度富集而提高色素纯度和品质[11]。近年来,应用大孔树脂技术提取纯化板栗、榛子等坚果类果壳色素的研究已见较多报道[12-16],但应用该技术吸附纯化锥栗壳色素并未见相应报道。
以锥栗壳为原料,利用易回收、安全性高的乙醇溶液提取锥栗壳粗色素,应用大孔吸附树脂进一步纯化,筛选出最佳纯化工艺,以期为锥栗壳天然色素的工业化分离纯化提供理论依据。
1 材料与方法
1.1 材料与试剂
锥栗壳:由福建省光祥食品有限公司提供。锥栗壳经筛选去除霉烂部分,清洗后先晾晒数天,去除贴壳的带绒毛的果衣,再于烘箱中60℃烘干,粉碎后过100目筛,备用。
无水乙醇、95%乙醇、氢氧化钠、石油醚、盐酸、乙酸乙酯(分析纯):国药集团化学试剂有限公司。
大孔吸附树脂(NKA-9、D4020、XAD-7、DA-201、AB-8、X-5、D101):均购于安徽三星树脂有限公司,具体物理性能如表1所示。
1.2 仪器与设备
PW80高速万能粉碎机:天津市泰斯特仪器有限公司;SHB-III循环水式真空泵:郑州长城科工贸有限公司;PB-10酸度计:上海多博科学仪器有限公司;TG16K-II高速离心机:衡阳东旺实验仪器有限公司;DHG-9123电热恒温鼓风干燥箱:上海精宏实验设备有限公司;Sartorius BSA2245型电子分析天平:北京赛多利斯科学仪器有限公司;岛津UV-2550紫外可见分光光度计:北京京科瑞达科技有限公司;HH-S4数显恒温水浴锅:河北中捷仪器制造有限公司;R-1001-VN旋转蒸发仪:郑州长城仪器有限公司;DZF-6050真空干燥箱:扬州市培英实验仪器有限公司;SH2-82恒温振荡器:常州国华电器有限公司;BSZ-100-LCD自动部分收集器:上海琪特分析仪器有限公司;HL-2恒流泵、CXG-1电脑恒温层析柜:上海沪西分析仪器厂有限公司。

表1 大孔树脂物理性能Table 1 Physical properties of macroporous resin
1.3 试验方法
1.3.1 锥栗壳色素的提取纯化工艺
色素提取工艺参照本课题组的方法进行[7]。提取纯化工艺流程如下:
锥栗壳粉→乙醇恒温回流浸提→抽滤、离心→减压浓缩→色素粗提液→加乙醇、乙酸乙酯及石油醚萃取除杂→减压浓缩→真空干燥→粗提色素干品→按需配置成一定浓度的溶液→大孔吸附树脂纯化→乙醇解析→减压浓缩→冷冻干燥→纯化色素干品
根据此提取制备工艺,制得的粗提色素干品呈土棕色、粉末状,触摸有沙沙的颗粒感。
1.3.2 锥栗壳色素标准曲线绘制
准确称取0.005 g的锥栗壳粗提色素干品溶于适量的40%乙醇溶液中,并定容至100 mL。取5支试管,分别量取 1、2、3、4、5 mL 色素溶液,再分别加入 9、8、7、6、5 mL乙醇溶液,配置成不同浓度的色素溶液,在λmax=277 nm处(前期色素提取试验测定得出)测定不同浓度的吸光度,绘制锥栗壳色素溶液的浓度C与吸光度A的标准曲线,如图1所示。

图1 锥栗壳色素溶液的标准曲线Fig.1 The standard curve of Castanea henryi shell pigment solution
锥栗壳色素在0.005 mg/mL~0.025 mg/mL范围内,吸光度值与其浓度呈良好的线性关系,回归方程如下:A=16.94C+0.0729,R2=0.9989,式中:A 为吸光度值;C为锥栗壳色素溶液浓度,mg/mL。
1.3.3 大孔树脂预处理
将1.1中所述的7种大孔树脂分别用95%乙醇溶液浸泡24 h,再进行抽滤,用蒸馏水抽滤洗涤树脂,至洗出液无乙醇味,流出的洗涤液澄清不浑浊;接着将大孔树脂放入5%HCl溶液中浸泡5 h,用蒸馏水抽滤洗涤,直至pH试纸显示流出的洗涤液呈中性,最后用5%NaOH溶液浸泡5 h,用蒸馏水抽滤洗涤,直至pH试纸显示流出的洗涤液呈中性。将处理好的大孔树脂置于蒸馏水中备用,以防微生物侵染。
1.3.4 最佳吸附树脂的选择
用滤纸轻轻擦拭经预处理活化的大孔树脂表面水分,分别准确称取 2.0 g D101、X-5、XAD-7、D4020、DA-201、AB-8、NKA-9大孔树脂于100 mL的锥形瓶中,加入10 mL锥栗壳色素溶液,测定吸光度A0。于恒温振荡箱(30℃,150 r/min)中充分振荡 24 h,过滤,测定滤液吸光度A1,根据式(1)计算吸附率。
去除滤液,并抽滤水洗除去大孔树脂表面的锥栗色素。将7种大孔树脂分别装于100 mL锥形瓶中,分别加入10 mL 80%乙醇溶液作为解吸液。设置恒温振荡箱温度30℃,转速150 r/min,充分振荡24 h,再过滤溶液,测定滤液的吸光度A2,根据式(2)计算解吸率。

选取吸附率和解吸率综合效果好的大孔树脂进行后续纯化工艺的研究。
1.3.5 静态吸附实验
1.3.5.1 静态动力学吸附研究
准确称取质量为1.0 g的大孔树脂,置于50 mL锥形瓶中,再加入30 mL锥栗壳色素溶液,置于恒温振荡箱中,设置温度30℃,转速150 r/min,充分振荡。每隔15 min从中快速移取1 mL溶液,用40%乙醇溶液准确定容至5 mL,测定吸光值,绘制静态吸附动力学曲线。
1.3.5.2 色素溶液pH值对D101树脂吸附效果的影响
准确称取7份1.0 g大孔树脂,分别置于7个50mL锥形瓶中,分别调节色素溶液pH值为2.0、3.0、4.0、5.0、6.0、7.0、8.0,再分别加入 10 mL 色素溶液,置于恒温振荡箱中,设置温度30℃,转速150 r/min,充分振荡120 min。过滤后测定色素溶液的吸光值A1,根据1.3.4中的式(1)计算不同pH值下树脂的吸附率。
1.3.5.3 温度对D101树脂吸附效果的影响
准确称取5份1.0g大孔树脂,分别置于5个50mL锥形瓶中,再分别加入20 mL色素溶液,设置转速150 r/min,分别于 20、30、40、50、60 ℃的恒温振荡箱中振荡吸附,每隔20 min测定上层液的吸光值,绘制不同温度下锥栗壳色素溶液的吸附曲线。
1.3.5.4 乙醇浓度对D101树脂解吸效果的影响
准确称取7份1.0 g大孔树脂,置于7个50 mL锥形瓶中,分别加入10 mL色素溶液。设置温度30℃,转速150 r/min,置于恒温振荡箱中充分振荡120 min,待树脂基本吸附饱和后,抽滤弃去滤液,留下吸附饱和的树脂,分别加入10 mL浓度为50%、60%、70%、80%、90%、95%、100%的乙醇溶液,充分振荡解吸24 h(温度30℃,转速150 r/min)。解析后测定滤液的吸光值,对比不同浓度的乙醇溶液对大孔树脂的解吸效果。
1.3.6 动态吸附试验
1.3.6.1 吸附柱径高比对吸附效果的影响
适宜的吸附柱径高比有利于提高色素的分离效率[17]。将充分活化的大孔湿树脂分别以 1∶7、1∶8、1∶9、1∶10的柱径高比进行装柱,配制适当浓度及pH 4.0的色素上样液,调节层析柜温度40℃,采用1.0 mL/min的流速进行上样。每5 mL收集一管流出液,测定其吸光度。当流出液的吸光值达到上样液吸光值的10%时,被称作为泄露点,表明大孔树脂已经吸附饱和,即可停止上样,绘制不同柱径高比对锥栗壳色素溶液的吸附曲线。
1.3.6.2 上样流速对吸附效果的影响
用充分活化的大孔湿树脂按1.3.6.1确定的最佳柱径高比进行装柱。配制0.100 mg/mL、pH 4.0的色素上样液,调节层析柜温度40℃,分别以0.5、1.0、1.5、2.0 mL/min流速流过树脂,每5 mL收集一管流出液,测定其吸光度。同1.3.6.1待大孔树脂吸附饱和后停止上样,绘制不同上样流速对锥栗壳色素溶液的吸附曲线。
1.3.6.3 上样浓度对吸附效果的影响
用充分活化的大孔湿树脂按1.3.6.1确定的最佳柱径高比进行装柱。配制浓度分别为0.075、0.100、0.125、0.150 mg/mL锥栗壳色素溶液,调节pH 4.0,以1.3.6.2确定的最佳流速上样。每5 mL收集一管流出液,测定其吸光度。同1.3.6.1待大孔树脂吸附饱和后停止上样,绘制不同上样浓度对锥栗壳色素溶液的吸附曲线。
1.3.6.4 洗脱流速对解吸效果的影响
用充分活化的大孔湿树脂按1.3.6.1确定的最佳柱径高比进行装柱。配制pH 4.0的锥栗壳色素溶液,以1.3.6.2确定的最佳流速上样,色素溶液流经大孔树脂至其饱和。再用蒸馏水上样,洗除树脂外表面的残留色素。洗涤完毕,待无蒸馏水流出,再用80%乙醇溶液分别以0.5、1.0、1.5、2.0 mL/min流速洗脱,每5 mL收集一管流出液,测定其吸光度。当吸光度为零时停止洗脱,绘制吸附饱和大孔树脂在不同洗脱液流速下的解吸曲线。
1.3.6.5 D101大孔树脂动态吸附的正交试验
根据单因素试验数据,以色素吸附率为评价指标,进行正交设计。正交试验和因素水平见表2。

表2 正交试验因素与水平Table 2 Orthogonal test factors and levels
1.3.7 纯化前后色素的性质对比[14]
分别对1.3.1即乙醇恒温回流提取的色素干品和大孔树脂纯化后的色素液经浓缩、干燥处理得到的色素干品进行色价测定,具体操作为:分别准确称取纯化前后锥栗壳色素0.1 g,用蒸馏水定容至100 mL,从中移取10 mL,再定容至100 mL,用1 cm比色皿在最大吸收波长277 nm处测定锥栗壳色素的吸光值。色价计算公式如下:

式中:A为吸光度;R为100 mL溶液需稀释至适合测定吸光值的倍数;M为100 mL溶液中所含色素干品的质量,g。
称取相同质量的纯化前后的锥栗壳色素,分别配成溶液,观察它们的水溶性、色泽及稳定性。
2 结果与讨论
2.1 大孔吸附树脂的筛选
采用7种大孔树脂对锥栗壳色素进行静态吸附,其吸附和解析性能如表3所示。

表3 不同大孔树脂的吸附和解吸性能比较Table 3 Comparison of adsorption and desorption capacity between different macroporous resins %
影响大孔树脂吸附性能的因素较多,如树脂的极性、树脂的比表面积、树脂孔径等。通常树脂的极性与被吸附分子的极性相同或者近似时效果较好;树脂比表面积大时吸附效果较好;树脂孔径与被吸附分子大小是5倍关系时吸附性更佳[9],因此选择树脂要多因素综合考虑。本研究选取了非极性、弱极性、中极性3种类型的不同比表面积及孔径大小的树脂进行静态吸附试验,由表3可知,在7种大孔树脂中,D101吸附率最高,X-5和 XAD-7次之,DA-201、AB-8和 NKA-9吸附效果较差,吸附率均低于40%;DA-201虽解吸效果最佳,但其吸附率较低,D101的解吸效果次之,且与DA-201解析率比较接近。D101树脂的比表面积较大,利于色素的扩散吸附与洗脱,且可能由于锥栗壳色素中主要成分的极性与D101树脂的极性相似,因此D101树脂对锥栗壳色素的吸附与解析效果均较好。综合考虑,选取D101树脂进行后续的静态及动态的吸附和解吸试验。
2.2 D101大孔树脂静态吸附研究
2.2.1 D101大孔树脂静态动力学吸附研究
D101大孔树脂静态动力学吸附曲线如图2所示。
由图2可知,色素溶液的吸光值随着D101树脂吸附时间的延长呈下降趋势。当吸附120 min后,吸光值随时间增加变化不大,吸附曲线趋于平缓,说明此时树脂基本达到吸附饱和平衡。
2.2.2 色素溶液pH值对D101大孔树脂吸附效果的影响
调整锥栗壳色素溶液的pH值,考察D101树脂对色素吸附效果的影响,结果如图3所示。
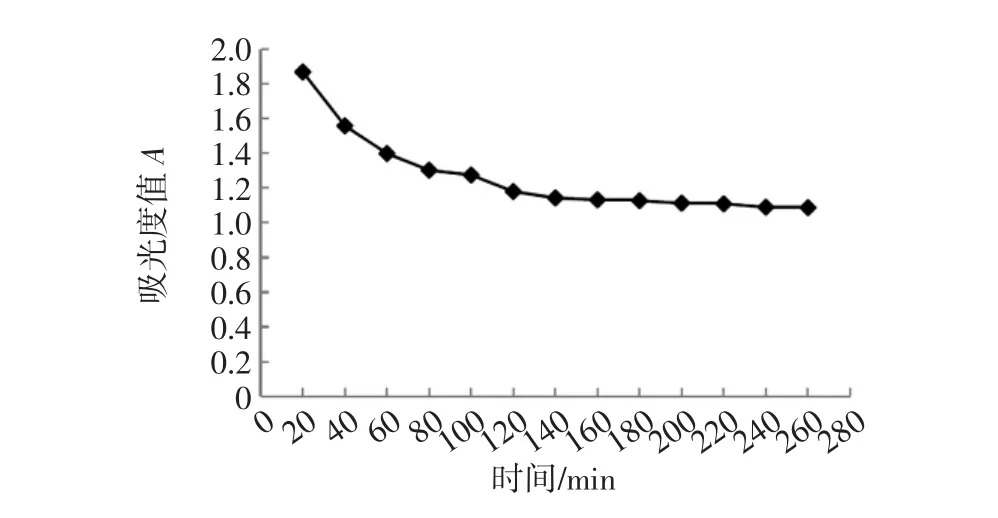
图2 树脂静态动力学吸附曲线Fig.2 The curve of resin static kinetic adsorption

图3 不同pH值下D101树脂的吸附性能Fig.3 Adsorption capacity of D101 under different pH values
由图3可看出,锥栗壳色素的吸附率随着pH值升高呈先增加后降低的趋势,当色素溶液pH值为4时,D101大孔树脂对色素的吸附率最高,达到88.44%;当pH值低于4时,树脂吸附率虽较高,但色素溶液颜色浅,显色效果差,这是由于酸性的洗脱液使大孔树脂呈一定程度的失水,从而增大树脂孔径,使得锥栗壳色素从树脂孔中逃逸,且pH值过低会使大孔树脂过度紧缩,阻碍了色素的逃逸,致使解析率降低[18];pH值较高,通常需要加酸,工业化生产中会增加对设备的腐蚀[19];当pH值超过4时,随pH值的增加,吸附率逐渐降低,说明pH值越高,色素越不稳定,pH值超过7后,吸附率变化趋于平缓。因此,样液pH值选取4.0为宜。
2.2.3 吸附温度对D101大孔树脂吸附效果的影响
吸附温度对D101大孔树脂吸附效果影响如图4所示。
由图4可知,在设定的温度范围内,随着吸附时间的延长,D101型大孔树脂对锥栗壳色素溶液的吸附率均呈明显的上升趋势。在吸附时间为100 min时,20、30、40℃对应的吸附率非常接近;随着温度升高,分子运动加剧导致分子与树脂间形成的氢键易断开,吸附率会下降[20],因此50、60℃最终的吸附率相较于40℃的低。因此,吸附温度选取40℃为宜。

图4 吸附温度对大孔树脂吸附效果的影响Fig.4 Influence of temperature on adsorption of macroporous resin
2.2.4 乙醇浓度对D101大孔树脂解吸效果的影响
乙醇浓度对大孔树脂解吸效果的影响如图5所示。

图5 不同乙醇浓度条件下D101大孔树脂的解吸率Fig.5 Desorption rate of D101 resin under different ethanol concentration
由图5可知,乙醇溶液对D101大孔树脂有较好的解吸效果,解析率随着乙醇浓度的增大而增大。当乙醇溶液浓度为80%时,解吸率达85.11%,继续增加乙醇浓度,解吸率变化不大,趋于平缓。因此,从解吸效果以及节省乙醇考虑,乙醇洗脱浓度选取80%为宜。
2.3 D101大孔树脂的动态吸附研究
2.3.1 柱径高比对D101树脂吸附效果的影响
柱径高比对D101树脂吸附效果的影响如图6所示。
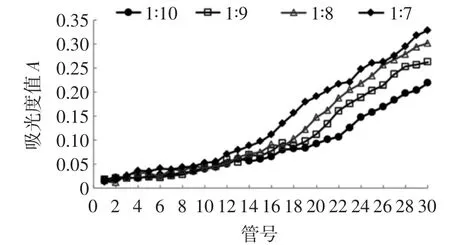
图6 柱径高比对色素吸附效果的影响Fig.6 The impact of mean-diameter blade length ratio on the adsorption effcct
由图6所示,当柱径高比为1∶7时,在第21管出现泄漏点,达到泄露点时间过早,色素吸附量较少;当柱径高比为1∶10时,在第29管出现泄漏点,达到泄漏点的时间过久。在实际生产中,会导致生产周期过长和工作效率低下等问题,不利于规模生产;当柱径高比为1∶8时,在第23管出现泄漏点;当柱径高比为1∶9时,在第25管出现泄漏点,达到泄漏点的时间适宜。因此,柱径高比选择1∶9为宜。
2.3.2 上样流速对D101树脂吸附效果的影响
上样流速对D101树脂吸附效果的影响如图7所示。

图7 上样流速对色素吸附效果的影响Fig.7 The impact of sample velocity on the adsorption result
上样流速差异,导致色素分子在D101大孔树脂内部的扩散作用差异,因此样液的上柱流速对吸附效果影响较大。当上样浓度相同时,流速越快,色素分子还未扩散到树脂内部而直接流走,容易造成泄漏现象,通常以泄漏点最迟出现的吸附流速为最佳控制流速[16]。
由图7所示,当上样液流速为2 mL/min时,在第21管出现泄漏点。这是由于流速快,色素分子与树脂作用时间太短,因此树脂无法有效吸附色素,一方面降低吸附效率,另一方面造成色素浪费;当流速为0.5 mL/min时,达到泄漏点的时间过久,延长生产周期,降低工作效率,不利于实际生产;当流速为1、1.5 mL/min时,分别在第25管、22管出现泄漏点。因此,吸附流速选择1 mL/min为宜。
2.3.3 上样浓度对D101树脂吸附效果的影响
上样浓度对D101树脂吸附效果的影响如图8所示。

图8 上样浓度对色素吸附效果的影响Fig.8 The impact of sample concentration on the adsorption effect
由图8所示,当上样液浓度为0.15 mg/mL和0.125 mg/mL时,分别在第16管和第19根管出现泄漏点。由于上样液浓度过高,在短时间内,树脂吸附已达到饱和状态,树脂无法继续吸附色素,造成色素流出;当浓度为0.075 mg/mL时,在第28管出现泄漏点,时间过长且色素的吸附量少;当浓度0.100 mg/mL时,在第25根管出现泄漏点。因此,选择吸附浓度0.100 mg/mL为宜。
2.3.4 洗脱液流速对D101树脂解吸效果的影响
洗脱液流速对D101树脂解吸效果的影响如图9所示。

图9 洗脱液流速对解吸效果的影响Fig.9 The impact of eluent flow rate on the desorption effect
由图9所知,吸附饱和的大孔树脂随着洗脱的进行,洗出液的吸光值逐渐增加,现象观察发现树脂颜色由棕色逐渐变浅,流出液的颜色不断变深,说明洗出液中的色素不断增多;当吸光值达到顶峰时,随即迅速下降,最终解吸液变清澈透明状态,说明洗脱完成。与吸附原理类似,流速为2.0 mL/min时,洗脱液与树脂的作用时间过短,色素洗脱不完全,富集获得的色素较少;流速为0.5 mL/min与1.0 mL/min的洗脱效果相似,但大规模生产时,采用1.0 mL/min的洗脱流速,生产效率和富集效果更佳。
2.4 正交试验结果
正交试验结果见表4。

表4 正交试验结果分析Table 4 Orthogonal experiment result analysis

续表4 正交试验结果分析Continue table 4 Orthogonal experiment result analysis

表5 色素吸附率方差分析Table 5 Variance analysis of pigment adsorption rate
通过极差分析可知3个因素对锥栗壳色素吸附纯化效果影响的大小顺序为:上样浓度>上样流速>柱径高比。方差分析结果表明,C为主要影响因素,具有显著性差异(P<0.05),A、B因素均无显著性差异(P>0.05)。根据正交试验结果确定锥栗壳色素的最佳动态吸附纯化工艺为:A3B2C2,即柱径高比为1∶10,上样流速为1.5mL/min,上样浓度为0.100mg/mL。在此工艺条件下进行验证试验,锥栗壳色素的吸附率达到92.88%,高于表4中正交设计各组试验的结果,因此确定其为锥栗壳色素动态吸附纯化的最佳工艺条件。
2.5 锥栗壳色素纯化前后的性质对比
锥栗壳色素纯化前后的性质对比见表6。

表6 色素纯化前后性质对比Table 6 Properties contrast of pigment before and after purification
由表6可知,经D101大孔树脂的吸附纯化,锥栗壳色素的色价由31.2变为74.3,纯度提高1.38倍,说明D101树脂对锥栗壳色素的纯化效果较佳;纯化后色素的水溶性较前者佳,溶液呈深红棕色、澄清透亮、稳定性好。与刘平等[14]得出的板栗壳色素纯化前后性质类似,但本研究中粗提色素及纯化色素的色价均高于相应的板栗壳色素,且锥栗壳纯化色素的色价较粗提色素的增加幅度也高于板栗壳色素。
3 结论
在选用的7种大孔树脂中,以吸附率和解吸率为考察指标,发现D101的综合效果最佳,筛选D101进行后续的静态和动态吸附实验。静态吸附实验结果表明:当锥栗壳色素溶液pH为4时,D101树脂吸附效果最佳;吸附时间延长,温度升高,吸附率下降,考虑生产成本,选用40℃为最佳吸附温度;从解吸效果以及节省乙醇考虑,选取乙醇溶液浓度80%作为最佳解吸浓度,对应解吸率达85.11%。动态吸附正交试验结果表明:上样浓度是影响吸附效果的最主要因素,确定D101大孔树脂对锥栗壳色素吸附纯化的最佳工艺条件为:柱径高比1∶10,上样流速1.5 mL/min,上样浓度0.100 mg/mL。在此工艺条件下进行验证试验,锥栗壳色素的吸附率达到92.88%。洗脱流速以1.0 mL/min为佳。经D101大孔树脂纯化,锥栗壳色素的色价由31.2提高至74.3,纯度提高1.38倍,表明D101大孔树脂对锥栗壳色素的纯化效果较好。纯化后色素的溶解性较纯化前佳,溶液呈深红棕色、澄清透亮、稳定性好。
本试验操作较简单,成本较低,经济环保且能达到较好的分离纯化效果,因此D101树脂用于锥栗壳色素的分离纯化具有推广应用的价值。后续研究可对大孔树脂分离纯化法得到的纯化色素与传统纯化方法如醇沉法、酸沉法等得到的纯化色素进行比较,测定其色价是否高于传统纯化方法,并进行D101型树脂的再生性实验。
[1] 周玉杰,李安平,梁振英,等.带壳即食锥栗加工工艺研究[J].食品科技,2015,40(5):134-135
[2] 张发备.锥栗高产栽培技术[J].福建农业科技,2011(1):31-32
[3] 蔡可柳.锥栗乌壳长芒品种的特征特性及栽培要点.[J].浙江农业科学,2009,1(2):278,281
[4]魏剑生.建瓯锥栗亩产十年翻四倍[EB/OL].(2015-10-31).http://news.ifeng.com/a/20151031/46062293_0.shtml.
[5]陈世平.建瓯市锥栗深加工产业快速发展[J].中国果业信息,2012,29(9):48-49
[6] 刘辉,魏剑生.建瓯锥栗:名品如何变名牌?[N].福建日报,2017-10-31(06)
[7] 黄艳,黄晓菲,吴琳珊,等.响应面法优化恒温-回流提取锥栗壳色素工艺[J].食品安全质量检测学报,2018,9(4):897-904
[8] 黄俊娴,梁荣选,杨建男.天然色素的提取方法和应用[J].广东化工,2006,33(6):63-66
[9] 徐青,卢莹莹,辛建美,等.大孔树脂吸附分离海芦笋中黄酮类化合物工艺[J].食品科学,2011,32(2):115-119
[10]孟维,李湘洲,吴志平,等.AB-8型大孔吸附树脂分离纯化茶皂素工艺[J].食品科技,2013(9):224-228
[11]王锋,谭兴和,郭时印,等.大孔树脂纯化黑花生衣色素的研究[J].湖南农业大学学报(自然科学版),2007,33(4):500-505
[12]展亚莉,刘晓波,展康华,等.大孔树脂吸附法纯化精制板栗壳天然棕色素的研究[J].中国食品添加剂,2015(5):105-109
[13]张海晖,段玉清,李金凤,等.板栗壳中原花青素大孔吸附树脂分离纯化工艺优化[J].农业机械学报,2011,42(5):156-159,155
[14]刘平.板栗壳棕色素提取、纯化及抗氧化性的研究[D].武汉:武汉工业学院,2008:28-40
[15]王金玲,姚丽敏,旷慧.榛子壳棕色素的分离纯化及其理化性质的研究[J].食品与生物技术学报,2016,35(7):770-777
[16]姚丽敏,旷慧,张龙.大孔树脂纯化榛子壳棕色素粗提液的研究[J].食品工业科技,2014,35(20):317-321
[17]唐红,谭沙,吴栋.大孔树脂分离红花中羟基红花黄色素A的优化工艺[J].广州化工,2017,45(8):50
[18]周俊良,沈佳奇,马玉华,等.大孔树脂吸附法纯化火龙果皮甜菜色素工艺[J].贵州农业科学,2017,45(4):112-115
[19]赵昕,常晓娟,展亚莉,等.大孔树脂分离纯化黑胡萝卜红色素的研究[J].中国食品添加剂,2017(3):68-73
[20]王金亭,鞠秀萍,吴广庆.大孔吸附树脂纯化紫荆花红色素的研究[J].食品研究与开发,2009,30(4):49-53
