4种大孔吸附树脂对阿胶低聚肽的脱苦效果研究
2018-07-04魏芳周祥山田守生刘海峰张建岭郭晓飞郭兴峰
魏芳,周祥山,田守生,刘海峰,张建岭,郭晓飞,郭兴峰,,*
(1.聊城大学农学院,山东聊城252000;2.东阿阿胶股份有限公司,山东聊城252201)
阿胶(Colla corii asini)为马科动物驴(Equus asinus L.)的干燥皮或鲜皮经煎煮、浓缩制成的固体胶,属我国传统名贵滋补类中药,也是卫生部规定的药食两用资源[1]。阿胶可追溯到2500多年以前,在《神农本草经》、《伤寒杂病论》、《本草经集》、《名医别录》《齐民要术》、《本草纲目》等众多中医著作中均有记载,具有补气养血、滋阴润燥等功效,被誉为补血圣药,与人参、鹿茸一起称为“中药三宝”[2-3]。现代研究表明:阿胶含有胶原蛋白、肽和多种微量元素,对人体的血液系统、心脑血管系统、免疫系统等均具有重要作用[4-6]。传统阿胶块炮制服用方法繁琐且不易吸收,对于脾胃虚弱,消化能力低下的血虚、贫血病人,阿胶药效得不到充分发挥,因此,阿胶素有“滋腻碍胃”之说[7]。
通过现代酶解技术将阿胶中的胶原蛋白水解为阿胶低聚肽是解决阿胶食用繁琐、携带不便、吸收率低等问题的有效途径,也是传统中药现代化的有效途径[7]。阿胶低聚肽与众多其他来源多肽相似,均具有较重的苦味[8-11]。如何降低苦味就成为多肽风味改善的重点和难点[8,10,12-13]。目前,多肽的苦味脱除方法大体有:选择分离法、掩盖法、酶法、微生物法等[14]。选择分离法是一种采用吸附、萃取、沉淀、色谱分离等方法将蛋白酶解液中具有苦味的多肽予以除去的方法。其中,树脂分离法因具有吸附性能好、比表面积大等优点,目前已广泛应用于生物制药及天然植物活性成分的提取分离中[15-17]。
以阿胶低聚肽为原料,通过静态、动态吸附和解吸试验,考察了AB-8、DA201-C、DA-201C和D101等4种不同规格的大孔吸附树脂对阿胶低聚肽的吸附、解吸和脱苦效果,并确定了最佳的脱苦工艺,应用高效液相色谱(high performance liquid chromatography,HPLC)和高效凝胶渗透色谱(high performance gel permeation chromatography,HPGPC)研究了分离前后样品氨基酸组成和分子量分布的差别,旨在为阿胶低聚肽的脱苦提供理论依据,同时为低苦味阿胶低聚肽产品的进一步开发奠定基础。
1 材料与方法
1.1 材料与试剂
阿胶低聚肽原粉:东阿阿胶股份有限公司;DA-201C、AB-8、D-101型大孔吸附树脂(孔径8 nm~10 nm):天津浩聚树脂科技有限公司;DA201-C型大孔吸附树脂(孔径10 nm):郑州华溢科技新材料股份有限公司;95%乙醇:莱阳经济技术开发区精细化工厂;盐酸:烟台市双双有限公司;无水醋酸钠(分析纯):吴江市华顺精细化工有限公司;冰醋酸(分析纯):湖北兴银河精细化工有限公司;乙腈(色谱纯):山东丰仓化工有限公司。
1.2 仪器与设备
KQ5200DE型数控超声波清洗器:昆山市超声仪器有限公司;SHZ-D(III)循环水式多用真空泵:郑州博科仪器设备有限公司;大孔吸附树脂用层析柱;OSB-2100式旋转蒸发仪:上海爱郎仪器有限公司;FD-1C-50式真空冷冻干燥机:北京博医康试验仪器有限公司;ME204/02式电子分析天平:梅特勒-托利多仪器(上海)有限公司;LC-100高效液相色谱仪:合肥捷岛科学仪器有限公司;Vensil-AA氨基酸分析方法包(Vensil-AA氨基酸分析专用柱、异硫氰酸苯酯、三乙胺、氨基酸标准溶液、正亮氨酸):天津博纳艾杰尔科技有限公司。
1.3 方法
1.3.1 树脂的预处理
将不同型号的大孔吸附树脂先用一定量的无水乙醇浸泡24 h,使其充分溶胀,然后将树脂装柱,用4~5倍床层体积的无水乙醇以2 BV/h~3 BV/h的流速通过树脂,至流出液在220 nm处无吸收峰,再用去离子水以3 BV/h~4 BV/h的流速冲洗至无乙醇味备用[18]。
1.3.2 静态吸附及解吸试验
1.3.2.1 静态吸附试验
于250 mL具塞锥形瓶中分别加入50 g预先处理过的树脂,再加入100 mL浓度为0.2 g/mL的阿胶低聚肽溶液。用塞子封好后放入20℃的恒温摇床中振荡3 h(140次/min),从摇床上取出静置 3 h[19]。每隔半小时搅拌一次,使吸附完全。将每个锥形瓶中的溶剂分别进行抽滤并用50 mL去离子水洗涤,把抽滤得到的滤液进行浓缩、冷冻干燥、称重,并按下式计算吸附当量。抽滤剩下的干燥固体树脂收集备用。
吸附当量/(mg/g)=吸附量/干树脂质量
1.3.2.2 静态解吸试验
将经静态吸附后得到的干燥固体树脂分别置于500 mL具塞锥形瓶中,各加入200 mL无水乙醇。用塞子封好后放入20℃的恒温摇床上振荡3 h(140次/min)。从摇床上取出,将锥形瓶中的溶剂进行抽滤。得到的溶液进行浓缩,冷冻干燥。将得到的干燥粉末进行称重,按下式计算解吸率。
解吸率/%=解吸量/吸附量×100
1.3.3 动态吸附及解吸试验
采用湿法装柱将经过预处理的大孔吸附树脂装入层析柱中,距柱口约3cm~4cm[20]。分别根据静态吸附及解吸试验结果,确定的每种树脂最佳上样量称取阿胶低聚肽粉末,按阿胶低聚肽粉末∶去离子水=1 g∶5 mL的比例加入去离子水。用磁力搅拌器搅拌20 min,超声波超声30 min。待阿胶低聚肽完全溶解后,将其缓慢加入到装好的柱子中。分别用25%乙醇和95%乙醇以1 BV/h~2 BV/h的速度洗脱4种大孔吸附树脂,得到的流出液分别按瓶进行收集、浓缩、冷冻干燥。并将得到的干燥固体粉末进行称重,按下式计算每种大孔吸附树脂动态吸附及解吸后的回收率。
回收率/%=总回收量/上样量×100
1.3.4 苦味评价
目前,常用的口尝苦味评价方法有排序法、评分法、排序加评分法[21]。本文采用排序法和评分法对阿胶低聚肽溶液的苦味进行评价,苦味评价方法均参照文献[21]。
1.3.4.1 排序法
将25%乙醇分别洗脱4种大孔吸附树脂得到的干燥固体粉末配制成浓度为2%的样品溶液,95%乙醇洗脱树脂得到的干燥固体粉末配制成浓度为1%的样品溶液。
以6个感官评价员为一组,每名感官评价员需分别评定两组共8个样品。每组样品评定的时间间隔40 min,每个样品间隔时间为2 min~3 min。评价员在感官评定前2小时禁食,感官评价前用水漱口,取少量溶液放入口中,使样品充分与味蕾接触,15 s后吐出漱口,并按照品尝到的苦味大小按从大到小的顺序排列。
1.3.4.2 评分法
以盐酸奎宁为参比,将配制好的样品溶液分别与浓度为 1.0×10-4、9.0×10-5、8.0×10-5、7.0×10-5、6.0×10-5、5.0×10-5、4.0×10-5、3.0×10-5、2.0×10-5、1.0×10-5g/mL 的盐酸奎宁做对比,其苦味值分别定为10~1。每位感官评价员按品尝到的苦味强度进行打分并取平均值[22]。
1.3.5 阿胶低聚肽分子量分布的测定
阿胶低聚肽分子量分布的测定参考GB/T 22492-2008《大豆肽粉》中大豆肽粉的分子量分布的测定方法应用HPGPC进行测定。色谱条件:色谱柱TSK gel 2000 swxl 300 mm×7.8 mm,流动相:乙腈-水-三氟乙酸=45∶55∶0.1(体积比),检测波长:220 nm,流速:0.5 mL/min,柱温:30 ℃,进样量:10 μL。样品制备:以流动相为溶剂配制浓度为2 mg/mL的样品溶液并用0.45 μm微孔膜过滤后进样。标准样品:将乙胺酸-乙胺酸-乙胺酸(Mw=189)、乙胺酸-乙胺酸-酪氨酸-精氨酸(Mw=451)、杆菌酶(Mw=1450)、抑肽酶(Mw=6500)、细胞色素C(Mw=12500)配成混标,每种物质含量均为2 mg/mL。将5种标准样品按2 mg/mL配制,按照上述色谱条件测定并以lgMw为纵坐标,以保留时间为横坐标制作标准曲线,结果见图1。

图1 5种标准样品的HPGPC图谱及标准曲线Fig.1 HPGPC profiles of five standard samples
从图1中可以看到洗脱峰出现时所对应的洗脱时间分别为 12.749、14.041、16.871、19.104、20.767 min,以分子质量对数值与洗脱时间作图,求出直线的回归方程为:y=-0.227x+6.991(式中:x为洗脱时间,y为分子质量对数),其回归系数R2=0.963。
1.3.6 阿胶低聚肽中氨基酸分析
阿胶低聚肽中氨基酸种类和含量测定使用Venusil AA氨基酸分析方法包进行测定[23],分别精确称取80 mg~90 mg阿胶低聚肽及经DA201-C大孔吸附树脂分离后的样品于安瓿瓶中,加入6 mol/L盐酸,混匀,封口,110℃烘箱中水解24 h。取水解液浓缩至干燥,加入稀盐酸溶解后,用0.45 μm滤膜过滤,取过滤液贮于0~4℃冰箱中,供衍生使用。准确量取上述配制好的氨基酸标准溶液及样品溶液200 μL置于1.5 mL离心管中,依次加入正亮氨酸内标溶液、三乙胺乙腈溶液、异硫氰酸苯酯溶液,混匀,室温放置1 h,然后加入正己烷,振摇后放置10 min,取下层溶液用0.45 μm的针式过滤器过滤。取部分滤液用水稀释,摇匀,进样。色谱条件:Venusil AA氨基酸分析柱(4.6 mm×250 mm,5 μm),检测波长:254 nm;进样量:10 μL,柱温:40 ℃,流动相,A:称取15.2 g无水醋酸钠,加水1850 mL,溶解后用冰醋酸调pH值至6.5,然后加乙腈140 mL,混匀,用0.45 μm滤膜过滤。流动相B:80%(体积比)乙腈溶液,流速:1.0 mL/min,梯度洗脱,对经阿胶低聚肽分离前后的氨基酸进行分析。
2 结果与分析
2.1 4种大孔吸附树脂的静态吸附与解吸试验
不同型号大孔吸附树脂对阿胶低聚肽的吸附与解吸性能见表1。
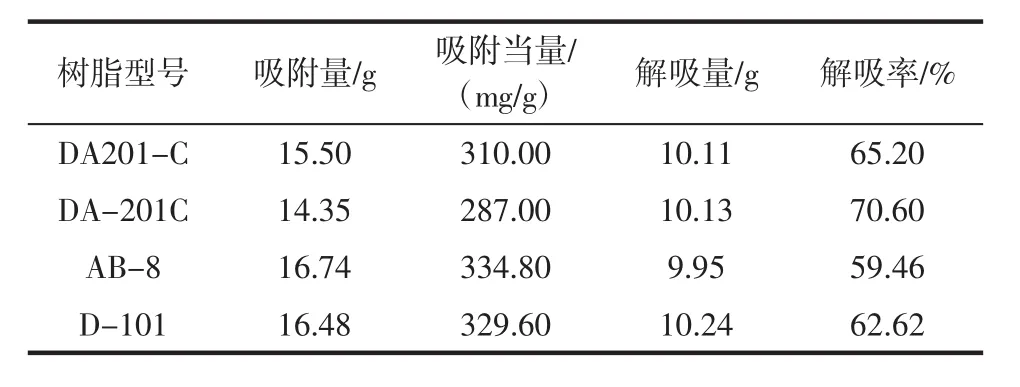
表1 不同型号大孔吸附树脂对阿胶低聚肽的吸附与解吸性能Table 1 Adsorption and desorption capabilities of Colla corii asini oligopeptides with different kinds of macroporous adsorptive resins
从表1可以看出,大孔吸附树脂AB-8的吸附当量最大,依次是D-101、DA201-C,最后是DA-201C。另外比较解吸率可知,DA-201C的解吸率均高于另外3种树脂。由于,AB-8、D-101和DA-201C3种树脂的解吸量和吸附量差别较大,不适用于阿胶低聚肽的分离。因此,结合吸附量和吸附当量的结果可知,大孔吸附树脂DA201-C对阿胶低聚肽的分离效果最好。
2.2 4种大孔吸附树脂的动态吸附与解吸试验
不同型号大孔吸附树脂对阿胶低聚肽的动态吸附性能结果见表2。

表2 不同型号大孔吸附树脂对阿胶低聚肽的动态解吸性能Table 2 Dynamic desorption capabilities of Colla corii asini oligopeptides with different kinds of macroporous adsorptive resins
由表2可以看出,4种大孔吸附树脂的洗脱率都达到了90%以上。而其中用25%乙醇洗脱所得组分占了上样量的大部分比例,用95%乙醇得到的洗脱量较小,可能是因为相对分子量较大的组分在95%乙醇中溶解度降低所致[24],同时说明通过大孔吸附树脂分离不会对样品造成较大的损失。
2.3 苦味的评价
2.3.1 排序法结果与分析
不同型号大孔吸附树脂分离阿胶低聚肽后各组分的苦味排序见表3。
由表3可知,大孔吸附树脂DA-201C用25%乙醇洗脱时得到的洗脱液苦味最重,D-101和AB-8次之,DA201-C的苦味最轻;而用95%乙醇洗脱组分中DA-201C苦味最轻,AB-8和D-101次之,DA201-C苦味最重。赵谋明等[25]认为,蛋白水解物苦味的产生,是由于蛋白质在水解过程中疏水性氨基酸残基暴露在多肽末端引起。因此,大孔吸附树脂DA201-C和AB-8能够较好的脱除阿胶低聚肽的苦味,是因为在一定比例乙醇洗脱时可以有的吸附一定量的疏水性氨基酸。

表3 经不同型号大孔吸附树脂分离阿胶低聚肽组分的苦味排序Table 3 The bitter sequence of fractions of Colla corii asini oligopeptides separated by different kinds of macroporous adsorptive resins
2.3.2 评分法结果与分析
不同型号大孔吸附树脂的评分结果见表4。

表4 不同型号大孔吸附树脂的评分结果Table 4 Results of different macroporous adsorptive resins
结合表3和表4可知,排序法与评分法的结果一致。从表4可以看出,当用25%乙醇洗脱DA201-C大孔吸附树脂时,得到的阿胶低聚肽组分苦味值最小,为1.3;DA-201C用95%乙醇洗脱时,苦味值为6.3。结合动态吸附与解吸的试验结果可知,DA201-C大孔吸附树脂具有最佳的脱苦效果。
2.4 分离前后阿胶低聚肽的分子量分布
通过前期分离和感官评价后发现DA201-C对阿胶低聚肽具有较好的脱苦效果,随后对分离前后的阿胶低聚肽分子量分布情况进行了分析。分析结果见图2和图3。

图2 原阿胶低聚肽的分子质量分布Fig.2 MolecularweightdistributionofCollacoriiasinioligopeptides

图3 乙醇洗脱后阿胶低聚肽的分子质量分布Fig.3 Molecular weight distribution of Colla corii asini oligopeptides ethanol elution
如图2所示,原阿胶低聚肽溶液中包含3个组分峰,洗脱时间分别出现在20.086、21.207、23.276 min,并根据标准曲线得出各峰的对应分子质量为270.07、150.32、50.97 Da。可见,原阿胶低聚肽的分子量分布在50.97 Da~270.07 Da之间。从图3中可以看出,经25%乙醇分离后的阿胶低聚肽溶液中包含4个组分峰,洗脱时间分别出现在 16.379、18.276、19.397、22.241 min,并根据标准曲线得出各峰的对应分子质量为1874.85、695.58、387.15、87.56 Da。经95%乙醇洗脱后的阿胶低聚肽样品溶液中主要包括3个组分峰,洗脱时间分别出现在 18.966、20.172、21.379 min,并根据标准曲线得出各峰的对应分子质量为484.97、258.20、137.39 Da。结合原阿胶低聚肽的分子量可知,25%乙醇和95%乙醇洗脱后得到的分子量有所增加,脱除了阿胶低聚肽中氨基酸类成分,提高了阿胶低聚肽纯度。
2.5 分离前后阿胶低聚肽氨基酸的成分变化
将经DA201-C大孔吸附树脂分离前后的阿胶低聚肽干粉进行氨基酸成分分析,比较分离前后各种氨基酸的含量变化,进一步验证其脱苦效果,结果见表5。

表5 不同洗脱组分的氨基酸组成Table 5 Total amino acid composition of desorbed fractions

续表5 不同洗脱组分的氨基酸组成Continue table 5 Total amino acid composition of desorbed fractions
不同组分亲水性氨基酸和疏水性氨基酸的含量见图4。

图4 不同组分亲水性氨基酸和疏水性氨基酸的含量Fig.4 Percentage of hydrophilic amino acids and hydrophobic amino acids in different fraction
从图4可以看出,用95%乙醇洗脱DA201-C大孔吸附树脂时,得到的疏水性氨基酸含量与原样相比最高,25%乙醇次之,水相最低。马铁铮等[14]认为疏水性氨基酸的含量与苦味值成正比,疏水性氨基酸的含量越高,苦味值越大。因此,95%乙醇洗脱得到的洗脱液苦味值最大,25%乙醇次之,水相最低。用水相和95%乙醇洗脱DA201-C大孔吸附树脂时,多数氨基酸的含量与原样相比均有明显变化;25%乙醇洗脱时,除苏氨酸的含量与原样相比大幅减少外,其余氨基酸的含量变化均不明显。因此,用25%乙醇洗脱DA201-C大孔吸附树脂,能较好的脱除阿胶低聚肽的苦味。
3 结论
本研究应用4种大孔吸附树脂对阿胶低聚肽进行脱苦研究,并对分离前后的分子量分布和氨基酸组成进行分析。结果表明:大孔吸附树脂DA201-C对阿胶低聚肽的脱苦效果优于其他3种树脂,且用体积分数为25%的乙醇作为流动相洗脱时,得到的洗脱液苦味较轻,洗脱率达到了91.07%。利用HPLC测得分离后阿胶低聚肽中的疏水性氨基酸含量比分离前低,分子量分布在87.56 Da~1874.85 Da之间。该研究为阿胶低聚肽脱苦提供了理论依据,也为阿胶低聚肽的进一步开发和应用奠定了基础。
[1] 国家药典委员会.中华人民共和国药典:2010年版一部[M].北京:中国医药科技出版社,2010:175
[2]张喆,胡晶红,李佳,等.阿胶基本属性管见[J].中成药,2014,36(9):2000-2001
[3] 吴海燕,孙佳明,张辉.阿胶的研究进展[J].吉林中医药,2016,36(1):57-60
[4] 吴宏忠,杨帆,崔书亚,等.阿胶有效组分对辐射损伤小鼠造血系统的保护作用研究[J].中国临床药理学与治疗学,2007,12(4):417-421
[5] 崔金玉,贾天柱.阿胶及不同炮制品的药理作用研究[J].中成药,2008,30(12):1841-1842
[6] 李志,陈壁锋,黄俊明,等.阿胶口服液对小鼠细胞免疫和体液免疫功能的影响[J].中国卫生检验杂志,2008,18(7):1426-1427
[7] 田景振.阿胶低肽制备工艺及其质量控制方法研究[D].长沙:湖南中医药大学,2008:1-2
[8]Favaro-Trindade C S,Santana A S,Monterrey-Quintero E S,et al.The use of spray drying technology to reduce bitter taste of casein hydrolysate[J].Food Hydrocolloids,2010,24(4):336-340
[9]Gianiandrea L,Antonio L J,Elietevazde F,et al.Taste modification of amino acids and protein hydrolysate by α-cyclodextrin[J].Food Research International,2009,42(7):814-818
[10]Newman J,O'Riordan D,Jacquier J C,et al.Masking of bitterness in dairy protein hydrolysates:Comparison of an electronic tongue and a trained sensory panel as means of directing the masking strategy[J].LWT-Food Science and Technology,2015,63(1):751-757
[11]Spellman D,O'Cuinn G,Fitzgerald R J.Bitterness in Bacillus proteinase hydrolysates of whey proteins[J].Food Chemistry,2009,114(2):440-446
[12]SahaB C,Hayashi K.Debittering of protein hydrolyzates[J].Biotechnology Advances,2001,19(5):355-370
[13]Fitzgerald R J,O'Cuinn G.Enzymatic debittering of food protein hydrolysates[J].Biotechnology Advances,2006,24(2):234-237
[14]马铁铮,王强,周素梅.蛋白短肽苦味成因与脱苦技术研究进展[J].中国粮油学报,2008,23(6):220-226
[15]潘道东,林璐.DA201-C大孔吸附树脂静态吸附ACE抑制肽的研究[J].食品科学,2009,30(5):20-23
[16]朱洁,王红宝,孔佳君,等.梨幼果多酚的纯化及其抗氧化性[J].食品科学,2017,38(5):14-20
[17]张旋,韩韬,颜廷才,等.浓香型原酒中塑化剂的吸附剂筛选[J].食品科学,2017,38(5):92-97
[18]王双,王昌涛,韩扬.燕麦ACE抑制肽的分离纯化及其活性研究[J].食品科学,2010,31(24):222-229
[19]马寒冰,廖永红,徐曼,等.DA201-C大孔吸附树脂纯化大豆多肽条件优化[J].中国调味品,2014,39(9):43-48
[20]王忠震,林兵,昊霞,等.大孔吸附树脂纯化雷公藤4种有效成分的工艺研究[J].中国药房,2016,27(16):2261-2264
[21]刘瑞新,张杏芬,李学林,等.3种口尝评价方法用于药物苦度评价的比较[J].中国试验方剂学杂志,2013,19(20):118-122
[22]谷宇,刘艳,涂钰,芦明春.高收率低苦味值大豆低聚肽的制备[J].中国酿造,2014,33(4):87-89
[23]杨彬,阮长春,刘志,等.柱前衍生-反相高效液相色谱法测定柞蚕蛹蜕中氨基酸[J].食品科学,2010,31(16):213-216
[24]宫霞,赵骏.大孔吸附树脂对酪蛋白酶解液的脱盐作用研究[J].食品科学,2006,27(11):301-303
[25]赵谋明,任娇艳,崔春,等.大孔吸附树脂静态吸附草鱼蛋白水解物中氨基酸的研究[J].食品与发酵工业,2006,32(4):22-26
