响应面法优化红薯叶中绿原酸的提取工艺及动力学分析
2018-07-04何春玫梁宇宁项有泳
何春玫,梁宇宁,项有泳
(1.广西农业职业技术学院,广西南宁530007;2.广西师范大学,广西桂林541004;3.防城港市广源农业开发有限公司,广西防城港538100)
红薯又称为甘薯、蕃薯、地瓜等,是我国主要粮食作物之一。广西红薯种植面积一直稳定在26.7万hm2左右,近年来,由于技术推广和品种更新,年产量达600万t,产值以每年5%的速度增加[1],红薯叶资源十分丰富。
绿原酸对人体具有清除自由基、抗菌消炎、利胆清热等作用,是许多中草药的有效药理成分之一[2]。当前,国内有学者研究了从金银花、杜仲、牛蒡、红薯叶根等植物中提取绿原酸[3-10],文献多集中于对不同提取工艺的优化,关于绿原酸提取动力学研究的报道较少。本试验在前人研究的基础上,以烘干的广西东兴市红姑娘红薯叶为原料,采用乙醇浸提法,通过Box-Behnken设计试验,优化提取工艺,并对提取过程建立动力学模型,为进一步利用红薯叶提供依据。
1 材料与方法
1.1 材料与仪器
1.1.1 材料
东兴市红姑娘红薯叶:由防城港市广源农业开发有限公司红姑娘红薯种植示范基地提供。
1.1.2 主要试剂
绿原酸标准品:合肥博美生物科技有限责任公司;无水乙醇、石油醚、盐酸(均为分析纯):西陇化工股份有限公司。
1.1.3 主要仪器
AL204电子天平:梅特勒-托利多仪器(上海)有限公司;DH-400S型电热恒温干燥箱:上海跃进医疗器械有限公司;800B台式离心机:上海安亭科学仪器厂;JP-1000B多功能粉碎机:永康市久品工贸有限公司;VIS-722型可见光分光光度计:北京瑞利分析仪器有限公司。
1.2 试验方法
1.2.1 绿原酸标准曲线的绘制
准确称取绿原酸标准品2.5 mg,以适量无水乙醇溶解后定容于25 mL容量瓶中,得绿原酸标准溶液。准确吸取 0、1、2、3、4、5 mL 上述标准液,用无水乙醇稀释并定容至25 mL,所得绿原酸系列工作液分别相当于0、4、8、12、16、20 μg/mL 的绿原酸标准液。在 200 nm~400 nm波长下对绿原酸标液进行扫描,在328 nm处出现最大吸收波长。以无水乙醇为参比,测标准系列的A328,以吸光度A328为纵坐标、绿原酸浓度为横坐标绘制标准曲线并拟合回归方程,如图1所示。

图1 绿原酸标准曲线Fig.1 Standard curve of chlorogenic acid
由图1可见,绿原酸浓度在0~20 μg/mL范围内与A328值呈现良好的线性关系。
1.2.2 绿原酸的提取工艺及提取率的计算
将新鲜的红薯叶洗净晾干后,于60℃烘干,粉碎过40目筛,备用。准确称取1.0 g红薯叶粉,石油醚处理去除色素等杂质,离心,沉淀按料液比1∶20(g/mL)加入乙醇溶液,加HCl溶液调整溶液pH值,在一定的温度下,回流提取一定时间,抽滤,定容至200 mL。取提取液1.00 mL稀释至10 mL,以无水乙醇为参比,测定样品溶液的吸光度A328,根据1.2.1回归方程计算绿原酸浓度C,提取率。

式中:C为绿原酸浓度,μg/mL;V为定容体积,mL;n为稀释倍数;m为红薯叶粉质量,g。
1.2.3 绿原酸提取工艺优化设计
通过查阅文献资料发现,影响醇提红薯叶绿原酸的因素有前处理方法、乙醇浓度、pH值、提取温度、提取时间、料液比等[2,6-9],其中乙醇浓度、pH 值、提取温度、提取时间对提取率的影响较显著,拟固定料液比1∶20(g/mL),通过单因素试验考察乙醇浓度、pH值、提取温度、提取时间的影响水平,利用Design Expert 8.0软件进行Box-Behnken响应面优化试验方案设计,响应面试验因素水平表见表1。

表1 Box-Behnken响应面试验因素水平表Table 1 Factors and levels used in response surface design
1.2.4 绿原酸提取过程动力学分析
利用Origin Pro 8.0软件对试验数据进行模型拟合,并以Reduced Chi2、R2和Adj-R23个参数以及离散比较图评价数学模型的拟合程度。Reduced Chi2表示数据与拟合曲线的偏离程度;R2表示决定系数平方;Adj-R2为校正决定系数平方。
2 结果与分析
2.1 单因素试验结果
2.1.1 乙醇浓度对绿原酸提取率的影响
调整溶液pH值为5,提取温度为60℃,提取时间为30 min,用20%、40%、60%、80%、100%的乙醇溶液提取绿原酸,测定绿原酸提取率,结果如图2所示。

图2 乙醇浓度对绿原酸提取率的影响Fig.2 Effects of ethanol volume fraction on the extraction yield of chlorogenic acid
由图2可见,红薯叶中绿原酸的提取率随乙醇浓度的增加呈现先增大后减小的趋势,当乙醇浓度达60%时,绿原酸的提取率较高,超过60%后绿原酸的提取率略有下降,原因可能是浓度较大的乙醇溶液会加大溶出一些醇溶性杂质,这些物质竞争乙醇从而影响了绿原酸的溶出。因此后续试验选择乙醇浓度为60%。
2.1.2 溶液pH值对绿原酸提取率的影响
选择乙醇浓度为60%,提取温度为60℃,提取时间为 30 min,分别调整溶液 pH 值为 1、3、5、7、9 的乙醇溶液提取绿原酸,测定绿原酸提取率,结果如图3所示。
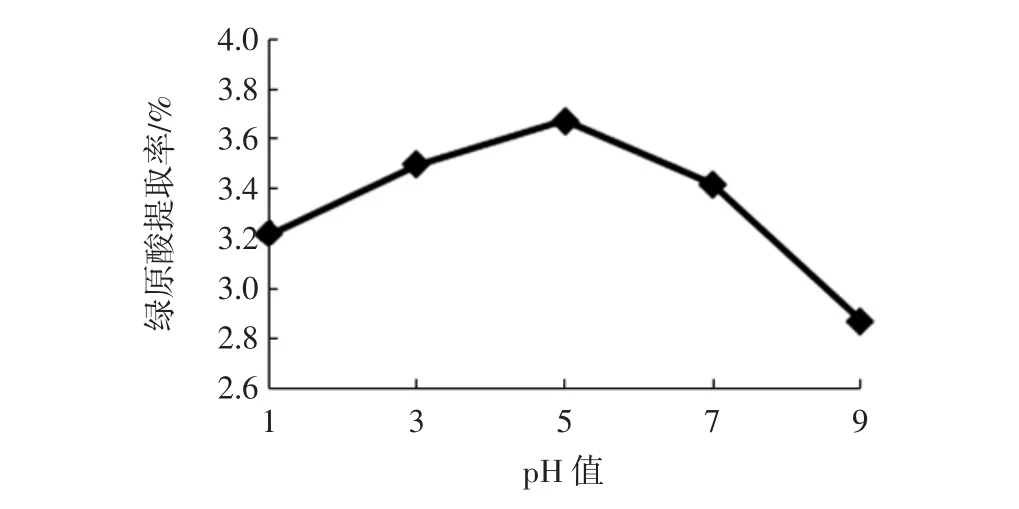
图3 溶液pH值对绿原酸提取率的影响Fig.3 Effects of pH on the extraction yield of chlorogenic acid
由图3可见,红薯叶中绿原酸的提取率随溶液pH值的增加呈现先略增加后快速减小的趋势,当溶液pH值为3~5时,提取率基本稳定,提取效果相当,随后提取率下降较快,原因可能是绿原酸是由咖啡酸与奎宁酸组成的一类缩酚酸[10],溶液pH值较大会加快绿原酸的水解而使提取率下降。因此,后续试验选择溶液pH值为5。
2.1.3 提取温度对绿原酸提取率的影响
固定乙醇浓度为60%,溶液pH值为5,提取时间为 30 min,选取提取温度分别为 20、40、60、80、100 ℃,测定绿原酸提取率,结果如图4所示。
由图4可见,红薯叶中绿原酸的提取率随提取温度的增加呈现先略增大后快速减小的趋势。60℃左右,提取率较高,当温度高于60℃,随着提取温度的升高,因高温破坏绿原酸,使得提取率下降较快。因此,后续试验选择提取温度为60℃。

图4 提取温度对绿原酸提取率的影响Fig.4 Effects of extraction temperature on the extraction yield of chlorogenic acid
2.1.4 提取时间对绿原酸提取率的影响
固定乙醇浓度为60%,溶液pH值为5,提取温度为 60 ℃,选取提取时间分别为 10、20、30、40、50 min,测定绿原酸提取率,结果如图5所示。

图5 提取时间对绿原酸提取率的影响Fig.5 Effects of extraction time on the extraction yield of chlorogenic acid
由图5可见,红薯叶中绿原酸的提取率随提取时间的增加呈现先增大后趋于稳定的趋势。提取时间30 min~50 min左右,提取率基本稳定,提取效果相当,因此,后续试验选择提取时间为30 min。
2.2 Box-Behnken试验设计及显著性分析
根据单因素试验结果,选择乙醇浓度、pH值、提取温度、提取时间4个因素的3个较优水平,采用Design Expert8.0软件进行Box-Behnken响应面优化试验方案,以绿原酸提取率作为响应值,确定提取最佳工艺条件。响应面试验方案与结果见表2。

表2 响应面试验方案与结果Table 2 Arrangement and corresponding results of Box-Behnken experimental design

续表2 响应面试验方案与结果Continue table 2 Arrangement and corresponding results of Box-Behnken experimental design
对表2数据进行回归拟合,可得响应变量A、B、C、D对提取率(Y)的回归方程为:

利用Design Expert8.0软件对表2数据进行二次响应模型方差分析,结果如表3如示。
经分析,回归模型的决定系数R2=0.9573,P<0.0001,说明模型极显著;失拟项P=0.2755,影响不显著,说明非试验因素对试验结果影响不大;模型校正决定系数R2Adj=0.9147,表示可以用此数学模型解释91.47%的变异性;变异系数C.V%=0.88,说明该回归模型可信度较高;精密度值=17.01>4,说明该模型合理,可应用该模型预测和分析红薯叶绿原酸的提取条件。根据表3可知,各因素对红薯叶绿原酸提取率的影响大小顺序为:pH值>提取温度>乙醇浓度>提取时间,其中pH值和提取温度的影响极显著(P<0.01),乙醇浓度影响显著(P<0.05)。
2.3 各因素间交互作用分析
根据表3可见,影响因素之间A(乙醇浓度)与B(溶液pH值)、A(乙醇浓度)与C(提取温度)的交互影响极显著(P<0.01),B(溶液 pH 值)与C(提取温度)的交互影响显著(P<0.05),其他因素之间的交互作用不显著。利用回归模型作各因素间响应面图和等高线图如图6所示。

表3 二次响应模型方差分析结果Table 3 ANOVA results of the fitted quadratic regression model
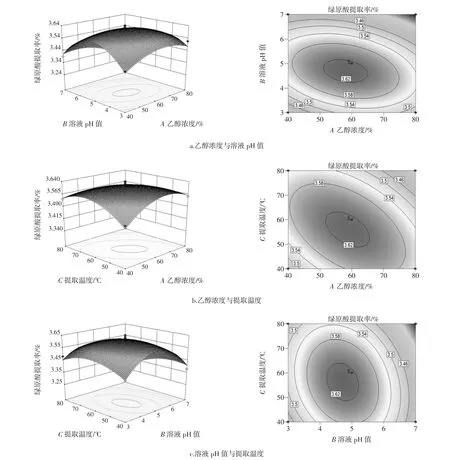
图6 各因素间交互作用的等高线图和响应面图Fig.6 Response surface and contour plots
由图6可见,以上响应面图均为开口向下的平滑曲面,曲面上存在最大响应值。综合各等高线图发现,沿溶液pH值方向的曲线较密集,可见溶液pH值的变化对响应值的影响较其他因素大。
2.4 最佳工艺条件确定
采用Design-Expert 8.0软件进行分析计算,得出提取红薯叶绿原酸最佳工艺条件为:乙醇浓度59%,溶液pH4.8,提取温度57℃,提取时间29 min,提取率预测值为3.63%。为检验工艺参数的准确性,为方便试验操作,选择乙醇浓度60%,溶液pH4.8,提取温度55℃,提取时间29 min,平行3次试验,测得绿原酸提取率为3.597%,相差为-0.91%,说明本回归模型具有可靠性。
2.5 绿原酸提取的动力学分析
2.5.1 动力学数学模型的建立
由表3可见,溶液pH值对绿原酸提取率的影响极显著,本试验固定乙醇浓度为60%和提取温度60℃,建立动力学数学模型分析不同溶液pH值随提取时间变化对绿原酸提取率的影响,考察不同溶液pH值下绿原酸的提取率随提取时间的变化规律。结果如图7所示。

图7 溶液pH值、提取时间与绿原酸提取率的关系Fig.7 Relationship between pH,extraction time and extraction rate of chlorogenic acid
由图7可见,溶液pH值不同,绿原酸的最大提取率不同,溶液pH值过大或过小都会影响绿原酸的提取。溶液pH值较大会加快绿原酸的水解而使提取率下降,溶液pH值较小会影响绿原酸从植物细胞中溶出而影响提取率。绿原酸溶出在溶剂后,由于自身稳定性较弱,随着时间的延长会略有分解而使提取率下降。
由图7可见,溶液pH值对绿原酸提取率的影响过程符合多项式模型,采用OriginPro 8.0软件的多项式函数对图7的试验数据进行模型拟合,结果如表4~表7。
R2又称为拟合优度,当它越接近1时,表示拟合模型的方程式参考价值越高。Adj-R2调整了由于参数个数带来的相关性计算误差,它的值越接近1越准确地评价回归方程的优劣。Reduced Chi2表示数据与拟合曲线的偏离程度,它的值越小说明数据越接近拟合曲线。由表4~表7可见,采用多项式函数可以很好地进行数据拟合,当多项式次数达5以上,R2达0.96以上,Adj-R2达0.93以上。
2.5.2 动力学数学模型考察
为验证所建立的动力学模型,分别计算4、5、6、7次多项式模型的拟合点,考察拟合数据对拟合方程的离散情况,结果如图8所示。

表4 不同溶液pH值的提取动力学模型4次多项式拟合参数表Table 4 4 degree polynomial fitting parameter table for extraction kinetics model of different pH solutions

表5 不同溶液pH值的提取动力学模型5次多项式拟合参数表Table 5 5 degree polynomial fitting parameter table for extraction kinetics model of different pH solutions

表6 不同溶液pH值的提取动力学模型6次多项式拟合参数表Table 6 6 degree polynomial fitting parameter table for extraction kinetics model of different pH solutions

表7 不同溶液pH值的提取动力学模型7次多项式拟合参数表Table 7 7 degree polynomial fitting parameter table for extraction kinetics model of different pH solutions

图8 数据对各拟合方程的离散情况Fig.8 The discretization of data to each fitting equation
图8中,实线为试验数据的拟合曲线,点为试验数据点或拟合数据点。从图8可见,除4次多项式拟合中pH5的试验数据拟合曲线较差外,其余次数多项式中各试验数据与模型的拟合程度都较高。但各次数多项式的拟合数据与模型的拟合程度又各不相同:在6次多项式拟合模型中,pH3、pH5的拟合数据点与拟合曲线偏离较大,在7次多项式拟合模型中,pH5、pH7的拟合数据点与拟合曲线偏离较大,说明所建立6次、7次多项式模型并不理想,模型公式对计算结果产生了较大的影响。可见建立多项式模型中,5次多项式模型更能反映红薯叶中绿原酸提取过程的动力学规律。
3 结论
本试验以烘干的东兴红姑娘红薯叶为原料,采用乙醇浸提法,以溶液pH值、乙醇浓度、提取温度和提取时间作为试验因素,通过单因素试验和Box-Behnken设计试验,研究了从烘干的红薯叶粉提取绿原酸的最优工艺条件为:乙醇浓度59%,溶液pH4.8,提取温度57℃,提取时间29 min,提取率预测值为3.63%。以不同溶液pH值下绿原酸提取率随时间变化的规律建立了提取过程动力学模型,采用Origin-Pro8.0软件的多项式函数对试验数据进行模型拟合。经拟合模型比较,5次多项式模型更能反映红薯叶中绿原酸提取过程的动力学规律。
[1] 陶运荣,何虎翼,宋月家,等.广西红薯产业价值链分析[J].广西农学报,2014,29(6):30-34
[2] 李悦丰,尹婷,钱金萍,等.红薯叶中绿原酸的提取纯化工艺研究[J].四川食品与发酵,2006,42(4):27-29
[3] 蒋美丽,久保辉幸,王正裔,等.响应面法优化超声辅助提取金银花中绿原酸[J].化学与生物工程,2017,34(3):35-39
[4] 李玉山,范鹏辉.杜仲叶中绿原酸提取工艺的优化[J].湖北农业科学,2012,51(17):3830-3831,3835
[5] 林春梅.牛蒡根中绿原酸提取工艺的优化[J].山东农业科学,2012,44(2):108-111
[6] 张冕,胡小莲,姚芳芳.Box-Behnken实验设计法优化红薯叶中绿原酸的提取工艺[J].德州学院学报,2013,29(24):56-60
[7] 单长松,刘锦,赵子彤,等.响应面优化红薯莲叶中绿原酸的提取工艺[J].粮油食品科技,2017(4):42-47
[8] 张春艳,覃逸明,蓝峻峰.响应面法对甘薯茎叶绿原酸超声提取工艺的优化[J].湖北农业科学,2015(9):2201-2205
[9] 高岐,窦宪民.微波提取红薯叶中绿原酸含量的应用研究[J].农业机械,2012(24):154-155
[10]齐惠丽.杜仲叶中绿原酸提取工艺研究[D].天津:天津大学,2006:5
[11]肖月,王珊珊,秦玉杰,等.响应面法优化超声提取独行菜绿原酸的工艺[J].湖北农业科学,2016,55(13):3450-3452,3455
[12]李文芳,晏丽,田春莲,等.甘薯叶中绿原酸最佳提取工艺的研究[J].食品科学,2007,28(11):245-248
[13]李莉,张赛,何强,等.响应面法在试验设计与优化中的应用[J].实验室研究与探索,2015,34(8):41-45
[14]罗婷,周坤,叶宏俊,等.响应面法优化苍耳子中绿原酸的提取工艺[J].中国现代中药,2017(11):1620-1624
[15]邓爱华,李红勇,谢鹏,等.响应面法优化杜仲叶中绿原酸提取工艺[J].经济林研究,2018,36(1):125-130
[16]王丽萍,徐传远.酶-超声波法提取红薯茎叶中绿原酸的工艺研究[J].湖北北农业科学,2012,51(12):2574-2575,2585
[17]甘露菁,邓泽元.响应曲面法优化醇提荷叶复方物超临界萃取残渣中黄酮的工艺[J].食品科学,2010(18):26-30
[18]魏凤华,倪艳,宋强,等.响应曲面法优化葛根总黄酮的提取工艺研究[J].世界科学技术-中医药现代化,2015,17(1):261-266
[19]孙庆庆,商丽娟,扶庆权,等.响应曲面法优化海蓬子茎叶总黄酮的提取工艺研究[J].食品工业科技,2012,33(10):276-279
[20]李杰,陈道鸽,王兵兵,等.水热法提取金银花中绿原酸的工艺研究[J].食品研究与开发,2018(1):62-67
[21]秦文文,刘宇,李妹妹,等.响应曲面法优化茶树总黄酮提取工艺的研究[J].食品研究与开发,2018(1):67-71
