基于图切割的骨组织CT图像分割方法
2018-07-04万林祥石志良
万林祥,石志良
(武汉理工大学 机电工程学院,湖北 武汉 430070)
医学图像分割是人体器官组织功能分析以及诊断治疗的基础,对于提取病变组织周围的信息,辅助医生进行病情分析以及三维重建等提供了很好的技术支撑。然而,由于医学图像的多样性、低对比度以及噪声等特性[1],目前用于临床实践的图像分割算法却很少。医学图像成像方式(CT、MRI、PET等)不同,人体组织器官在形状结构上存在差异,这些因素都给医学图像的分割带来了一定的困难[2]。因此,研究一种实用的分割方法取代目前临床上主观性较强的半自动化分割方法是当前医学图像分割领域的重点研究内容。
基于图论的图像分割方法是一种新兴的图像分割技术。2001年,Boykov[3]等首次提出将图切割的思想应用于图像分割。这一交互式框架的提出引起了人们的注意。在此基础上,韩守东[4]等通过使用高斯超像素来构造Graph Cuts模型,加快图切割算法的分割效率。侯叶[5]利用图切割思想与水平集技术各自在图像分割领域的优势,提出一种GC-CV(graph cuts-chan vese)模型,减少了Graph Cuts算法的运算量,提高了运行效率。Gueziri[6]等研究当图像较大时如何减少图切割算法中图的结点,实现快速分割的问题。
然而传统的Graph Cuts算法及其改进算法是一种交互式分割算法,在分割过程中需要主观的选定前景和背景标记点[10],严重阻碍其在医学图像分割领域的应用。因此,笔者提出了一种适用于医学骨组织CT图像的标记自动生成的Graph Cuts算法。
1 基于形态学和Graph Cuts的混合分割算法
1.1 标记自动生成的Graph Cuts算法框架
标记自动生成的Graph Cuts算法是一种基于交互式框架的图像分割算法。其以形态学运算作为预处理手段,得到Graph Cuts算法的前景背景标记点,从而消除传统算法需手动标记种子点的缺陷,加快算法运行效率。
图1为标记点自动生成的Graph Cuts算法的基本框架。标号1代表着标记点生成过程,标号2代表Graph Cuts算法的输入,标号3代表人工交互,标号4代表最终的分割结果。
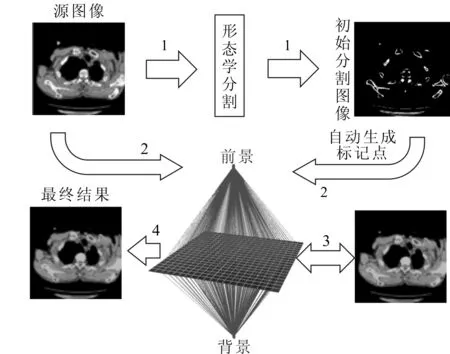
图1 标记自动生成的Graph Cuts算法框架
1.2 形态学标记生成
形态学方法一方面能消除医学图像中的噪声,还能在图像中分割出独立的元素并连接相邻的元素。形态学运算相对固定,一般为膨胀、腐蚀及其组合操作,因此结构元素的选择成为了形态学算法的关键。若用E表示原图像,A(x)代表结构元素,则对膨胀的定义为:
Y=E⊕A={y:A(y)∩E≠Φ}
(1)
对腐蚀的定义为:
X=E⊙A={x:A(x)⊂E}
(2)
开运算和闭运算是形态学的另外两个操作,是由腐蚀和膨胀操作组合而成。先腐蚀后膨胀的过程称为开操作,其具有消除细小物体,平滑边界的作用;先膨胀后腐蚀的过程称为闭操作,具有填充物体内部细小孔洞、连接临近区域和平滑边界的作用。
标记点自动生成的Graph Cuts算法并不以形态学来得到精确的结果,只将获取的目标信息作为Graph Cuts算法的前景和背景标记点,因此笔者提出的该算法是以形态学开运算为基础,选取水平方向1×3的结构元素来实现的。
[本刊讯] 为满足广东省护理人员刊登科技论文的需求,《上海护理》编辑部将于2012年6月编辑出版《上海护理》增刊1。敬请广大作者与读者予以关注。咨询电话:62671836。
1.3 Graph Cuts算法
图论中的图是一种描述事物之间关联程度的拓扑图形,将事物称为顶点,事物之间的关系则用事物对应顶点之间的连线来度量,称之为边。据此,在数学上可将图G表示成顶点与边的二元数组,记为G=(V,E)。其中,V代表顶点的集合,E代表边的集合。
在图切割算法中,G为无向图。其在构建时存在两个特殊的终端结点:源结点s和汇结点t。将图像中的像素点映射为图G的结点,结点之间的关系以权值来表示。分割时,图中存在两类边:结点与源结点s或汇结点t的连接称为t-links,结点之间的连接称为n-links。
能量函数的建立是图切割算法的关键,其一般由数据项和光滑项组成。数据项代表了图切割算法的应用背景,光滑项则决定了最终的图像分割质量。为获取最优化的二值分割结果,定义一个加权因子λ表征数据项和光滑项间的权重,则能量函数可以表示为:
E(L)=λ×R(L)+B(L)
(3)
数据项为:
(4)
光滑项为:
·δ(lp,lq)
(5)
其中
Rp("obj")=-lnPr(Ip|O)
Rp("bkg")=-lnPr(Ip|B)
(6)
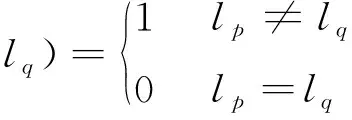
(7)
式中:Rp(lp)是像素p属于前景或背景的惩罚;Pr为某一点处的像素归属于前景或背景的概率;N代表像素点的合集;p、q是N中的任意像素点;Ip、Iq是像素p、q处的灰度值;B{p,q}为相邻像素间不连续性惩罚。
利用原始图像和标记点图像构建图或网络,并采用最大流/最小割定理进行求解,得到初始分割图像。对于分割错误的区域,手动标记前景或背景,得到最终的分割图像。标记点自动生成的Graph Cuts算法流程如图2所示。
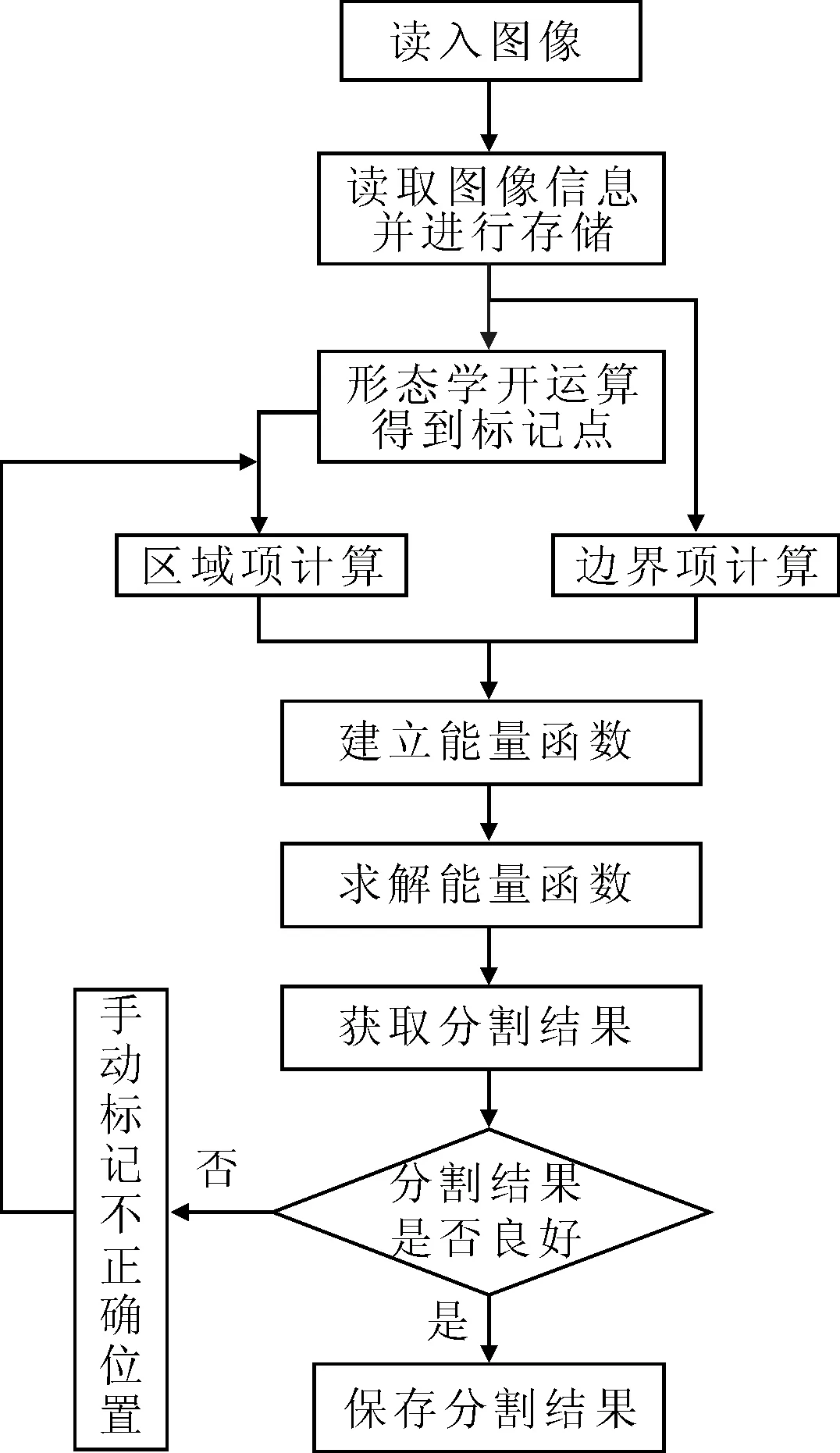
图2 算法流程图
算法的具体步骤如下:
(1)利用图像信息建立光滑项。式(8)是一种基于灰度和距离的权值设置方法,式中σ为尺度因子,用于调节结点之间的灰度差异。

(8)
(2)以形态学开运算后得到的标记点为基础,根据式(6)建立数据项。
(3)依据数据项和光滑项构建能量函数,并利用最大流/最小割算法求得初次分割结果。
(4)根据初次分割结果,对分割错误处重新手动标记,再执行步骤(2),得到最终分割结果。
2 实验过程及实验结果分析
2.1 分割过程
图3为标记点自动生成的Graph Cuts算法的分割过程。图3(a)为原始DICOM图像;图3(b)为形态学处理后的标记点图像;图3(c)为Graph Cuts算法的首次分割结果;图3(d)是对图3(c)中出现错误标记成前景的区域进行重新标记(黑色线条);图3(e)为重新标记后得到的最终分割结果。
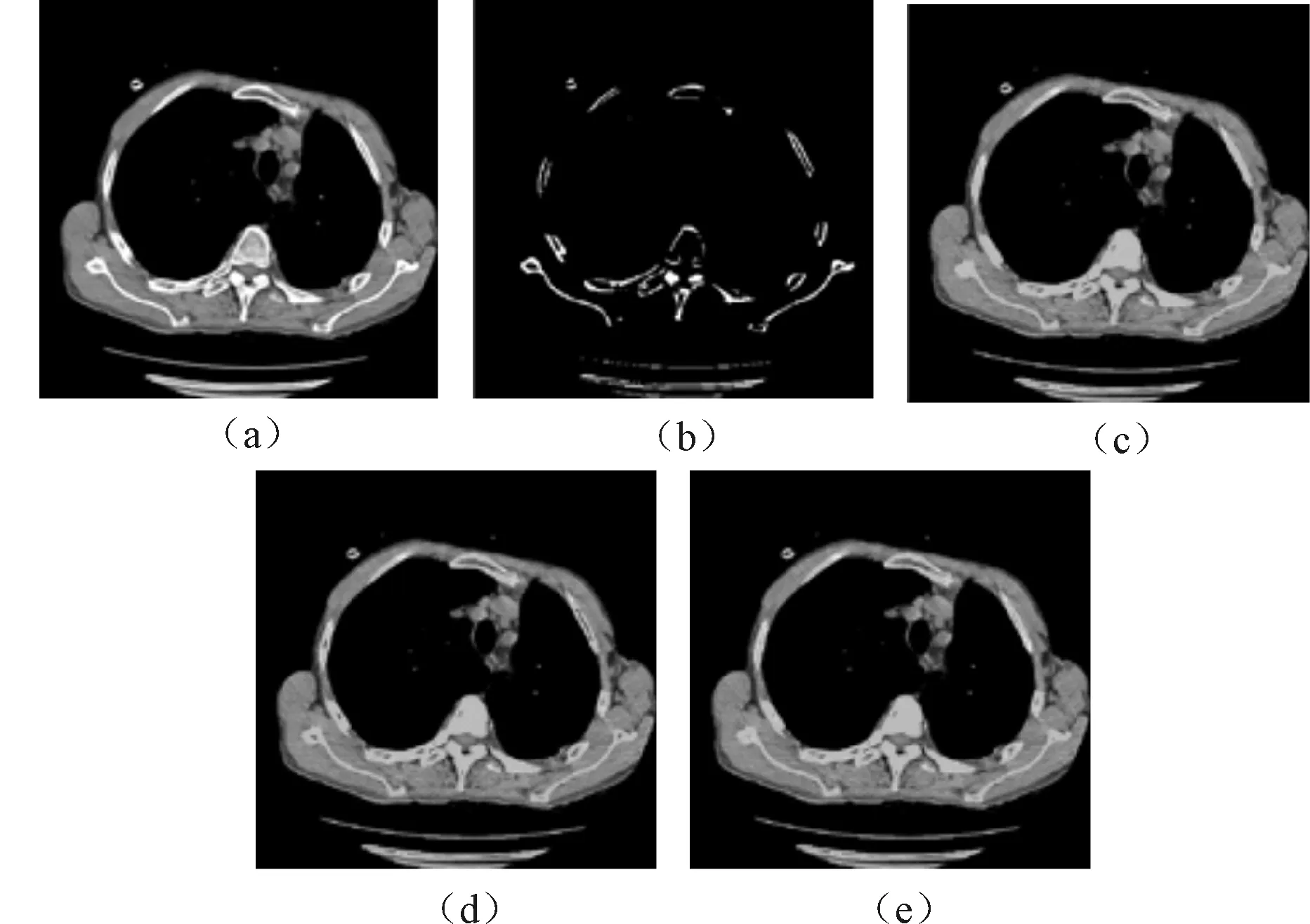
图3 分割过程
2.2 实验结果分析
笔者选择4张腹部骨组织切片,将提出的算法与成熟的Materialise公司的MIMICS系统、传统的Graph Cuts算法作对比分析。实验PC配置为3.2 GHz的Intel四核CPU,8 G内存,在Windows平台下,采用Visual Studio 2010配置DCMTK和CxImage实现。选取的实验图片来源于华中科技大学同济医院,图像均为标准DICOM格式,图像大小均为512×512像素。
图4为人体腹部骨组织第3、第10、第61、第95张切片的分割对比图。从分割结果可以看出:与传统Graph Cuts算法相比,本文算法大幅减少了人工干预所带来的影响,加快了分割效率,具体数据如表1所示,边界识别也更为准确;与成熟的Mimics系统对比可知,分割质量更为良好,“空洞”能完成自动“修补”,边界也更为清晰。

图4 实验分割结果对比

s
3 结论
针对目前骨组织分割算法存在的不足之处,结合Graph Cuts算法在图像分割中的优良特性,提出了一种基于形态学和Graph Cuts的混合分割算法。实验结果表明,本文算法在分割质量和分割效率上均有较大提高,证明了该算法的有效性。
参考文献:
[1] 隋航.人体典型骨组织自动分割算法的设计与实现[D].沈阳:东北大学,2008.
[2] 王俏.图切割技术在医学影像组织分割中的应用研究[D].长春:长春理工大学,2014.
[3] Boykov Y Y, Jolly M P. Interactive Graph Cuts for Optimal Boundary and Region Segmentation of Objects in N-D Images[J]. Iccv, 2001(1):105-112.
[4] 韩守东,赵勇,陶文兵,等.基于高斯超像素的快速Graph Cuts图像分割方法[J].自动化学报,2011(1):11-20.
[5] 侯叶.基于图论的图像分割技术研究[D].西安:西安电子科技大学,2011.
[6] Gueziri H, Mcguffin M J, Laporte C. A Generalized Graph Reduction Framework for Interactive Segmentation of Large Images[J]. Computer Vision and Image Understanding, 2016,150(Supplement C):44-57.
[7] Mahapatra D. Combining Multiple Expert Annotations Using Semi-supervised Learning and Graph Cuts for Medical Image segmentation[J]. Computer Vision and Image Understanding, 2016,151:114-123.
[8] Kalshetti P, Bundele M, Rahangdale P, et al. An Interactive Medical Image Segmentation Framework Using Iterative Refinement[J]. Computers in Biology and Medicine, 2017,83(Supplement C):22-33.
[9] Dai S, Lu K, Dong J, et al. A Novel Approach of Lung Segmentation on Chest CT Images Using Graph Cuts[J]. Neurocomputing, 2015,168:799-807.
[10] Mahapatra D. Semi-supervised Learning and Graph Cuts for Consensus Based Medical Image Segmentation[J]. Pattern Recognition, 2017,63(Supplement C):700-709.
