胶红酵母与酿酒酵母混合酒精发酵中酵母生长与糖苷酶活动力学
2018-07-04李爱华王星晨彭文婷陶永胜
李爱华,王星晨,彭文婷,李 朔,陶永胜,3
(1.西北农林科技大学 食品科学与工程学院,陕西杨凌 712100;2.西北农林科技大学 葡萄酒学院,陕西杨凌 712100;3.陕西省葡萄与葡萄酒工程技术研究中心,陕西杨凌 712100)
葡萄酒酒精发酵是由非酿酒酵母引起,随后由酿酒酵母逐步替代并完成发酵[1-2]。目前,葡萄酒酒精发酵依赖于使用商业酿酒酵母,主要由于早期接种足量的酿酒酵母(≥106cfu/mL)可以有效防止致病性微生物的繁殖增长,降低破败的风险,保证酒精发酵的正常进行[3-4]。然而商业酿酒酵母的广泛使用限制了葡萄酒的产地或者品种的特性,因此一些酒庄采用自然发酵的方法进行,即不接种任何酵母,利用存在于葡萄原料中的酵母启动并完成酒精发酵。自然发酵的方法虽然有潜力使所酿葡萄酒获得独特的风格[5-6],但在酒精发酵前期极易造成杂菌生长,进而破坏葡萄酒的品质。因此许多研究者在模拟自然发酵过程中的非酿酒酵母与酿酒酵母生长演变规律,控制使用优选的非酿酒酵母与酿酒酵母混合发酵葡萄酒,以期在发挥仅使用酿酒酵母或者采用自然发酵优点的情况下,同时还可以避免上述2种发酵方式的缺点[3, 7-10]。
目前大量研究进行优选非酿酒酵母与酿酒酵母混合发酵葡萄酒[3],以分析所使用的非酿酒酵母对供试酒样多酚及颜色[7]、挥发性香气成分[8-9]及感官品质的影响[10]。使用优选的非酿酒酵母和酿酒酵母混合接种发酵葡萄酒的接种方式主要分为同时接种和顺序接种(先接种非酿酒酵母,随后接种酿酒酵母)[11-14]。顺序接种方案模拟自然发酵过程,即首先由接种的非酿酒酵母启动酒精发酵,并发挥非酿酒酵母的代谢特点来修饰供试酒样的风格;随后再接种酿酒酵母,从而使酒精发酵顺利完成。在此过程中,非酿酒酵母产生的糖苷酶比酿酒酵母产生的更能适应高糖、高酸、低pH的发酵环境[15],葡萄中的香气糖苷前体由糖苷酶水解,释放挥发性成分,因此在发酵前期接种的非酿酒酵母产生的糖苷酶有能力水解更多的糖苷结合态香气成分,从而有助于提高葡萄酒品种香气质量[10, 15-18]。由于不同种属的非酿酒酵母特性差异较大,因此不同的非酿酒酵母的接种数量以及接种时机均有差异[10-11, 13-14],而不同的混合接种策略则会导致酒精发酵过程中酵母生长动力学的改变。
混合发酵过程中不同酵母的生长变化体现了不同种属酵母的生长特性。Moreira等[19]研究在YM培养基中酿酒酵母与葡萄汁有孢汉逊酵母和季也蒙有孢汉逊酵母单一及混合发酵的生长动力学,结果显示混合发酵中酿酒酵母和非酿酒酵母的浓度均可达107cfu/mL,且非酿酒酵母的生长并未显著地受到酿酒酵母的抑制。也有研究显示,在季也蒙有孢汉逊酵母与酿酒酵母混合发酵中,葡萄汁有孢汉逊酵母和季也蒙有孢汉逊酵母会受到酿酒酵母的抑制从而使非酿酒酵母在发酵结束前提前消失[20-21]。此外,本研究前期分析在葡萄汁和模拟葡萄汁的混合发酵中,酿酒酵母对葡萄汁有孢汉逊酵母有较强烈的抑制作用[22]。模拟发酵试验结果证明,发酵毕赤酵母在与酿酒酵母混合发酵中也受到抑制[23]。在葡萄酒发酵过程中,酿酒酵母对非酿酒酵母的抑制或杀死作用有助于控制非酿酒酵母的一些负面作用,例如汉逊酵母属,接合酵母属会产更高含量的乙酸[3]。
目前,葡萄酒的混合菌种发酵因其对供试酒样有增香作用而得到广泛关注,但在发酵过程中糖苷酶活的变化过程却缺乏充分的数据支撑。因此本试验选择1株由西北农林科技大学葡萄酒学院酿造与风味化学实验室(以下称本实验室)前期优选的高葡萄糖苷酶活性的胶红酵母,监测其与酿酒酵母在混合发酵‘爱格丽’干白葡萄酒过程中,β-葡萄糖苷酶、鼠李糖苷酶、半乳糖苷酶和木糖苷酶4种糖苷酶的活性变化,同时监测酒精发酵过程中的酵母生长动力学,以期从糖苷酶活性变化规律结合酵母生长动力学来评价该株优选的胶红酵母在葡萄酒增香酿造的应用潜力,并优化混合发酵的接种方案。
1 材料与方法
1.1 试验材料与试剂及仪器
葡萄原料:‘爱格丽’葡萄于2016年8月末采收于中国陕西省河阳葡萄基地。还原糖121.3 g/L,总酸7.3 g/L(以酒石酸计)。
菌种:非酿酒酵母使用本实验室筛选的胶红酵母(Rhodotorula mucilaginosa),中国典型培养物保藏中心保藏编号:M2013660。酿酒酵母是ACTIFLORE○RF33 (Laffort, France)。
试剂:亚硫酸(6%),D-葡萄糖,酒石酸氢钾购于天津市科密欧化学试剂有限公司;酵母浸粉、蛋白胨购于北京奥博星生物技术有限责任公司、琼脂、果糖购于北京Solarbio生物科技有限公司;二水合氯化钙、氢氧化钠、磷酸氢二钾、七水合硫酸镁、柠檬酸、无水碳酸钠、一水合柠檬酸、十二水合磷酸氢二钠购买于四川西陇化工有限公司;苹果酸、对-硝基苯基-β-D-葡萄糖吡喃糖苷(98%)、对-硝基苯基-α-L-鼠李糖吡喃糖苷(98%)、对-硝基苯基-β-D-半乳糖吡喃糖苷(98%)、对-硝基苯基-β-D-木糖吡喃糖苷(98%)购买自源叶生物。
仪器:Cary 60 UV-Vis紫外分光光度计(安捷伦科技有限公司,美国),TGL-16M高速离心机(湘仪离心机仪器有限公司,中国),CX31光学显微镜(奥林巴斯有限公司,日本),MP-250B恒温培养箱(上海南荣实验室设备有限公司),HW.SY21-KP8水浴锅(北京市长风仪器仪表公司)。
1.2 葡萄酒酿造
1.2.1 葡萄酒的酿造 参照Wang等[11]的工艺。新鲜葡萄经除梗破碎后,直接压榨取汁,加入60 mg/L的SO2(以亚硫酸计),使用0.5 g/L的膨润土在5 ℃下胶澄清24 h,调整分离出的澄清汁的还原糖到187 g/L,分装葡萄汁,待其温度达15 ℃接种酵母(具体接种方案见“1.2.3”),发酵温度控制在15~17 ℃,发酵结束后,加入60 mg/L的SO2,满罐密封储藏(15 ℃)并进行常规的稳定处理。每24 h取样。
1.2.2 模拟发酵汁配方 参考Contreras等[24]的配方并有修改。葡萄糖100 g/L,果糖100 g/L,柠檬酸0.2 g/L,苹果酸3 g/L,酒石酸氢钾2.5 g/L,磷酸氢二钾1.1 g/L,七水合硫酸镁1.5 g/L,二水合氯化钙0.4 g/L,酵母浸粉10 g/L,pH用氢氧化钠溶液调至3.5,由于模拟葡萄汁的营养成分含量远低于葡萄汁,因此设置模拟葡萄汁发酵温度为25 ℃恒温静止发酵,以保证模拟发酵的正常进行。每隔24 h取样。
1.2.3 酵母接种方案 对照组(CK):只接种2×106cfu/mL的经过YEPD液体培养基活化的F33酿酒酵母。
试验组:采用顺序接种酵母的方式接种胶红酵母和酿酒酵母;同时接种1×106cfu /mL的经过YEPD液体培养基活化3 d的胶红酵母和1×106cfu/mL的F33(C0);先接种1×106cfu/mL的胶红酵母,24 h后接种1×106cfu/mL的F33(S24);先接种1×106cfu/mL的胶红酵母,48 h后接种1×106cfu/mL的F33(S48);先接种1×106cfu/mL的胶红酵母,96 h后接种1×106cfu/mL的F33(S96)。每个方案做2个发酵试验。
1.3 测定项目及方法
1.3.1 糖苷酶酶活测定 参考Fia等[25]方法并进行修改测定糖苷酶酶活。酒样先经过离心(10 000×g,4 ℃,15 min),取上清液,过0.45 μm滤膜。试验组:200 μL粗酶提取液加入到750 μL柠檬酸-磷酸氢二钠(pH 5.0)缓冲液中,再加入250 μL 1 mmol/L相应的p-NPG(对-硝基苯基-β-D-葡萄糖吡喃糖苷、对-硝基苯基-α-L-鼠李糖吡喃糖苷、对-硝基苯基-β-D-半乳糖吡喃糖苷、对-硝基苯基-β-D-木糖吡喃糖苷)(3份)。对照组:200 μL粗酶提取液加入到750 μL柠檬酸-磷酸氢二钠(pH 5.0)缓冲液中,加入250 μL蒸馏水(1份)。反应条件为:40 ℃水浴,避光准确反应30 min。然后加入1.0 mL的1 mol/L Na2CO3以终止反应。在400 nm测其吸光度,蒸馏水调零,每个样品重复3次,利用对-硝基苯酚标准曲线计算酶活。糖苷酶活力单位(IU)定义为:40 ℃下1 min内催化生成1 μmol对-硝基苯酚所要的酶量。
1.3.2 微生物计数及动力学方程建立 葡萄酒发酵过程中采样时轻微搅动发酵液以保证酵母在发酵汁中均匀分布,并且减小氧化风险,酵母总数的测定采用血球计数法;模拟发酵过程中取样前将沉淀的菌体搅动均匀,不同酵母数量的监测采用稀释平板法[22]。
酵母生长动力学模型采用Monod模型[22],使用Logistic方程进行非线性拟合,Logistic方程如下:
Y=a/[1+b×exp(-k×x)]
式中,Y为x时刻菌体浓度(107cfu/mL),a为最大菌体浓度(107cfu/mL),b为常数,k为最大比生长速率(d-1),x为发酵时间(d)。
1.4 数据处理及分析
曲线图的绘制及动力学拟合采用OriginPro 9.0完成,采用Microsoft Excel 2013 (Microsoft,USA)进行基本统计分析。
2 结果与分析
2.1 模拟发酵中2种酵母的生长变化
由图1-A可知,CK中的酵母(酿酒酵母)增长速度最快,在发酵第4天后进入平衡期(约5×107cfu/mL)。C0中(图1-B),胶红酵母以极低的数量水平生长3 d,而酿酒酵母在第5天进入发酵的平衡期(约5×107cfu/mL)。S24中(图1-C)胶红酵母以低数量水平存在4 d,从发酵第4天后,酿酒酵母开始主导发酵,并在发酵第5天进入平衡期(约5×107cfu/mL)。S48中(图1-D)胶红酵母生存了5 d,并且在发酵第3天胶红酵母数量显著上升(1×107cfu/mL),但由于同一天接种了酿酒酵母,致使胶红酵母的数量在第4天有降低到极低水平,并在发酵的第5天后消失,酿酒酵母则在第3天后进入对数期,开始主导发酵,并在发酵第6天进入平衡期(约6×107cfu/mL)。S96中(图1-E)的胶红酵母共存在7 d,并且其数量在酿酒酵母接种以前及前期保持在较高水平(约1.5×107cfu/mL),并且在接种了酿酒酵母24 h后仍保持高水平的数量,酿酒酵母接种后很快进入对数期,并在第8到第9天进入平衡期(约5×107cfu/mL)。
在‘爱格丽’葡萄汁酒精发酵过程中,为研究不同接种方案下的酵母生长动力学,试验监测各处理酒样中的酵母总数,并利用酒精发酵过程中的平衡期及以前的酵母数量,建立各接种处理的酵母生长动力学(图1-F)),动力学各项参数见表1。由表1可知,混合发酵会降低发酵过程中的酵母最大浓度,C0和S24接种方案会提高酵母的最大比生长速率,而S96顺序接种降低该参数。由图1-F可知,酵母接种初期,对照酒样CK和同时接种酒样C0的酵母数量增长速度最快,此2酒样在最短的时间里进入对数期(第2天),并分别在第5天和第4天进入平衡期。而3种顺序接种处理的酒样(S24、S48和S96)随着接种酿酒酵母时间的推迟,进入对数期和平衡期的时间也在逐渐地延迟。与模拟发酵中的酵母生长动力学相比,葡萄汁中的酵母生长速度更快,其潜在原因可能源于葡萄汁的营养成分比模拟汁中的更丰富。此外,在葡萄汁酒精发酵平衡期以后,越来越多的酵母逐渐衰亡并沉淀在发酵罐底部,因而总酵母数呈现减少的趋势。
2.2 发酵过程中糖苷酶酶活的变化
为探究葡萄汁发酵中不同接种方案对发酵液中糖苷酶活性的影响,试验监测发酵过程中β-葡萄糖苷酶、鼠李糖苷酶、半乳糖苷酶以及木糖苷酶的活性变化,结果如图2所示。此外,为了更直观地观察到不同接种处理间的酶活差异,图2列出了各处理酒样中4种糖苷酶的累积酶活。
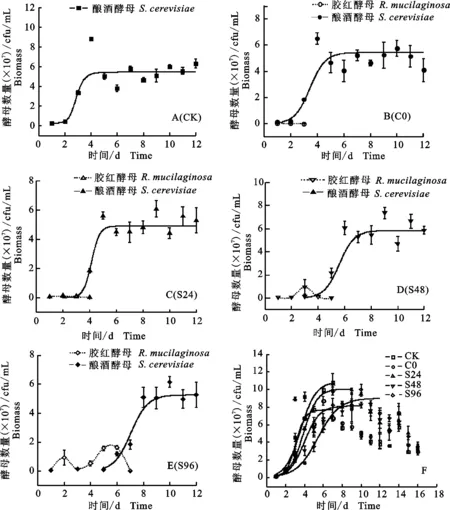
图1 模拟汁中不同接种处理的2种酵母的生长变化Fig.1 Changes of two yeasts in fermentation of synthetic grape juice under different treatments
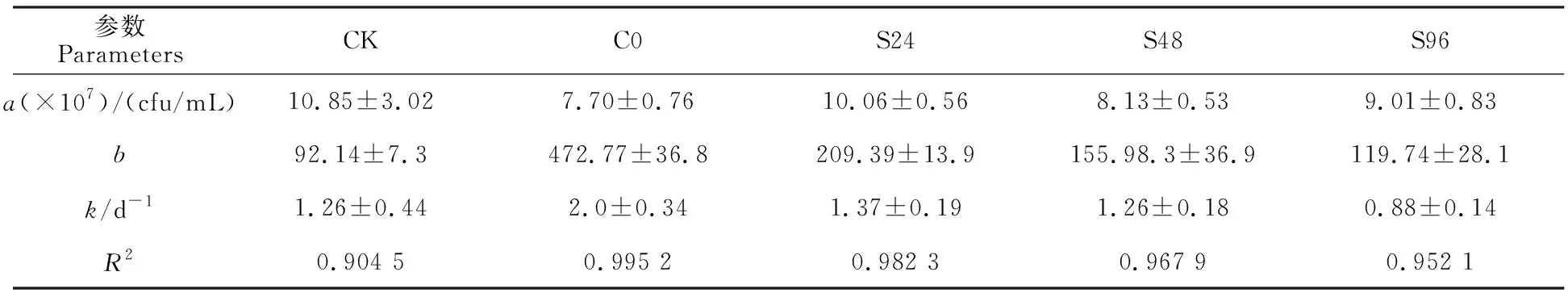
表1 酵母生长动力学拟合参数Table 1 Parameters of yeasts growth kinetics
β-葡萄糖苷酶的活性(图2-A)从发酵开始(约1.0 mU/mL)呈现递减趋势,在发酵第4天降到最低值(0~0.65 mU/mL),此后酶活开始上升直到发酵结束(1.75~2.5 mU/mL)。根据β-葡萄糖苷酶的累积酶活(图2-B)可知,混合接种方案在发酵过程中没有显著提高β-葡萄糖苷酶的活性,且CK的累积酶活从发酵的第7天后高于混合发酵酒样。
在酵母接种初期,鼠李糖苷酶(图2-C)的活性在CK中最高(3.87±0.027 mU/mL)。24 h后降至0.55±0.12 mU/mL,此后与C0处理的酶活变化保持一致并维持在0~1 mU/mL至发酵结束。顺序接种酒样(S24、S48、S96)的鼠李糖苷酶酶活一直处于较低水平,但值得注意的是,在酿酒酵母接种后,鼠李糖苷酶活性均有不同程度微小的提高。根据累积鼠李糖苷酶活(图2-D)可知,顺序接种处理S96从发酵第3天(4.927 3 mU/mL)后累积酶活高于CK(4.613 8 mU/mL),处理S24在发酵的第4天后累积酶活逐渐高于C0和S48,在发酵后期S24的累积酶活接近但仍低于CK。
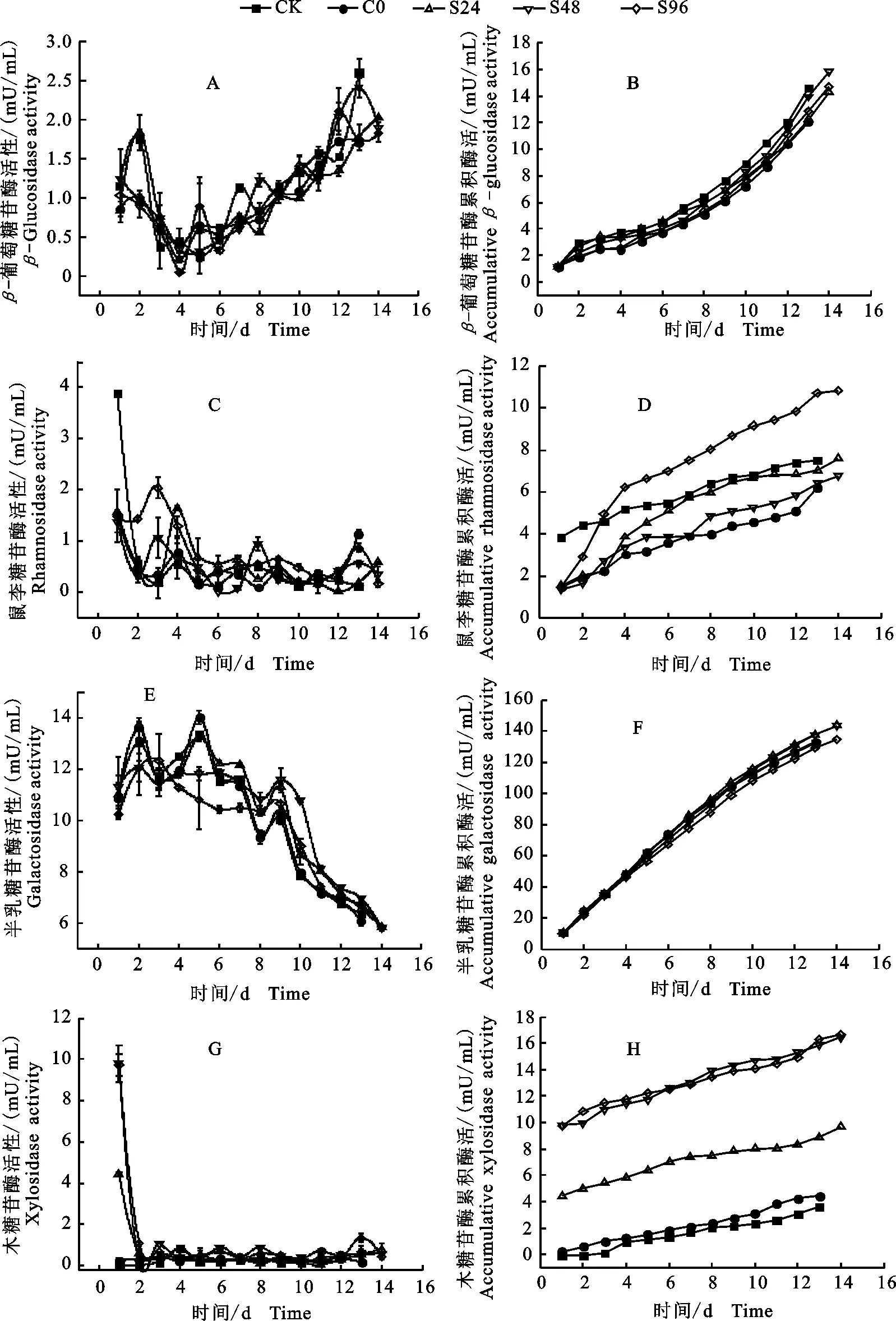
图2 ‘爱格丽’葡萄汁酒精发酵过程中糖苷酶变化及累积酶活Fig.2 Glycosidase and accumulated glycosidase activity during alcoholic fermentation of ecolly must
半乳糖苷酶活(图2-E)在发酵前期(第1天到第7天)在10~14mU/mL波动,而当酵母生长进入衰减期后,半乳糖苷酶的活性随之开始降低。根据半乳糖苷酶累积酶活(图2-F)可知,不同接种处理间无显著差异,但随着发酵进行,S24和S48的累积酶活逐渐高于其他处理。
顺序接种处理S24(4.423 9 mU/mL)、S48(9.783 7 mU/mL)、S96(9.717 3 mU/mL)在发酵第1天的木糖苷酶活显著高于C0和CK酒样(图2-G),然而在第2天,S24、S48、S96的酶活则降低至与C0和CK相同的水平,且所有酒样的木糖苷酶活在随后的发酵过程中一直处于较低的水平。由木糖苷酶累积酶活(图2-H)可知,源于发酵早期相对更高的酶活,顺序接种处理S96和S48中木糖苷酶活性显著地高于S24,并且S24的累积酶活显著高于CK和C0,即胶红酵母的接种在发酵早期显著提高葡萄汁中木糖苷酶的活性。综上所述,胶红酵母和酿酒酵母混合发酵提升了鼠李糖苷酶、半乳糖苷酶和木糖苷酶的活性。
3 讨 论
胶红酵母属于红酵母属,由于红酵母没有酒精发酵能力[26],因此,对红酵母在葡萄酒酒精发酵中的应用少有研究,Mingorance-Cazorla等[27]使用1株胶红酵母单一发酵葡萄汁和橘汁,但结果证明其所使用的胶红酵母不能提高挥发性香气成分的含量,也没有表现出感官上的增香特点。本研究所使用的胶红酵母是从河北葡萄酒产区筛选的高β-葡萄糖苷酶活性酵母,Hu等[28]证明从本株胶红酵母提取的糖苷酶粗酶对高浓度的葡萄糖,或高浓度的乙醇,或低pH等环境具有较强的适应性,从胶红酵母中提取的糖苷酶粗酶能有效水解香气糖苷前体;Wang等[11]利用此株胶红酵母与商业酿酒酵母混合发酵‘爱格丽’干白葡萄酒,结果表明接种混合发酵的酒样具有更高含量的挥发性香气成分,尤其C6-化合物、萜烯类、C13-去甲类异戊二烯类、高级醇、酯类、脂肪酸以及苯基乙基类香气化合物,且感官分析显示混合发酵增强了酒样的果香香气特征。
葡萄中储存的结合态香气成分是葡萄酒中品种香气的来源,在酒精发酵过程中结合态香气成分通过相应的糖苷酶水解,进而释放挥发性苷元,如C6-化合物、萜烯类、C13-去甲类异戊二烯等[29]。由于前期试验分析本株胶红酵母对葡萄酒挥发性香气成分以及感官特征的影响,因此本试验使用本株胶红酵母与酿酒酵母混合酒精发酵,分析其混合酒精发酵过程中酵母生长动力学,以及发酵过程中糖苷酶的活性变化,以期揭示本株胶红酵母影响葡萄酒品种香气的潜在原因。酵母生长动力学结果证明顺序接种发酵葡萄酒的发酵速率更慢,因此发酵环境中的糖苷酶能发挥更久的糖苷水解活性。此外,在顺序接种处理酒样中,鼠李糖苷酶以及木糖苷酶在发酵过程中呈现的高活性明确了混合接种对于提升糖苷酶活性的积极意义。本发酵试验中,各处理的酵母生长进入对数期的时间较晚(第2~4天),然而在1株优选的葡萄汁有孢汉逊酵母与酿酒酵母混合发酵的酵母生长动力学研究中,单一接种酿酒酵母和同时接种处理的酒样在接种酵母后立即进入对数期生长期[22],其原因最可能源于其更高的发酵温度。
目前,关于发酵过程中糖苷酶活性变化的研究较少,Maturano等[30]监测混合发酵过程中β-葡萄糖苷酶的变化趋势,结果表明发酵初期酶活较高,随着发酵的进行,酶活逐渐降低,并且在发酵中后期酶活几乎为零,与本研究结果不同,其原因可能由于发酵时间长度的差异(Maturano的试验中发酵时间为35 d)。此外,由于发酵过程中糖苷酶活性并不是稳定不变的,所以有必要观察发酵过程中糖苷酶活性变化的规律,因此,Maturano等[31]在后期试验中监测了发酵过程中的β-葡萄糖苷酶的活性,但文章没有直观地表现酶活变化过程,反而仅列出了酶活变化曲线下方的积分面积来反映发酵过程中酶活总量。然而,本试验不仅给出了在混合发酵过程中不同糖苷酶活性变化的过程,而且利用累积酶活图以期更加清楚地对比发酵过程中不同处理对4种糖苷酶活性的影响。
4 结 论
综上所述,胶红酵母与酿酒酵母顺序接种有助于减慢发酵速率,随着接种酿酒酵母时间的推迟,胶红酵母的生存时间逐渐延长,且最高生长数量增多。所监测的4种糖苷酶(β-葡萄糖苷酶、鼠李糖苷酶、半乳糖苷酶和木糖苷酶)主要在发酵前期表现较高的活性,混合接种发酵显著提升鼠李糖苷酶、半乳糖苷酶和木糖苷酶活性的累积量,因此,胶红酵母在与酿酒酵母混合发酵中有增香酿造的潜力,并且顺序接种方案S48是最佳的接种方案。
参考文献Reference:
[1] 李 华,王 华,袁春龙,等.葡萄酒工艺学[M].北京:科学出版社,2007:71-73.
LI H,WANG H,YUAN CH L,etal.Wine Making Technology [M].Beijing:Science Press,2007:71-73.
[2] FLEET G H,Yeast interactions and wine flavour[J].InternationalJournalofFoodMicrobiology,2003,86 (1):11-22.
[3] PADILLA B,GIL J V,MANZANARES P.Past and future of non-saccharomyces yeasts:from spoilage microorganisms to biotechnological tools for improving wine aroma complexity[J].FrontiersinMicrobiology,2016,7:411.
[4] ROMANO P,FIORE C,PARAGGIO M,etal.Function of yeast species and strains in wine flavour[J].InternationalJournalofFoodMicrobiology,2003,86(1):169-180.
[6] LIU P T,LU L,DUAN C Q,etal.The contribution of indigenous non-Saccharomyceswine yeast to improved aromatic quality of Cabernet Sauvignon wines by spontaneous fermentation[J].LWT-FoodScienceandTechnology,2016,71:356-363.
[7] MEDINA K,BOIDO E,FARINA L,etal.Non-SaccharomycesandSaccharomycesstrains co-fermentation increases acetaldehyde accumulation:effect on anthocyanin-derived pigments in tannat red wines[J].Yeast,2016,33 (7):339-343.
[8] WHITENER M E B,STANSTRUP J,CARLIN S,etal.Effect of non-Saccharomycesyeasts on the volatile chemical profile of Shiraz wine[J].AustralianJournalofGrapeandWineResearch,2017,23 (2):179-192.
[9] TOFALO R,PATRIGNANI F,LANCIOTTI R,etal.Aroma profile of Montepulciano d'Abruzzo wine fermented by single and co-culture starters of autochthonousSaccharomycesand non-Saccharomycesyeasts[J].FrontiersinMicrobiology,2016,7:1-12.
[10] LOIRA I,MORATA A,COMUZZO P,etal.Use ofSchizosaccharomycespombe andTorulasporadelbrueckiistrains in mixed and sequential fermentations to improve red wine sensory quality[J].FoodResearchInternational,2015,76:325-333.
[11] WANG X C,LI A H,DIZY M,etal.Evaluation of aroma enhancement for “Ecolly” dry white wines by mixed inoculation of selectedRhodotorulamucilaginosaandSaccharomycescerevisiae[J].FoodChemistry,2017,228:550-559.
[12] RENAULT P,COULON J,MOINE V,etal.Enhanced 3-sulfanylhexan-1-ol production in sequential mixed fermentation withTorulasporadelbrueckii/Saccharomycescerevisiaereveals a situation of synergistic interaction between two industrial strains[J].FrontiersinMicrobiology,2016,7:1-10.
[13] ENGLEZOS V,TORCHIO F,CRAVERO F,etal.Aroma profile and composition of Barbera wines obtained by mixed fermentations ofStarmerellabacillaris(synonymCandidazemplinina) andSaccharomycescerevisiae[J].LWT-FoodScienceandTechnology,2016,73,567-575.
[14] RENAULT P,COULON J,REVEL G,etal.Increase of fruity aroma during mixedT.delbrueckii/S.cerevisiaewine fermentation is linked to specific eesters enhancement[J].InternationalJournalofFoodMicrobiology,2015,207,40-48.
[15] HU K,QIN Y,TAO Y S,etal.Potential of glycosidase from non-Saccharomycesisolates for enhancement of wine aroma[J].JournalofFoodScience,2016,81 (4):M935-M943.
[16] PUERTAS B,JIMENEZ M J,CANTOS-VILLAR E,etal.Use ofTorulasporadelbrueckiiandSaccharomycescerevisiaein semi-industrial sequential inoculation to improve quality of palomino and Chardonnay wines in warm climates[J].JournalofAppliedMicrobiology,2017,122(3):733-746.
[17] MARTINO A,SCHIRALDI C,DI LAZZARO A,etal.Improvement of the flavour of Falanghina white wine using a purified glycosidase preparation fromAspergillusniger[J].ProcessBiochemistry,2000,36(1/2):93-102.
[18] GONZALEZ-POMBO P,FARINA L,CARRAU F,etal.Aroma enhancement in wines using co-immobilizedAspergillusnigerglycosidases[J].FoodChemistry,2014,143,185-91.
[19] MOREIRA N,MENDES F,HOGG T,etal.Alcohols,esters and heavy sulphur compounds production by pure and mixed cultures of apiculate wine yeasts[J].InternationalJournalofFoodMicrobiology,2005,103 (3):285-294.
[20] ROJAS V,GIL J V,PIAGA F,etal.Acetate ester formation in wine by mixed cultures in laboratory fermentations[J].InternationalJournalofFoodMicrobiology,2003,86 (1):181-188.
[21] MOREIRA N,MENDES F,DE PINHO R G,etal.Heavy sulphur compounds,higher alcohols and esters production profile ofHanseniasporauvarumandHanseniasporaguilliermondiigrown as pure and mixed cultures in grape must[J].InternationalJournalofFoodMicrobiology,2008,124 (3):231-238.
[22] 王星晨,胡 凯,陶永胜.葡萄汁有孢汉逊酵母和酿酒酵母的混合酒精发酵动力学[J].食品科学 2015,37 (3):103-108.
WANG X CH,HU K,TAO Y SH.Kinetics of alcohol fermentation by mixed cultures ofHanseniasporauvarumandSaccharomycescerevisiae[J].FoodScience,2015,37(3):103-108.
[23] 李 婷.川南白酒窖池中产酯酵母的筛选及其葡萄增香酿造潜力分析[D].陕西杨凌:西北农林科技大学,2017.
LI T.Screening ester-producing non-Saccharomycesyeast from southern Sichuan liquor pits in China and its potential analysis of wine aroma enhancement[D].Yangling Shaanxi:Northwest A&F University,2017.
[24] CONTRERAS A,HIDALGO C,SCHMIDT S,etal.The application of non-Saccharomycesyeast in fermentations with limited aeration as a strategy for the production of wine with reduced alcohol content[J].InternationalJournalofFoodMicrobiology,2015,205:7-15.
[25] FIA G,CANUTI V,ROSI I.Evaluation of potential side activities of commercial enzyme preparations used in winemaking[J].InternationalJournalofFoodScience&Technology,2014,49 (8):1902-1911.
[26] 裴 亮.高产β-胡萝卜素红酵母的选育及其色素的分离纯化与鉴定[D].成都:四川农业大学,2009.
PEI L.Screening ofRhdotorulaproducing highβ-carotenoid and the seperation,purification and identification of its pigments [D].Chengdou:Sichuan Agricuotural University,2009.
[27] MINGORANCE-CAZORLA L,CLEMENTE-JIMENEZ J M,MARTNEZ-RODRGUEZ S,etal.Contribution of different natural yeasts to the aroma of two alcoholic beverages[J].WorldJournalofMicrobiologyandBiotechnology,2003,19 (3):297-304.
[28] HU K,ZHU X L,MU H,etal.A novel extracellular glycosidase activity fromRhodotorulamucilaginosa:its application potential in wine aroma enhancement[J].LettersinAppliedMicrobiology,2016,62 (2):169-176.
[29] LIU J B,ZHU X L,ULLAH N,etal.Aroma glycosides in grapes and wine[J].JournalofFoodScience,2017,82(2):248-259.
[30] MATURANO Y P,RODRIGUEZ ASSAF L A,TORO M E,etal.Multi-enzyme production by pure and mixed cultures ofSaccharomycesand non-Saccharomycesyeasts during wine fermentation[J].InternationalJournalofFoodMicrobiology,2012,155 (1/2):43-50.
[31] MATURANO Y P,ASSOF M,FABANI M P,etal.Enzymatic activities produced by mixedSaccharomycesand non-Saccharomycescultures:relationship with wine volatile composition[J].AntonieVanLeeuwenhoekInternationalJournalofGeneralandMolecularMicrobiology,2015,108 (5):1239-1256.
