东方粘虫中肠V-ATP酶a亚基的克隆及原核表达
2018-07-04王高振吴元元吴文君祁志军
金 朵,王高振,吴元元,吴文君,祁志军
(1.西北农林科技大学 植物保护学院 农药研究所,陕西杨凌 712100;2.陕西省植物源农药研究与开发重点实验室,陕西杨凌 712100)
靶标创新是农药创新的基础,而基于化学蛋白组学分子靶标导向的绿色农药创制是新农药创制的最新趋势。例如,Robertson等[1]利用化学蛋白组学在果蝇Kc167细胞系中发现印楝素可直接结合到热休克蛋白60(Hsp60)复合体上;Krishamoorthy等[2]以Bt毒素为探针并利用化学蛋白质组学,鉴定数十种作用于昆虫中肠的靶蛋白。V-ATPase是一种保守的异聚体蛋白,广泛分布于真核生物的质膜和内膜系统上[3],是一种依赖ATP的质子泵,由复合体V1和复合体V0组成,这两部分结合时有活性,分离时无活性[4-6]。a亚基是复合体V0的重要组成部分,参与质子的跨膜转运过程[7-8]。V-ATPase在昆虫生长、发育和生殖过程中具有重要作用。昆虫中肠杯状细胞顶端质膜上的V-ATPase通过水解ATP产生能量,将中肠腔内H+运输到细胞中,维持中肠内的碱性环境,有利于碱性蛋白发挥作用[9]。
东方粘虫[Mythimnaseparata(Walker)]属鳞翅目夜蛾科,主要危害玉米和小麦等禾本科作物,是亚洲和大洋洲许多国家农作物上的重要害虫之一,在中国、朝鲜、新西兰等地发生较为严重[10],曾在中国河北、内蒙古、吉林、黑龙江、辽宁、天津、东北等地造成严重危害[11-12]。目前,对粘虫的防治主要以化学防治为主。然而,随着人们对化学农药造成的环境污染和害虫抗药性等问题的日益关注,环境友好型农药的创制已成为防治害虫的重要途径。苦皮藤素V等一系列二氢沉香呋喃类化合物作用于昆虫的消化系统,可引起昆虫中肠上皮细胞的严重病变[13-15],且在昆虫中肠上皮细胞的刷状缘膜囊泡(BBMV)上存在苦皮藤素V的结合蛋白[16-17]。目前,已经验证V-ATPase H亚基是苦皮藤素V的作用靶标,并且发现MS-VATPa是苦皮藤素V的疑似作用靶标[18-19]。然而,针对MS-VATPa是否为苦皮藤素V的作用靶标尚需进一步验证。
因此,本研究对东方粘虫中肠MS-VATPa基因进行克隆、原核表达与纯化研究,以期为进一步探索MS-VATPa的结构与功能、苦皮藤素V与V-ATPase的分子作用机制以及基于MS-VATPa为筛选模型的新农药创制奠定基础。
1 材料与方法
1.1 材 料
1.1.1 供试昆虫 东方粘虫由西北农林科技大学植物保护学院农药研究所提供,在(25±1)℃、相对湿度为60%~70%的条件下,室内人工饲养。
1.1.2 主要试剂 Trizol Reagent购自Invitrogen公司;5′-RACE和3′-RACE试剂盒、PrimeSTAR○RHS DNA Polymerase、DL5000 marker、PrimeScriptTMRT reagent Kit with gDNA Eraser、快捷型琼脂糖凝胶DNA回收试剂盒购自西安热默尔生物科技有限公司;限制性内切酶NdeⅠ和XhoⅠ购自NEB公司;Plasmid Mini Kit Ⅰ购自Omega公司;Ni-NTA agarose柱购自GE公司;蛋白marker购自北京索莱宝科技有限公司;辣根过氧化物酶(HRP)标记的抗His标签鼠单克隆抗体、DAB显色试剂盒购自北京康为世纪生物科技有限公司;原核表达载体pET-22b(+)的质粒为西北农林科技大学植保学院农药研究所实验室所保存;其余相关试剂为进口或国产分析纯均购自西安博美天成化玻有限公司。
1.1.3 主要仪器 超净工作台(苏州安泰空气技术有限公司,SW-CJ-2FD型),PCR仪(珠海黑马医学仪器有限公司,Hema 9700型),旋涡混合器(江苏海门市其林贝尔仪器制造有限公司,QL-901型),小型台式离心机(Thermo Scientific Heraeus Pico),冷冻离心机(Thermo Scientific Biofuge Stratos,sorvall ST16R),GelDoc凝胶成像系统(BIO-RAD公司),紫外可见分光光度计(北京普析通用仪器有限责任公司,TU-1810APC型),电泳仪电源(北京六一仪器厂,DYY-6D型),电热恒温培养箱(上海森信实验仪器有限公司,DRP-9030型),全温振荡培养箱(太仓市实验设备厂,HZQ-F100型),pH计(METTLER-TOLEDO公司),Synergy超纯水系统(Millipore 公司,Synergy型),水浴锅(上海博迅实业有限公司)。
1.2 试验方法
1.2.1 总RNA的提取与第一链cDNA的合成 选取6龄东方粘虫,严格按照Trizol Reagent说明书提取东方粘虫中肠总RNA,用10 g/L琼脂糖凝胶电泳检测总RNA的完整性,并用紫外分光光度计测定OD260/OD280值。将提取的总RNA放入-80 ℃冰箱中保存,待用。以获得的总RNA为模板,严格按照RT-PCR说明书反转录合成第一链cDNA,并放入-20 ℃冰箱,备用。
1.2.2 cDNA序列片段的的克隆 通过比对烟草天蛾(CAB55500.1_1)、小菜蛾(XP_011561281.1_1)和家蚕(XP_004931129.1_1)3种昆虫的MS-VATPa基因序列,设计1对特异性引物aF和aR(表1)扩增东方粘虫MS-VATPa基因cDNA序列片段。PCR反应程序:98 ℃预变性5 min;98 ℃变性10 s,55 ℃退火5 s,72 ℃延伸1 min,共30个循环;72 ℃延伸10 min。用10 g/L琼脂糖凝胶电泳检测PCR产物,并将回收的PCR产物送至英潍捷基(上海)贸易有限公司测序。
1.2.3 5′和3′-RACE扩增 根据获得的cDNA部分序列设计特异性引物aGSPR和aGSPF(表1),分别用于5′端和3′端序列的扩增。PCR反应程序:94 ℃ 30 s;72 ℃ 3 min,共5个循环;94 ℃ 30 s;70 ℃ 30 s,72 ℃ 3 min,共5个循环;94 ℃ 30 s;68 ℃ 30 s,72 ℃ 3 min,共30个循环;最后72 ℃延伸10 min。经10 g/L琼脂糖凝胶电泳检测后,将回收产物送去测序。
1.2.4 cDNA全长序列的获得与验证 将“1.3.2”和“1.3.3”扩增的序列进行拼接获得MS-VATPa全长序列,设计1对特异性引物QCaGSPF和QCaGSPR(表1)进行PCR扩增,经10 g/L琼脂糖凝胶电泳检测后,将回收产物送测序。
1.2.5 构建重组载体 设计原核表达引物aEF和aER(表1)扩增MS-VATPa基因编码区,方法同“1.2.2”。将回收的扩增产物与pET-22b(+)质粒分别用NdeⅠ和XhoⅠ进行双酶切,把回收的酶切产物用T4连接酶连接构建重组载体pET22b-MS-VATPa,并转化至BL21(DE3)感受态,涂布平板,37 ℃过夜培养,挑选阳性单克隆,提取质粒进行PCR扩增及酶切检测,将检测正确的阳性菌液送测序。
1.2.6 诱导表达及SDS-PAGE检测 将测序结果正确的阳性菌株接种于5 mL含有100 μg/mL 氨苄青霉素的LB液体培养基中,37 ℃、200 r/min 过夜培养12 h;取0.5 mL菌液接种于50 mL含有100 μg/mL氨苄青霉素LB液体培养基中,相同条件下培养至OD600为0.6~0.8。吸取2 mL 菌体离心(5 000 r/min,4 ℃,5 min)后,弃去上清,保留菌体沉淀。加入IPTG至终浓度分别为0.3、0.6、0.9 mmoL/L,在16 ℃、160 r/min条件下诱导表达20~24 h,离心(5 000 r/min,4 ℃,15 min)收集菌体,用Lysis buffer(50 mmol/L Tris-HCl、300 mmol/L NaCl、10 mmol/L咪唑,pH 7.4)重悬菌体,加入适量的溶菌酶和核酸酶,冰浴条件下超声破碎菌体(功率100 W、工作时间6 s、间隔时间8 s、工作20~30 min),离心(12 000 r/min,4 ℃,30 min),分别收集上清和沉淀,并以SDS-PAGE电泳检测目标蛋白的表达情况。
1.2.7 目标蛋白的纯化及Western blot验证 采用Ni-NTA柱亲和层析法纯化上述目标蛋白粗提液,对收集的目标蛋白洗脱液进行SDS-PAGE电泳检测分析,并利用HRP标记的抗His标签鼠单克隆抗体对纯度较高的目标蛋白进行Western blot验证。

表1 试验所用引物Table 1 The primers used in the experiment
2 结果与分析
2.1 cDNA全长序列的获得与序列分析
将RT-PCR和RACE克隆获得的部分序列拼接后获得东方粘虫中肠MS-VATPa全长序列,PCR扩增产物经10 g/L琼脂糖凝胶电泳(图1)后显示:MS-VATPa基因的中间保守区片段、5′和3′-RACE及全长扩增的目的条带均与预期大小一致,表明成功克隆东方粘虫MS-VATPa基因全长序列。利用生物信息学软件分析发现该基因cDNA全长序列为3 538 bp,开放阅读框为2 511 bp,起始密码子ATG,终止密码子TAG,包含121 bp和905 bp的5′和3′非编码区,编码836个氨基酸,预测的蛋白质分子质量为95.75 ku,等电点(pI)为6.01,含有8个跨膜区(图2)。目前,已经获得该基因的GenBank登录号为KY921845。
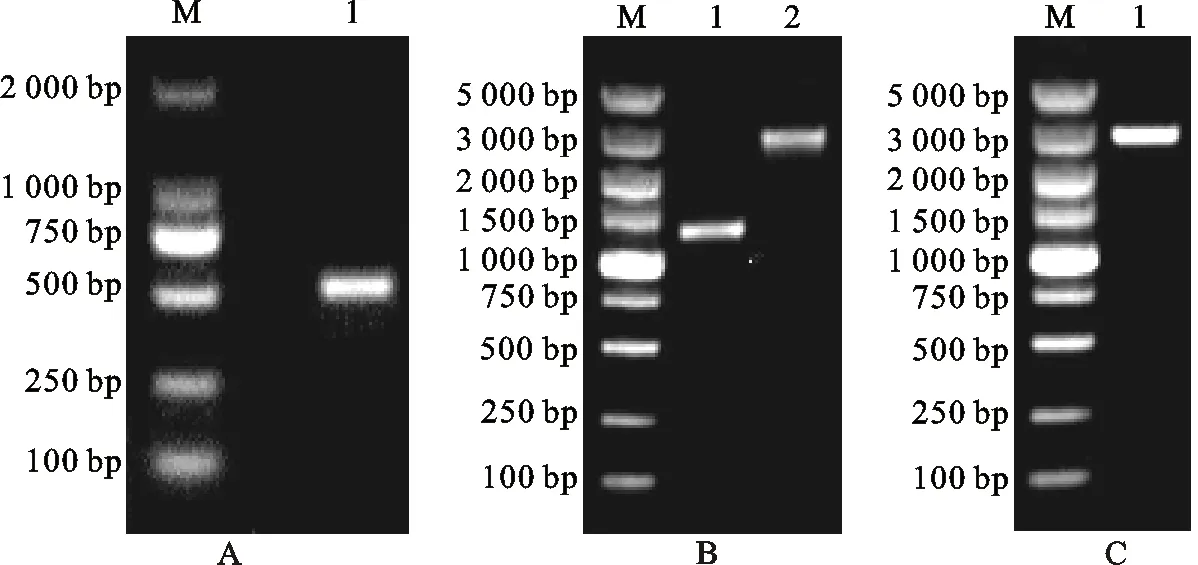
M. DNA marker;A:1.MS-VATPa的中间片段 Intermediate fragment of MS-VATPa;B:1.MS-VATPa的5′-RACE产物 5′-RACE product of MS-VATPa,2.MS-VATPa的3′-RACE产物 3′-RACE product of MS-VATPa;C:1.MS-VATPa全长的扩增产物 Amplification product of the full-length MS-VATPa
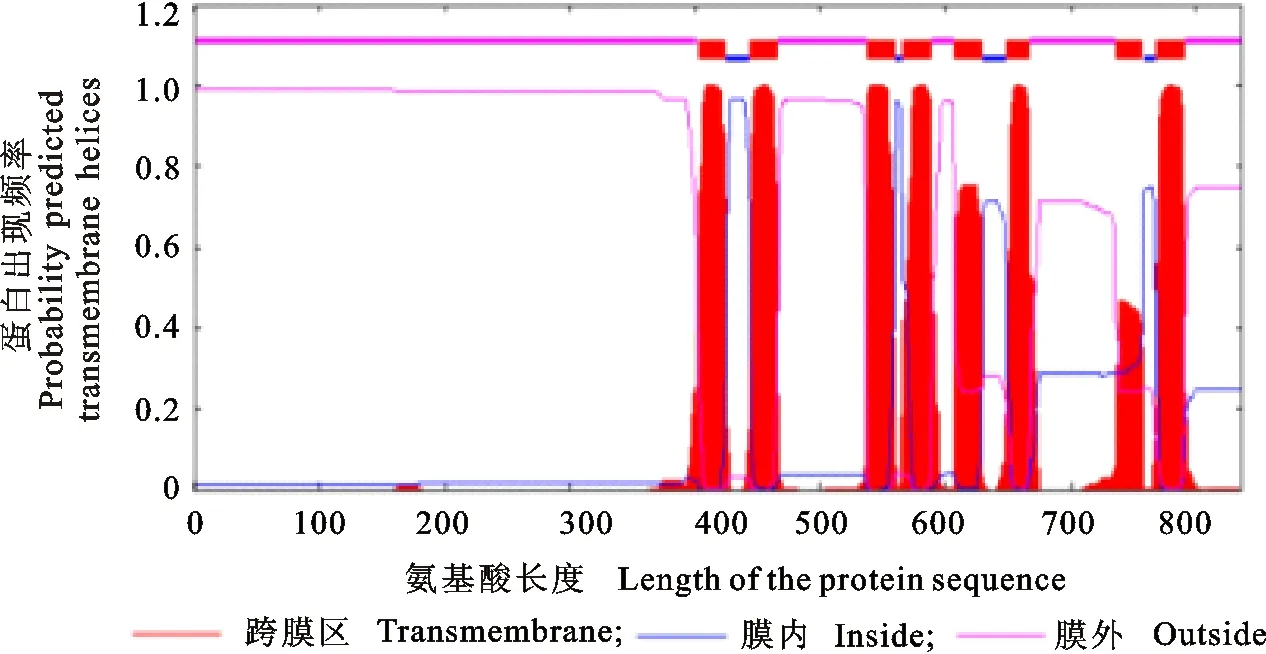
图2 MS-VATPa编码蛋白跨膜区预测Fig.2 Prediction of the transmembrane regions of the encoded protein of MS-VATPa
2.2 同源性及系统进化分析
根据NCBI数据库BLAST搜索发现东方粘虫MS-VATPa氨基酸序列与其他昆虫V-ATP酶a亚基氨基酸序列的一致性为75%~94%。通过多重序列比对发现不同物种间该基因编码氨基酸序列的差异不明显。采用MEGA 6.0中Neighbor-Joining法构建系统进化树(图3),可以看出东方粘虫与烟草天蛾(Manducasexta)、棉红铃虫(Pectinophoragossypiella)、小菜蛾(Plutellaxylostella)、脐橙螟(Amyeloistransitella)、家蚕(Bombyxmori)、玉带凤蝶(Papiliopolytes)、柑橘凤蝶(Papilioxuthus)等鳞翅目昆虫V-ATP酶a亚基具有较高同源性,进一步明确该序列的正确性。

图3 东方粘虫与其他昆虫MS-VATPa氨基酸序列的系统进化树Fig.3 Phylogenetic tree based on amino acid sequences of MS-VATPa of M.separate and other insects
2.3 重组载体的构建与鉴定
以提取的重组质粒pET22b-MS-VATPa为模板进行PCR检测(图4),结果显示扩增产物的条带大小与预期相符。经NdeⅠ和XhoⅠ双酶切鉴定(图5),结果显示重组质粒pET22b-MS-VATPa经双酶切后的载体条带与阴性对照基本一致,目的基因条带与预期大小基本相符。另外,重组子的测序结果显示亚克隆于pET-22b(+)载体的基因序列与目的基因序列大小一致。这表明成功构建重组表达载体pET22b-MS-VATPa。
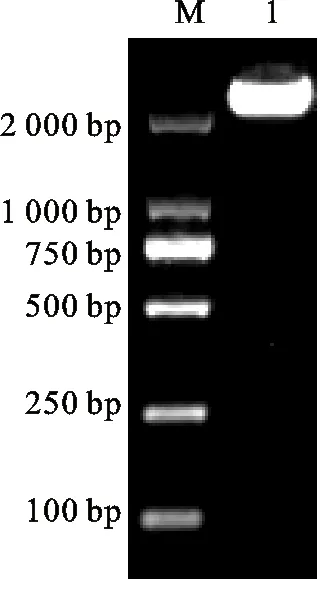
M. DL2000 DNA marker;1.pET22b-MS-VATPa质粒的扩增产物 Amplification product of pET22b-MS-VATPa plasmid

M.DL5000 DNA marker;1.pET22b-MS-VATPa重组质粒 The recombination plasmid of pET22b-MS-VATPa;2.pET22b-MS-VATPa双酶切产物 Double enzyme digestion product of pET22b-MS-VATPa
2.4 pET22b-MS-VATPa诱导表达及纯化分析
将鉴定正确的重组质粒pET22b-MS-VATPa转入BL21(DE3)菌株经不同浓度IPTG诱导表达后,经SDS-PAGE电泳检测(图6)发现目标蛋白的条带与预测分子质量相符。另外,纯化后的目标蛋白的SDS-PAGE电泳检测(图7-A)和Western blot验证(图7-B)结果显示:表达1条带有6个His-tag的MS-VATPa融合蛋白,且条带大小约为96.6 ku,与理论预测值相一致。这表明成功实现MS-VATPa在大肠杆菌原核表达系统中的表达。
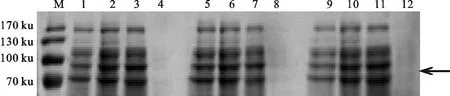
M.蛋白分子质量标准 Protein molecular mass marker;1、5、9.pET22b-MS-VATPa在加IPTG诱导前的表达产物 The expression products of pET22b-MS-VATPa before inducing with IPTG;2、6、10.pET22b-MS-VATPa分别在0.3、0.6 和1 mmoL·L-1 IPTG条件下诱导的表达产物 The expression products of pET22b-MS-VATPa with 0.3, 0.6 and 1 mmoL·L-1 IPTG, respectively;3、7、11.pET22b-MS-VATPa经IPTG诱导表达后超声破碎的上清 The ultrasonication supernatant of pET22b-MS-VATPa induced with IPTG;4、8、12.pET22b-MS-VATPa经IPTG诱导表达后超声破碎的沉淀 The ultrasonication precipitation of pET22b-MS-VATPa by inducing with IPTG
图6pET22b-MS-VATPa的原核表达
Fig.6ProkaryoticexpressionofpET22b-MS-VATPa
3 讨论与结论
近年来,新农药的创制转变为以分子靶标为导向的农药创制,而以天然活性物质为探针是发现新靶标的研究热点。本研究克隆获得的MS-VATPa基因预测编码蛋白含有8个跨膜螺旋,与其他文献报道的V-ATPase a亚基含有8个跨膜螺旋一致[20-21]。通过对MS-VATPa序列同源相似性搜索发现东方粘虫与多种鳞翅目昆虫 V-ATPase a亚基序列具有较高同源性,所构建的系统发育树也表现出相似的结果,且该序列与多种昆虫V-ATPase a1亚型具有较高的同源性。

A:MS-VATPa重组蛋白的SDS-PAGE分析 SDS-PAGE analysis of the MS-VATPa recombianant protein,1. MS-VATPa重组蛋白 MS-VATPa recombianant protein;B:MS-VATPa重组蛋白Western blot分析 Western blot analysis of the MS-VATPa recombianant protein,1. MS-VATPa重组蛋白 MS-VATPa recombianant protein
这些结果表明MS-VATPa基因与多种昆虫V-ATPase a亚基既具有较高的保守性,又存在一定程度的差异,进一步证明所得MS-VATPa序列的准确性。
在本研究中,针对东方粘虫MS-VATPa基因构建pET22b-MS-VATPa原核表达载体,该载体上有6个His-tag,能够与Ni-NTA柱中的Ni2+相互结合,便于目标蛋白的纯化。SDS-PAGE和Western blot分析结果表明成功表达出MS-VATPa融合蛋白。然而,在实际诱导表达中,该融合蛋白的表达量相对较低,分析原因可能是由于其在进行原核表达时受多种因素影响,例如,表达载体和宿主菌的选择、诱导条件(如温度、时间、浓度)、目标蛋白本身的特性等,具体原因有待进一步研究确定。
近年来,越来越多的研究者发现利用RNAi技术可以使昆虫V-ATPase基因的表达量降低,进而导致昆虫死亡[22]。有报道[23]称V-ATPase基因突变会引起运输障碍及昆虫死亡。Ahmed利用RNAi干扰技术沉默棉红铃虫体内a亚基基因,能够降低其表达水平而导致害虫死亡[24]。V-ATPase还参与昆虫对Bt毒素和农药的抗性作用[25-26]。此外,研究者[27-29]发现Bafilomycins和Conannamycins两类V-ATPase抑制剂能与a亚基结合而影响质子的转运。这不仅说明V-ATPase a亚基在昆虫体内具有重要的作用,也为农药的创制提供新的思路。
本研究从东方粘虫中肠首次克隆获得V-ATP酶a亚基基因cDNA全长序列,并对其相关分子特性进行分析,成功实现MS-VATPa基因在大肠杆菌原核表达系统中的表达。该研究结果为进一步探究东方粘虫MS-VATPa的生物学功能,苦皮藤素V与V-ATP酶的分子作用机制,以及基于MS-VATPa为靶标的新药筛选模型提供重要基础。
参考文献Reference:
[1] ROBERTSON S L,NI W,DHADIALLA T S,etal.Identification of a putative azadirachtin-binding complex fromDrosophilaKc167 cells[J].ArchivesofInsectBiochemistryandPhysiology,2007,64(4):200-208.
[2] KRISHAMOORTHY M,JURAT-FUENTES J L,MCN- ALL R J,etal.Identification of novel Cry1Ac binding proteins in midgut membranes fromHeliothisvirescensusing proteomic analyses[J].InsectBiochemistryandMolecularBiology,2006,37(3):189-201.
[3] STEVENS T H,FORGAC M.Structure,function and regulation of the vacuolar(H+)-ATPase[J].AnnualReviewofCellandDevelopmentalBiology,1997,13(13):779.
[4] BOKEMA E J,BREEMEN J F L V,BRISSON A,etal.Biological motors:connecting stalks in V-type ATPase[J].Nature,1999,401(6748):37-38.
[5] FUTAI M,OKA T,SUNWADAG,etal.Luminal acidification of diverse organelles by V-ATPase in animal cells[J].JournalofExperimentalBiology,2000,203(1):107-116.
[6] POWELL B,GRAHAM L A,STEVENS T H.Molecular characterization of the yeast vacuolar H+-ATPase proton pore[J].JournalofBiologicalChemistry,2000,275(31):23654-23660.
[7] ANRAKU Y,UMEMOTO N,HIRATA R,etal.Structure and function of the yeast vacuolar membrane proton ATPase[J].JournalofBioenergeticsandBiomembranes,1989,21(5):589.
[8] TOEI M,TOEI S,FORGAC M.Definition of membrane topology and identification of residues important for transport in subunit a of the vacuolar ATPase[J].JournalofBiologicalChemistry,2011,286(40):35176-35186.
[9] WIECZOREK H,BROWN D,GRINSTEIN S,etal.Animal plasma membrane energization by proton-motive V-ATPase[J].Bioessays,1999,21(8):637-648.
[10] SHARMA H C,SULLIVAN D J,BHATNAGAR V S.Population dynamics and natural mortality factors of the Oriental armyworm,Mythimnaseparata(Lepidoptera:Noctuidae),in South-Central India[J].CropProtection,2002,21(9):721-732.
[11] 张云慧,张 智,姜玉英,等.2012年三代黏虫大发生原因初步分析[J].植物保护,2012,38(5):1-8.
ZHANG Y H,ZHANG ZH,JIANG Y Y,etal.Prelimunary analysis of the outbreak of the third-generation armywormMythimnaseparatain China in 2012[J].PlantProtection,2012,38(5):1-8.
[12] 晋齐鸣,高月波,苏前富,等.玉米粘虫暴发流行对玉米产量和性状表征的影响[J].玉米科学,2013,21(6):131-134.
JIN Q M,GAO Y B,SU Q F,etal.Effect of heavy damage caused by oriental armyworm outbreak to corn yield and characteristics[J].JournalofMaizeSciences,2013,21(6):131-134.
[13] 刘惠霞,董育新,吴文君.苦皮藤素V对东方粘虫中肠细胞及其消化酶活性的影响[J].昆虫学报,1998,41(3):258-262.
LIU H X,DONG Y X,WU W J.Effects of celangulin V on the midgut cells and the digestive enzyme activities ofMythimnaseparata( Walker ) larver[J].ActaEntomologicaSinica,1998,41(3):258-262.
[14] 杨润亚,刘惠霞,胡兆农,等.苦皮藤素V引起粘虫失水的作用机理初探[J].西北农林科技大学学报(自然科学版),2001,29(2):77-79.
YANG R Y,LIU H X,HU ZH N,etal.Study on the mechanism of action of celangulin V[J].JournalofNorthwestSci-TechUniversityofAgricultureandForestry(NatureScienceEdition),2001,29(2):77-79.
[15] QI Z J,XUE X P,WU W J,etal.Preparation of monoclonal antibody against celangulin V and immunolocalization of receptor in the oriental armyworm,MythimnaseparataWalker(Lepidoptera:Noctuidae)[J].JournalofAgriculturalandFoodChemistry,2006,54(20):7600-7605.
[16] 马彩霞,刘惠霞,吴文君.粘虫不同发育期体内储存蛋白的检测及苦皮藤素V对其含量的影响[J].昆虫学报,2006,9(1):58-63.
MA C X,LIU H X,WU W J.Detection of storage proteins in different developmental stages ofMythimnaseparataand the effect of celangulin V on their content[J].ActaEntomologicaSinica,2006,9(1):58-63.
[17] QI Z J,WU W J.Ultrastructural effects of celangulin V on midgut cells of the oriental armyworm,MythimnaseparataWalker(Lepidoptera:Noctuidae)[J].EcotoxicologyandEnvironmentalSafety,2011,74(3):439-444.
[18] LU L N,QI Z J,LI Q L,etal.Validation of the target protein of insecticidal dihydroagarofuran seaquiterpene polyesters[J].Toxins, 2016,8(3):79.
[19] 吴文君.植物杀虫剂苦皮藤素V作用靶标和作用机理研究进展[J].农 药,2016,55(8):547-550.
WU W J.Research advance on the acting target and mechanism of botanic insecticide celangulin V[J].Agrochemicals,2016,55(8):547-550.
[20] TOYOMURA T,OKA T,YAMAGUCH C,etal.Three subunit a isoforms of mouse vacuolar H(+)-ATPase.preferential expression of the a3 isoform during osteoclast differentiation[J].JournalofBiologicalChemistry,2000,275(12):8760-8765.
[21] KOTA Z,PALI T,DIXON N,etal.Incorporation of transmembrane peptides from the vacuolar H+-ATPase in phospholipid membranes:spin-label electron paramagnetic resonance and polarized infrared spectroscopy[J].Biochemistry,2008,47(12):3937-3949.
[22] 刘 希,周 琳,高 飞,等.V-ATPase分子结构与功能及其RNAi技术在害虫防治中的应用研究进展[J].河南农业科学,2014,43(5):1-5.
LIU X,ZHOU L,GAO F,etal.Advance in molecular structures and functions of V-ATPase and application of related RNAi technology in insect management[J].JournalofHenanAgriculturalScience,2014,43(5):1-5.
[23] YAN Y,DENEF N,SCHUPBACH T.The vacuolar proton pump,V-ATPase,is requied for notch signaling and endosomal trafficking inDrosophila[J].DevelopmentalCell,2009,17(3):387-402.
[24] AHMED M A.RNAi-based silencing of genes encoding the vacuolar-ATPase subunits a and c in pink bollworm(Pectinophoragossypiella)[J].AfricanJournalofBiotechnology,2016,15(45):2547-2557.
[25] 陈利珍.棉铃虫中肠Cry1A结合蛋白分离、鉴定及其与抗性的关系[D].北京:中国农业科学院,2008.
CHEN L ZH.The seperation and identification of the Cry1Ac binding proteins in larval midgut ofHelicoverpaarmigeraand their alterations in Cry1Ac-resistantH.armigeralarvae[D].Beijing:Chinese Academy of Agricultural Sciences,2008.
[26] 徐丽娜.Cry1Ab抗性亚洲玉米螟对不同Bt毒素的交互抗性及其产生的分子机理[D].北京:中国农业科学院,2010.
XU L N.Cros-resistence and molectular mechanism of Cry1Ab-selectedOstriniafurnacalisto other Bt toxins[D].Beijing:Chinese Academy of Agricultural Sciences,2010.
[27] BOWAN E J,SIEBERS A,ALTENDORF K.Bafilomycins:a class of inhibitors of membrane ATPases from microorganisms,animal cells,and plant cells[J].ProceedingsoftheNationalAcademyofSciences,1988,85(21):7972-7976.
[28] DROESE S,KAI U B,BOWMAN E J,etal.Inhibitory effect of modified bafilomycins and concanamycins on P- and V-type adenosinetri-phosphatases[J].Biochemistry,1993,32(15):3902-3906.
[29] KINASHI H,SOMENO K,SAKAGUCHI K.Isolation and characterization of concanamycins A,B and C[J].JournalofAntibiotics,1984,37(11):1333-1343.
