PI3K/AKT信号通路在大鼠腹腔感染性脓毒症急性肾损伤中的作用
2018-07-04杨蕊许华王兵王勇强
杨蕊,许华,王兵,王勇强△
脓毒症是机体对感染的反应失调而导致的危及生命的器官功能障碍,是重症监护病房(ICU)患者死亡的首要因素[1]。其中肾脏是最常受累的器官之一,急性肾损伤(acute kidney injury,AKI)常常是预测脓毒症患者死亡的独立危险因素。白细胞介素(IL)-1β及IL-18作为炎症形成早期的主要促炎因子[2],其释放受半胱氨酸天冬氨酸特异性蛋白酶1(Caspase-1)的调控,而后者又与Nod样受体蛋白3(NLRP3)炎性小体密切相关[3]。作为一种蛋白复合物,NLRP3炎性小体包括NLRP3、Caspase-1和凋亡相关斑点样蛋白(ASC)。磷脂酰肌醇3-激酶/蛋白激酶B(PI3K/AKT)通路在炎症反应过程中也发挥重要作用,其活化后可诱导NLRP3炎性小体表达升高[4]。本研究通过盲肠结扎穿孔法(cecal ligation and puncture,CLP)复制大鼠腹腔感染性脓毒症模型,并通过检测相关指标确认AKI的发生,进而探讨PI3K/AKT通路及NLRP3炎性体激活在大鼠腹腔感染性脓毒症相关AKI发病中的作用,为防治脓毒症AKI提供新思路。
1 材料与方法
1.1 材料
1.1.1 实验动物及分组 清洁级雄性SD大鼠70只,8~10周龄,体质量220~250 g,购于解放军军事医学科学院卫生学环境医学研究所动物实验中心,所有大鼠均在同一实验室按照清洁级要求适应性饲养1周,室温(20±1)℃,湿度(60±10)%,每日光照12 h。所有大鼠采用随机数字表法分为假手术组(n=10)、CLP 24 h组(n=20)、CLP 48 h组(n=20)、CLP 72 h组(n=20)。
1.1.2 主要试剂及仪器 ABI-7500 Real-time PCR检测仪购自美国ABI公司;多功能酶标仪购自美国BioTek公司;EPS300电泳仪购自美国Bio-Rad公司;FluorChemFC2型显影仪购自美国Alpha Innotech公司;Real-time PCR试剂盒购自美国CWbio公司;兔抗大鼠NLRP3多克隆抗体、山羊抗大鼠ASC多克隆抗体、兔抗大鼠Caspase-1单克隆抗体购自美国Abcam公司,小鼠抗大鼠β-actin单克隆抗体购自美国abbkine公司;肿瘤坏死因子-α(TNF-α)、IL-1β及IL-18酶联免疫吸附法(ELISA)检测试剂盒购自美国RayBiotech公司;辣根过氧化物酶标记的山羊抗兔抗体、兔抗山羊抗体、兔抗小鼠抗体购自武汉博士德生物工程有限公司。
1.2 方法
1.2.1 模型制备 根据Rittirsch等[5]报道的方法建立CLP诱导的大鼠腹腔感染性脓毒症模型。所有动物造模均在上午8:00—10:00进行,术前禁食不禁水,用5%水合氯醛溶液(6 mL/kg)对大鼠腹腔注射进行麻醉,腹正中切口切开1 cm,识别盲肠并将其拉出,在盲肠总长度50%处进行结扎,用18号针头在结扎线下5 mm处进行穿刺后将盲肠放回腹腔并关腹。假手术组操作与CLP组相同,但不进行盲肠结扎及穿孔。分别观察假手术组和CLP各组大鼠的外观形态、活动、饮食等情况。假手术组大鼠全部存活,CLP 24 h组死亡7只,CLP 48 h组死亡11只,CLP 72 h组死亡13只。
1.2.2 样本采集 在术后24、48、72 h对CLP各组及假手术组的存活大鼠进行腹主动脉取血,以2 000 r/min离心15 min后留取血清备用。大鼠处死后摘取肾脏组织,剪碎后冻存于-80℃备用。
1.2.3 肾脏功能检测 在术后24、48、72 h取血应用全自动生化分析仪检测血肌酐(Cr)和尿素氮(BUN)水平。
1.2.4 肾脏组织PI3K/AKT mRNA表达水平检测 取50~100 mg冷冻肾脏组织,按照试剂盒说明书先提取总RNA,之后逆转录合成cDNA。所有产物作为Real-time PCR的模板。根据NCBI基因库查询到的基因mRNA序列,用Primer-BLAST设计引物(表1),进行扩增,以GAPDH作为内参,用ABI 7500 Real-time PCR System进行检测,采集荧光信号制作融解曲线,所得Ct值用2-ΔΔCt法计算目的基因相对表达量。
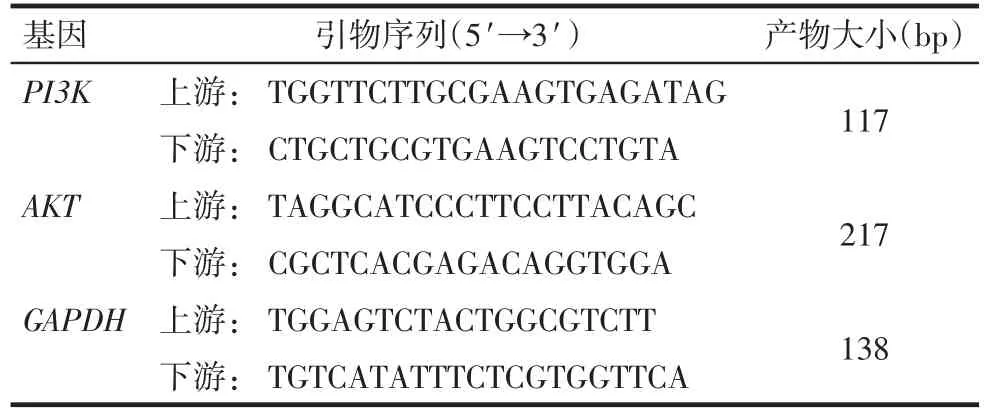
Tab.1 Real-time PCR primer sequences of PI3K/AKT表1 PI3K/AKT Real-time PCR引物序列
1.2.5 肾脏组织NLRP3炎性小体蛋白表达水平检测 应用蛋白质免疫印迹法(Western blot,WB)测定肾脏组织蛋白表达水平。组织冰上匀浆并裂解蛋白,4℃、12 000 r/min离心15 min,取上清,BCA蛋白定量,取20 μL蛋白样品进行电泳、转膜、封闭并孵育一抗4℃过夜;次日TBST洗膜后将膜与辣根过氧化酶标记的抗IgG抗体孵育,室温摇床上轻摇2 h,再用TBST洗膜,加显影液显影。采用Bio-Rad图像分析系统分析条带灰度值,以β-actin为内参,计算目的蛋白与内参蛋白灰度值比值得到目的蛋白相对表达量。
1.2.6 血清IL-1β、TNF-α及IL-18水平检测 严格按照ELISA试剂盒说明书检测血清IL-1β、TNF-α及IL-18水平。
1.3 统计学方法 使用SPSS 22.0统计软件对数据进行统计与分析,计量资料以均数±标准差(±s)表示,多组间比较采用单因素方差分析(One-way ANOVA),组间多重比较采用SNK-q检验,P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠肾脏组织一般情况及功能指标 腹腔解剖可见,CLP各组大鼠肾脏组织呈暗红色,可见明显充血及肿胀。假手术组血Cr及BUN水平较低且平稳,与假手术组相比,CLP各组Cr及BUN水平明显升高,差异有统计学意义(P<0.05),见表2。表明脓毒症AKI模型制备成功。
Tab.2 Changes of serum levels of creatinine and blood urea nitrogen in four groups表2 各组大鼠血Cr及BUN变化 (±s)

Tab.2 Changes of serum levels of creatinine and blood urea nitrogen in four groups表2 各组大鼠血Cr及BUN变化 (±s)
**P<0.01;a与假手术组比较,b与CLP24 h比较,c与CLP48 h比较,P<0.05;表3~5同
n组别假手术组CLP 24 h组CLP 48 h组CLP 72 h组F 10 13 9 7 Cr(μmol/L)45.79±7.63 79.40±5.96a 80.42±8.87a 82.88±9.78a 66.249**BUN(mmol/L)7.78±1.53 18.35±2.21a 20.97±2.05ab 24.53±1.79abc 115.448**
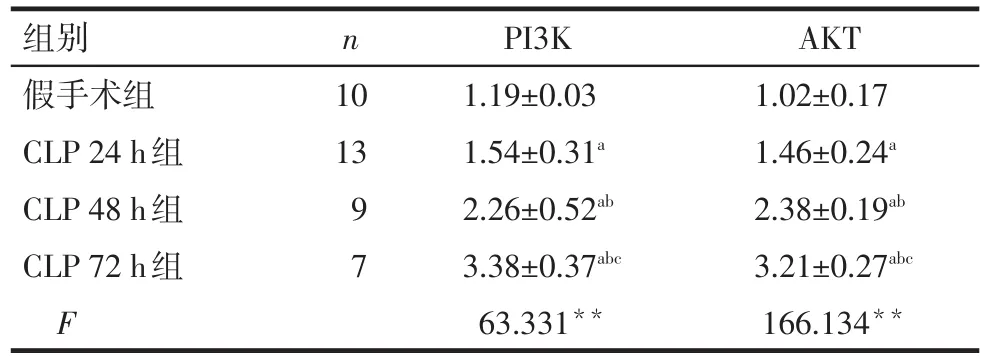
2.2 各组大鼠肾脏组织PI3K、AKT mRNA表达水平 假手术组大鼠肾脏组织PI3K、AKT mRNA的表达水平较低;与假手术组相比,CLP各组PI3K、AKT的mRNA表达水平明显升高,差异具有统计学意义(P<0.05),见表3。
Tab.3 The expression levels of PI3K and AKT mRNA in kidney tissues in four groups表3 各组大鼠肾脏组织中PI3K、AKT的mRNA表达水平(±s)
Tab.3 The expression levels of PI3K and AKT mRNA in kidney tissues in four groups表3 各组大鼠肾脏组织中PI3K、AKT的mRNA表达水平(±s)
n组别假手术组CLP 24 h组CLP 48 h组CLP 72 h组F 10 13 9 7 PI3K 1.19±0.03 1.54±0.31a 2.26±0.52ab 3.38±0.37abc 63.331**AKT 1.02±0.17 1.46±0.24a2.38±0.19ab 3.21±0.27abc 166.134**
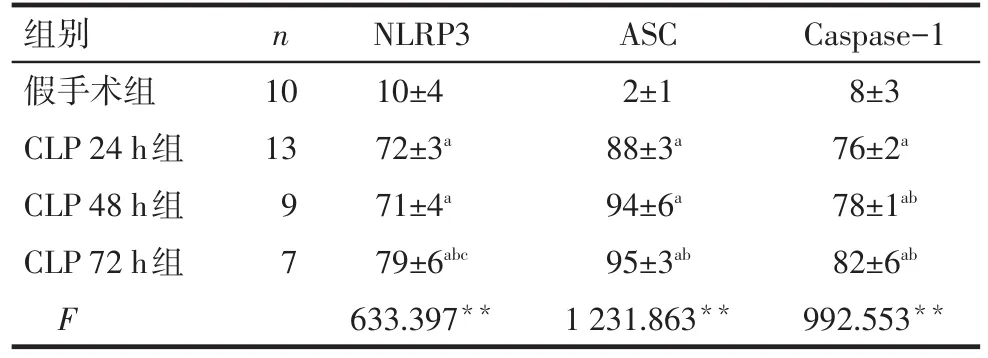
2.3 各组大鼠肾脏组织NLRP3炎性小体蛋白表达水平 与假手术组相比,CLP各组的NLRP3、ASC及Caspase-1的表达水平均显著升高,差异有统计学意义(P<0.05),见表4、图1。
Tab.4 The expression levels of NLRP3/ASC/Caspase-1 in kidney tissues in four groups表4 各组大鼠肾脏组织中NLRP3/ASC/Caspase-1的蛋白表达水平 (%,±s)
Tab.4 The expression levels of NLRP3/ASC/Caspase-1 in kidney tissues in four groups表4 各组大鼠肾脏组织中NLRP3/ASC/Caspase-1的蛋白表达水平 (%,±s)
n组别假手术组CLP 24 h组CLP 48 h组CLP 72 h组F 10 13 9 7 NLRP3 10±4 72±3a 71±4a 79±6abc 633.397**ASC 2±1 88±3a 94±6a 95±3ab 1 231.863**Caspase-1 8±3 76±2a 78±1ab 82±6ab 992.553**
2.4 各组大鼠血清炎症因子表达水平 与假手术组相比,CLP各组的血清TNF-α、IL-1β及IL-18水平均显著升高(P<0.01)。其中CLP 48、72 h组IL-1β水平较24 h组升高,而IL-18水平则出现下降(P<0.01),见表5。
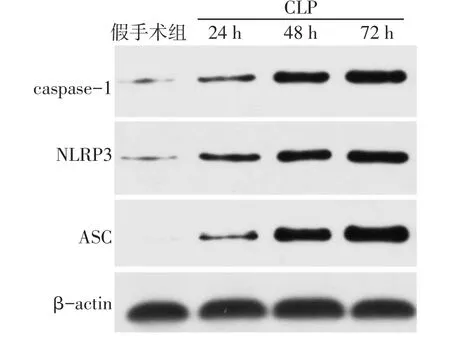
Fig.1 The expression levels of NLRP3/ASC/caspase-1 in kidney tissues of each group图1 各组大鼠肾脏组织中NLRP3/ASC/caspase-1的蛋白表达水平
Tab.5 The serum expression levels of TNF-α,IL-1β and IL-18 in four groups表5 各组大鼠血清TNF-α、IL-1β、IL-18的表达水平(ng/L,±s)
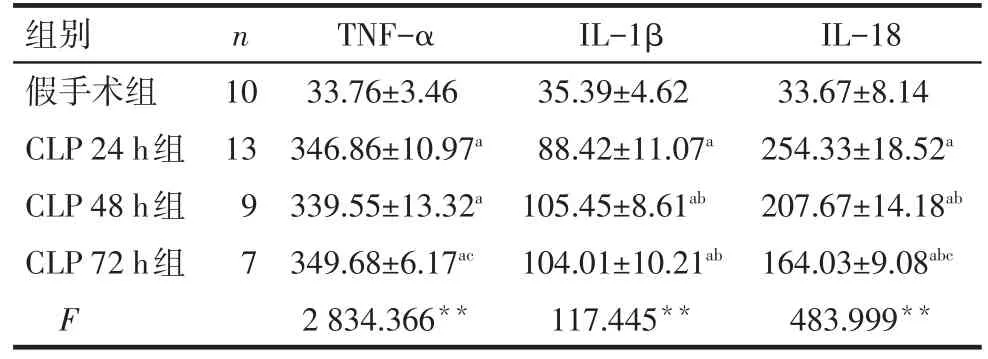
Tab.5 The serum expression levels of TNF-α,IL-1β and IL-18 in four groups表5 各组大鼠血清TNF-α、IL-1β、IL-18的表达水平(ng/L,±s)
n组别假手术组CLP 24 h组CLP 48 h组CLP 72 h组F 10 13 9 7 TNF-α 33.76±3.46 346.86±10.97a 339.55±13.32a 349.68±6.17ac 2 834.366**IL-1β 35.39±4.62 88.42±11.07a 105.45±8.61ab 104.01±10.21ab 117.445**IL-18 33.67±8.14 254.33±18.52a 207.67±14.18ab 164.03±9.08abc 483.999**
3 讨论
据世界卫生组织不完全统计,发达国家脓毒症发病率以每年8%~13%的速度急剧增加,且住院患者的病死率高达30%~60%,而高龄患者的病死率达50%以上[6]。脓毒症以严重的炎症反应为特征,而失控性炎症反应是导致多器官功能障碍综合征的主要因素之一。肾脏是炎症因子首要攻击的靶器官之一[7],其内皮细胞被激活后会产生炎症因子。传统意义上认为肾脏损伤是血流动力学改变导致的肾脏缺血[8],但近年来的研究认为,脓毒症AKI的发生主要与应激激素、炎性介质、内毒素、内皮素、血管内皮与一氧化氮合酶、活性氧簇等有关[9]。本实验通过检测与大鼠肾脏功能相关的指标Cr、BUN,证实腹腔感染性脓毒症造成了AKI,进而对肾脏组织内的PI3K/AKT信号通路及NLRP3炎性小体进行检测,明确其在脓毒症AKI发生发展中的作用。
机体在缺氧、感染或饥饿时利用溶酶体降解自身受损的细胞器和大分子物质,为细胞修复及更新提供原料与营养,保持能量稳态,而PI3K/AKT是影响这个过程的重要信号通路。PI3K属于脂质激酶家族,能使肌醇环第3位羟基磷酸化为磷脂酰肌醇激酶。AKT是丝氨酸/苏氨酸激酶,可调节细胞周期、增殖、凋亡等活动。PI3K/AKT通路活化后可激活固有免疫系统,而模式识别受体是固有免疫系统激活的必备条件[10]。NLRP3炎性小体作为胞浆内的一种模式识别受体,主要是由NLRP3、衔接蛋白ASC及Caspase-1三部分组成的蛋白复合物[11]。研究表明在炎症反应中抑制PI3K/AKT通路后NLRP3的表达降低,IL-1β释放量显著减少[12]。本次研究亦证实,与假手术组相比,CLP各组大鼠肾脏组织PI3K、AKT的mRNA的表达水平明显升高,CLP各组大鼠肾脏组织NLRP3、ASC及Caspase-1的表达水平也显著升高,表明在脓毒症AKI时PI3K/AKT活化并激活其下游的NLRP3炎性小体,使其释放量明显增加,从而加重机体的炎症反应。
在脓毒症中TNF-α、IL-1β和IL-18是具有诊断和预测价值的炎症因子[13]。IL-18属于IL-1家族的促炎症因子,主要由巨噬细胞释放并诱导干扰素(IFN)-γ,IFN-γ通过合成NO发挥抗菌和抗病毒作用[14]。Vanden Berqhe等[10]利用IL-1β/IL-18基因敲除的小鼠建立CLP脓毒症模型,发现同时缺乏IL-1β和IL-18的小鼠由于自身具有保护性而不表现出脓毒症症状。本研究显示,与假手术组相比,CLP各组的IL-1β、TNF-α及IL-18水平均显著升高(P<0.01),考虑脓毒症AKI时有大量的炎性介质释放,其中IL-1β和IL-18水平的迅速升高可能与炎性小体活化有关。但本次研究未检测脓毒症AKI早期的细胞因子水平及炎性小体释放量的变化。
综上所述,在大鼠腹腔感染性脓毒症AKI模型中PI3K/AKT通路介导NLRP3炎性小体表达增加,进而使其下游炎症因子释放增加而加重脓毒症AKI症状,提示PI3K/AKT在一定程度上参与脓毒症AKI病情的进展,IL-1β、IL-18可在一定意义上提示脓毒症AKI病情的严重程度,但其具体作用机制仍需进一步研究。
[1]Rhodes A,Evans LE,Alhazzani W,et al.Surviving Sepsis Campaign:International Guidelines for Management of Sepsis and Septic Shock:2016[J].Crit Care Med,2017,45(3):486-552.doi:10.1007/s00134-017-4683-6.
[2]Martinon F,Burns K,Tschopp J.The inflammasome:a molecular platform triggering activation of inflammatory caspases and processing of proIL-beta[J].Mol Cell,2002,10(2):417-426.
[3]Vladimer GI,Marty-Roix R,Ghosh S,et al.Inflammasomes and host defenses against bacterial infections[J].Curr Opin Microbiol,2013,16(1):23-31.doi:10.1016/j.mib.2012.11.008.
[4]Qiu Y,Huang X,Huang L,et al.5-HT receptor antagonist improves behavior performance of delirium rats through inhibiting PI3K/Akt/mTOR activation-induced NLRP3 activity[J].IUBMB Life,2016,68(4):311-319.doi:10.1002/iub.1491.
[5]Rittirsch D,Huber-Lang MS,Flierl MA,et al.Immunodesign of experimental sepsis by cecal ligation and puncture[J].Nat Protoc,2009,4(1):31-36.doi:10.1038/nprot.2008.214.
[6]Terashima A,Okamoto K,Nakashima T,et al.Sepsis-induced osteoblast ablation causes immunodeficiency[J].Immunity,2016,44(6):1434-1443.doi:10.1016/j.immuni.2016.05.012.
[7]Aird WC.The role of the endothelium in severe sepsis and multiple organ dysfunction syndrome[J].Blood,2003,101(10):3765-3777.
[8]Boffa JJ,Arendshorst WJ.Maintenance of renal vascular reactivity contributes to acute renal failure during endotoxemic shock[J].J Am Soc Nephrol,2005,16(1):117-124.
[9]Vanmassenhove J,Glorieux G,Hoste E,et al.AKI in early sepsis is a continuum from transient AKI without tubular damage over transient AKI with minor tubular damage to intrinsic AKI with severe tubular damage[J].Int Urol Nephrol,2014,46(10):2003-2008.doi:10.1007/s11255-014-0822-y.
[10]Vanden Berqhe T,Demon D,Boqaert P,et al.Simultaneous targeting of IL-1 and IL-18 is required for protection against inflammatory and septic shock[J].Am J Respir Crit Care Med,2014,189(3):282-291.doi:10.1164/rccm.201308-1535OC.
[11]Stutz A,Golenbock DT,Latz E.Inflammasomes:too big to miss[J].J Clin Invest,2009,119(12):3502-3511.doi:10.1172/JCI40599.
[12]Qiao J,Liu Y,Li X,et al.Elevated expression of NLRP3 in patients with immune thrombocytopenia[J].Immunol Res,2016,64(2):431-437.doi:10.1007/s12026-015-8686-5.
[13]Sims JE.IL-1 and IL-18 receptors,and their extended family[J].Curr Opin Immunol,2002,14(1):117-122.
[14]Seeley EJ,Matthay MA,Wolters PJ.Inflection points in sepsis biology:from local defense to systemic organ injury[J].Lupus,2012,303(5):L355.doi:10.1152/ajplung.00069.2012.
