角鲨烯对HepG2细胞LDLR表达的影响及机制初探
2018-07-04赵丽萍余超超范春雷
李 婷,赵丽萍,余超超,田 男,范春雷
(浙江中医药大学生命科学学院,浙江 杭州 310053)
动脉粥样硬化(atherosclerosis,AS)是诱发脑血管疾病的主要病理基础,胆固醇代谢紊乱是AS发生的关键因素,降低血液胆固醇水平可减少AS的发病率和死亡率[1]。体内大部分胆固醇结合于低密度脂蛋白(low density lipoprotein,LDL),通过低密度脂蛋白受体(low density lipoprotein receptor,LDLR)进入肝脏代谢,因此,上调LDLR的表达是降低血液胆固醇浓度的主要手段。胆固醇合成受固醇调节元件结合蛋白(sterol regulatory element binding protein, SREBP)及其转运蛋白-固醇调节元件结合蛋白裂解激活蛋白(sterol regulatory element binding protein cleavage activating protein, SCAP)的调节。临床上,他汀类降胆固醇药,是一类羟甲基戊二酰辅酶A(hydroxy methylglutaryl coenzyme A,HMG-CoA)还原酶抑制剂[2-4]。但部分患者长期服用他汀类药物后会出现相关不良反应,如肝功能损害等[5]。因此,筛选新型降胆固醇药物是调血脂药物的研究重点。
角鲨烯是由 6个异戊二烯连接而成的不饱和三萜类化合物,具有广泛的生物活性[6-7]。Shin等[8]研究发现,外源性角鲨烯可以降低HMG-CoA还原酶的活性,抑制胆固醇的合成;Smith等[9]报道,角鲨烯能够通过激活过氧化物酶体增殖剂激活受体(peroxisome proliferators-activated receptors,PPARs),调节脂质代谢。目前关于角鲨烯是否能够上调LDLR的表达,及可能的作用机制尚未见报道。
胰岛素诱导基因( insulin-induced gene, Insig)是调控脂肪分化和脂质代谢的新基因,其编码的Insig2蛋白是一种内质网膜结合蛋白[10]。当细胞内胆固醇浓度较高时,其结合于SCAP的固醇敏感结构域,并以Insig2-SREBPs-SCAP 复合物形式附着在内质网上,阻止SCAP 护送SREBPs至高尔基体,调控 LDLR基因的转录,调节细胞内胆固醇水平[11-13]。实验室前期构建有青色荧光蛋白(cyan fluorescent protein,CFP)标签的Plv-CFPSCAP质粒和黄色荧光蛋白(yellow fluorescent protein,YFP)标签的Plv-YFP Insig2质粒,通过慢病毒转染的方法将二者共转染至HepG2细胞,获得稳定表达的报告基因细胞系,用于该靶点药物的研究。本研究检测不同浓度角鲨烯对HepG2细胞内源性LDLR表达活性的影响,通过荧光能量共振转移(fluorescence resonance energy transfer, FRET)技术,从细胞信号调控角度分析角鲨烯对SCAP蛋白和Insig2蛋白相互作用的影响,阐明角鲨烯降胆固醇的机制。
1 材料
1.1细胞与试剂人肝癌细胞HepG2购自中科院上海细胞所;CFPSCAP/YFPInsig2/HepG2报告基因细胞系由本实验室前期建立。角鲨烯(CAS:111-02-4)购自梯希爱(上海)化成工业有限公司,批号S3626;细胞膜红色荧光探针 (DiI),购自杭州碧云天生物技术有限公司,批号C1036。
1.2仪器Guava EasyCyte 8微流式细胞分析仪(美国EMD Millipore公司);DS-5M-L1荧光倒置显微镜(日本尼康仪器有限公司);细胞能量代谢实时检测系统(德国FLUOstar Omega公司),型号BMG LABTECH。
2 方法
2.1细胞培养HepG2细胞呈贴壁生长,用含10%灭活胎牛血清的DMEM培养液在37℃、5% CO2条件下培养,采用0.25%胰酶消化,每3 d按1 ∶3的比例传代1次,取对数生长期的细胞用于实验。
2.2MTT实验取对数生长期的HepG2细胞,以5×103个/孔的密度接种于96孔板,置37℃、5% CO2培养箱中培养24 h后进行药物处理,设置空白对照组和终浓度分别为100、150、200、250、300、350、400 μmol·L-1的角鲨烯药物处理组,每组6个复孔。MTT具体操作按照试剂使用说明书进行。细胞增殖抑制率/%=(1-处理组吸光度/对照组吸光度)×100%。
2.3LDL的分离纯化和DiI-LDL的制备参考文献[13],利用密度梯度超速离心法分离人血浆中的LDL,通过Sepharse 6B凝柱层析进一步纯化,得到高纯度LDL。取4 mg DiI和l00 mg不溶性马铃薯淀粉用4 mL磷酸盐缓冲液( pH 7.4 )溶解后,置于试管中涡旋振荡,然后加入含1% DiI的甲醇溶液60 μL , 4℃放置 l h,冷冻干燥后,加入 2 mL 10 mmol·L-1三(羟甲基)甲基甘氨酸-叠氮化钠缓冲液(pH 8.2)。4℃冰箱中孵育,每隔2 h取出混匀1次;48 h后,4℃、2 000 r·min-1离心15 min;取上清4℃、2 000 r·min-1离心15 min;所得上清含有DiI-LDL,分装4℃保存。
2.4流式细胞术检测角鲨烯对HepG2细胞LDLR表达活性的影响将HepG2细胞分为A、B实验组,每个实验组分别加入0、5、15、25 μmol·L-1的角鲨烯处理细胞,每个药物浓度设3个复孔。将细胞分别加药后摇匀,置于37℃、5% CO2中培养。培养24 h后,吸去细胞培养液上清,在实验A组中均加入5 mg·L-1DiI-LDL,实验B组内均加入5 mg·L-1DiI-LDL和10 mg·L-1胆固醇溶液,置37℃、5% CO2中避光培养4 h,然后置4℃避光培养0.5 h后取出细胞,吸去上清,胰酶消化,离心取细胞沉淀,加入PBS溶液重悬细胞,再加入4%甲醛,吹匀静置10 min。离心弃去上清,用PBS溶液清洗3次,最后在每管细胞沉淀中加入300 μL PBS溶液重悬,用倒置荧光显微镜观察红色荧光亮度,流式细胞仪检测细胞中的DiI荧光量,实验结果中各组细胞平均红色荧光强度反映LDLR的活性。
2.5FRET检测角鲨烯对SCAP蛋白和Insig2蛋白相互作用的影响取对数期生长的CFPSCAP/YFPInsig2/HepG2细胞,以1.2×106个/孔的细胞密度接种于6孔板中。实验分为5组,第1组为空白对照组,不加任何药物;第2组为模型对照组,加入终浓度为10 mg·L-1的胆固醇溶液,不加角鲨烯;第3-5组为给药组,分别给予5、15、25 μmol·L-1的角鲨烯处理细胞。各组细胞置于37℃、5% CO2中培养12 h。然后各组细胞1 000 r·min-1离心5 min,弃上清,沉淀分别加入2 mL PBS溶液洗2遍。最后每组细胞沉淀用1 mL PBS溶液重悬,以每孔1×104个细胞接种于96孔板中,每组设5个复孔。使用FLUOstar Omega多功能荧光酶标仪检测SCAP蛋白和Insig2蛋白之间的相互作用,结果以每10 000个细胞的平均YFP荧光值表示。

3 结果
3.1角鲨烯对HepG2细胞活性的影响不同浓度的角鲨烯与HepG2细胞共培养24 h后,MTT法测定角鲨烯对HepG2细胞抑制率的影响。Fig 1结果显示,角鲨烯在0~400 μmol·L-1范围内对HepG2细胞抑制率均小于20%,未达到50%抑制率时的角鲨烯药物浓度(IC50)。因此,我们选取0~25 μmol·L-1浓度范围研究角鲨烯对细胞LDLR表达的影响。
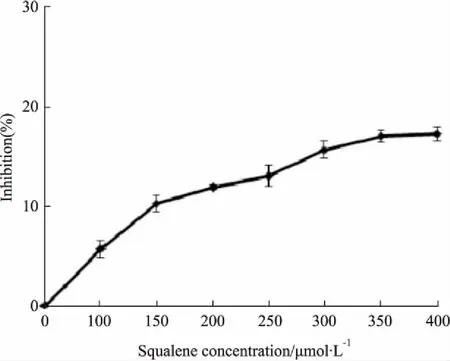
Fig 1 Effect of squalene on proliferation
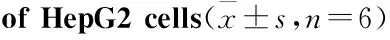
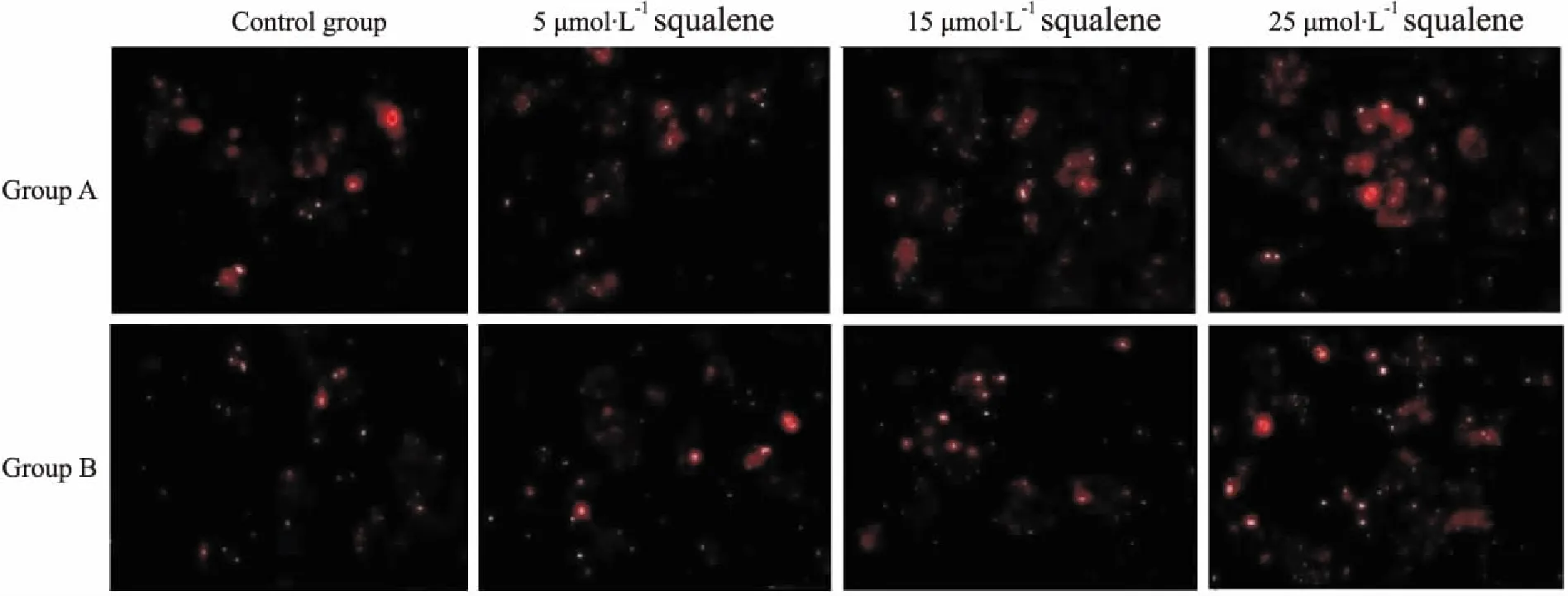
Fig 2 Effects of different concentrations of squalene on activity of LDLR in HepG2 cells(×20)
3.2角鲨烯上调HepG2细胞LDLR的表达活性Fig 2的倒置荧光显微镜结果显示,与对照组相比,经过角鲨烯处理后,HepG2细胞的DiI-LDL红色荧光强度逐渐增强,并呈浓度依赖性。Tab 1的流式细胞仪的检测结果表明,角鲨烯明显促进HepG2细胞 LDLR的表达活性,并且在0~25 μmol·L-1范围内,随着角鲨烯浓度的增高,LDLR表达活性增强,差异均具有统计学意义(P<0.05,P<0.01)。
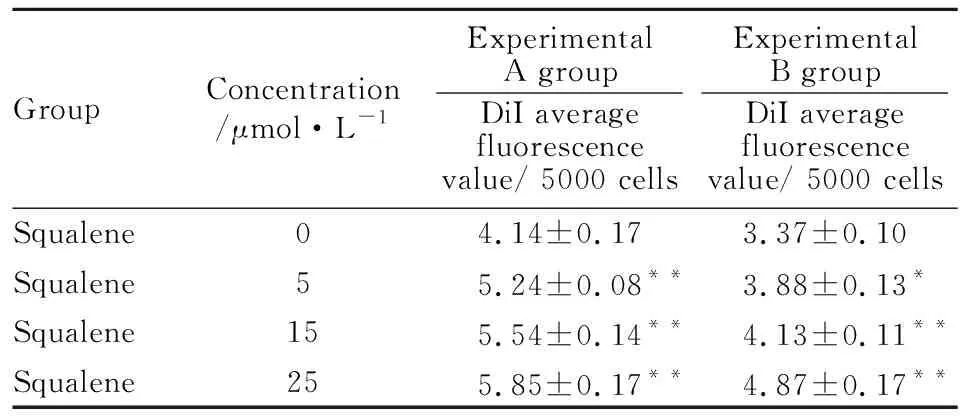
Tab 1 Effect of different concentrations of squalene on LDLR activity in HepG2 cells by flow cytometry
*P<0.05,**P<0.01vscontrol
3.3角鲨烯对SCAP蛋白和Insig2蛋白相互作用的影响Tab 2的FRET检测结果显示,与模型对照组相比,角鲨烯组YFP荧光值降低,而在5~25 μmol·L-1范围内,随角鲨烯浓度的增高,YFP荧光值降低。YFP的平均荧光值越低,说明角鲨烯能够降低SCAP与Insig2的结合率,激活了SCAP/SREBP固醇调控通路,差异均具有统计学意义(P<0.01)。
4 讨论
肝脏是人体脂蛋白及LDL-C代谢的主要脏器,所以选用人肝细胞系 HepG2 细胞,该细胞系能够正常表达参与胆固醇和脂质代谢有关的酶类和蛋白,目前已被广泛应用于LDLR作用途径及调脂药物筛选和作用机制的研究。
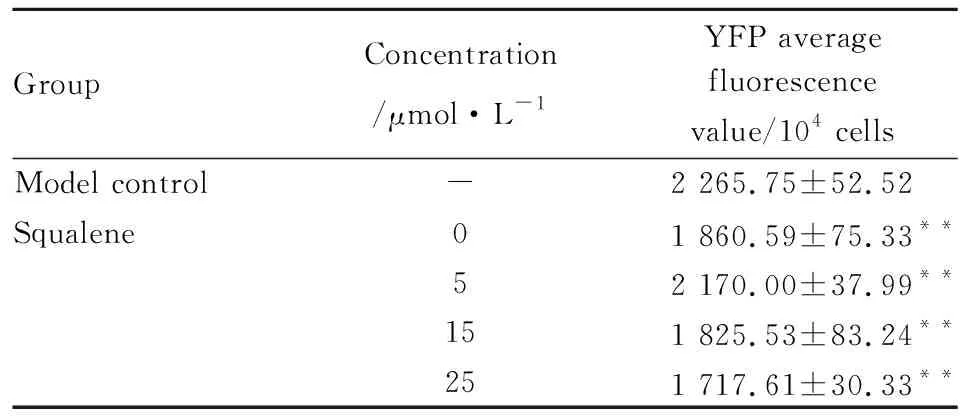
Tab 2 Effect of squalene on SCAP and Insig2 protein binding shown by FRET results
**P<0.01vsmodel control
采用MTT法检测角鲨烯对HepG2细胞的毒性。前期经过一系列MTT预实验的数据表明,角鲨烯在400 μmol·L-1浓度内对细胞的毒性较小,当角鲨烯的浓度超过25 μmol·L-1时,药效已达到饱和,再选取更高浓度已没有意义。所以我们以此为参照,选取低、中、高3个不同浓度的角鲨烯进行实验。DiI 是一种羰花青染料,可以与脂蛋白结合,独有的羰花青探针可以嵌入细胞膜做侧向扩散运动,从而标记整个细胞。流式细胞仪的检测结果显示,在同一角鲨烯浓度下,实验A组的平均荧光强度值均高于实验B组,实验B组中加入10 mg·L-1胆固醇,胞内胆固醇浓度增高,胆固醇能特异性吸收DiI-LDL标记的LDLR, 最终降低了LDLR的表达,导致实验B组细胞的平均红色荧光值低于A组。因此,我们推测角鲨烯与胆固醇之间有竞争抑制作用,可能竞争作用于SCAP/SREBP通路。
FRET技术是指能量从一种受激发的荧光基团转移到另一种荧光基团的检测方法,目前广泛应用于研究细胞内的蛋白分子间的相互作用[14]。当细胞内有较高胆固醇浓度时,胆固醇结合于固醇敏感结构域,并使SCAP与Insig2结合形成紧密的复合体。此时,细胞用440 nm的激发光激发CFPSCAP融合蛋白上的CFP,CFP产生490 nm荧光能量,被邻近的YFPInsig2融合蛋白上的YFP吸收而产生527nm的黄色荧光。当细胞用固醇位点竞争结合药处理时,胆固醇失去作用,CFPSCAP与YFPInsig2分离,此时细胞用440 nm的激发光激发CFPSCAP融合蛋白上的CFP,CFP产生490 nm荧光[15]。利用这一机制并应用FRET技术可分析角鲨烯对细胞内SCAP蛋白与Insig2蛋白结合的影响,检测结果中YFP的荧光值,可以间接反映SCAP与Insig2的结合情况。建立CFPSCAP/YFPInsig2/HepG2细胞系用于胆固醇竞争结合位点靶点新药的研究。当细胞用角鲨烯处理后,YFP的荧光值降低,说明SCAP与Insig2的结合率降低,SCAP/SREBP固醇调控途径激活,SCAP与SREBPs形成复合物,并通过囊泡运输的方式进入到高尔基复合体。SREBPs在高尔基体中经过两步剪切后,释放出活性氨基末端“碱性螺旋-环-螺旋-亮氨酸拉链”(bHLH-ZIP)并进入核中,在细胞核内 bHLH-ZIP与靶基因上游的固醇调节元件结合,从而激活靶基因LDLR的转录,上调LDLR的表达。因此,我们推测角鲨烯可能是通过与胆固醇竞争结合,降低了SCAP与Insig2的结合率,激活了SCAP/SREBP途径。
综上所述,我们建立了一个新型的降胆固醇药选靶系统,通过流式细胞术和荧光倒置显微镜表明角鲨烯能够上调HepG2细胞LDLR表达活性,FRET实验从细胞水平初步证明角鲨烯与胆固醇在固醇敏感结构域靶点竞争结合,从而激活SCAP/SREBP途径,上调LDLR的表达。因而角鲨烯可能是一个具有潜在价值的降胆固醇新药。
[1] Poli G, Sottero B, Gargiulo S, et al. Cholesterol oxidation products in the vascular remodeling due to atherosclerosis[J].MolAspectsMed, 2009,30(3):180-9.
[2] 刘 燕, 张 军, 蒲强红,等. 瑞舒伐他汀减轻ApoE-/-小鼠动脉硬化形成与ST6Gal-Ⅰ表达相关性研究[J]. 中国药理学通报, 2016,32(4):525-30.
[2] Liu Y, Zhang J, Pu Q H, et al. Correlation of ST6Gal-Ⅰ expression and atherosclerotic plaque reduction induced by rosuvastatin in ApoE-/-mice[J].ChinPharmacolBull, 2016,32(4):525-30.
[3] Ridker P M, Mora S, Rose L. Percent reduction in LDL cholesterol following high-intensity statin therapy: potential implications for guidelines and for the prescription of emerging lipid-lowering agents[J].EurHeartJ, 2016,37(17):1373-9.
[4] 高 欣, 赵 琳, 朱 皓. 依折麦布联合阿托伐他汀对不稳定型心绞痛患者血清甘油三酯的影响[J]. 大连医科大学学报, 2016,38(4):361-4.
[4] Gao X,Zhao L,Zhu H. Lipid-lowering efficacy of atorvastatin and ezetimibe combination therapy for patients with unstable angina[J].JDalianMedUniv, 2016,38(4):361-4.
[5] Yoon D, Sheen S S, Lee S, et al. Statins and risk for new-onset diabetes mellitus: areal-world cohort study using a clinical research database[J].Medicine, 2016,95(46):e5429.
[6] 刘纯友, 马美湖, 靳国锋,等. 角鲨烯及其生物活性研究进展[J].中国食品学报,2015,15(5):147-56.
[6] Liu C Y, Ma M H, Jin G F, et al. Research process on squalene and bioactivities[J].JChinInstFoodSciTech, 2015,15(5):147-56.
[7] Hoang T M, Nguyen C H, Le T T, et al. Squalene isolated from Schizochytrium mangrovei is a peroxisome proliferator-activated receptor-α agonist that regulates lipid metabolism in HepG2 cells[J].BiotechnolLett, 2016,38(7):1065-71.
[8] Shin D H, Heo H J, Lee Y J, et al. Amaranth squalene reduces serum and liver lipid levels in rats fed a cholesterol diet[J].BrJBiomedSci, 2004,61(1):11-4.
[9] Smith T J. Squalene: potential chemopreventive agent[J].ExpertOpinInvestigDrugs, 2000,9(8):1841-8.
[10] 张 琴, 杨发建, 何 芸,等. 以Insig-2基因启动子为靶点的药物筛选模型的建立[J]. 中国药理学通报, 2014,30(1):140-3.
[10] Zhang Q,Yang F J,He Y,et al. Establishment of drug screening model targeting Insig-2 promoter[J].ChinPharmacolBull, 2014,30(1):140-3.
[11] Mcfarlane M R, Cantoria M J, Linden A G, et al. Scap is required for sterol synthesis and crypt growth in intestinal mucosa[J].JLipidRes, 2015,56(8):1560-71.
[12] Dong X Y, Tang S Q. Insulin-induced gene: a new regulator in lipid metabolism[J].Peptides, 2010,31(11):2145-50.
[13] 窦晓兵, 范春雷, 洪行球,等. 姜黄素对人淋巴细胞低密度脂蛋白受体表达影响的研究[J]. 中国药学杂志, 2005,40(13):980-3.
[13] Dou X B, Fan C L, Hong X Q, et al. Effect of curcumin on expression of LDL-R in human lymphocyte[J].ChinPharmJ, 2005,40(13):980-3.
[14] Komatsubara A T, Matsuda M, Aoki K. Quantitative analysis of recombination between YFP and CFP genes of FRET biosensors introduced by lentiviral or retroviral gene-transfer[J].SciRep, 2015,5(3):13283.
[15] 金艳燕, 邓 君, 金良韵,等. 荧光共振能量转移技术阳性参照质粒的构建及应用[J]. 山西医科大学学报, 2015,46(11):1074-8.
[15] Jin Y Y,Deng J,Jin L Y, et al. Construction of CFP-YFP positive plasmid and its application in fluorescence resonance energy transfer[J].JShanxiMedUniv, 2015,46(11):1074-8.
