高血压病血瘀证患者血清对内皮细胞功能及AMPK激活的影响
2018-07-03邓波江小梨刘彬张双伟陈利国张竞之
邓波, 江小梨, 刘彬, 张双伟, 陈利国, 张竞之
(1.广州医科大学附属第二医院中医科,广东广州510260;2.暨南大学中医学院,广东广州510632)
高血压病是一种以动脉血压升高为特征、临床上常见的心血管疾病.据资料显示,我国心血管疾病死亡率逐年升高,其死亡率居首位,占居民疾病死亡构成的40%以上,已经高于肿瘤和其他疾病[1].高血压病是冠状动脉粥样硬化性心脏病(冠心病)的主要危险因素之一,高血压患者发生冠心病是正常血压人群的3~4倍[2],因此预防和控制高血压有重要临床意义.血瘀证是高血压病在中医辩证分型中最常见的证型,通过观察血瘀证患者血清对血管内皮功能障碍的影响,可探讨高血压病血瘀证的机理过程,对防治高血压引起的冠心病有重要的临床意义.内皮功能障碍是冠心病发生的重要因素,其主要表现为内皮依赖性的舒张功能异常、血管内皮黏附功能异常和血管内皮炎症.本研究借鉴陈利国教授提出的血瘀证病证结合内皮细胞损伤模型[3],即采用高血压血瘀证患者血清处理内皮细胞,观察高血压病血瘀证患者血清损伤对内皮细胞功能的影响,探讨高血压病血瘀证的病理实质和形成机制.
1 材料与方法
1.1 主要试剂
EBM-2购自 Lonza公司(货号:CC-3156),胎牛血清(FBS)购自 BI公司(货号:04-001-1ACS);细胞裂解液(RIPA)购自碧云天公司(货号:P0013)、一氧化氮(nitric oxide,NO)检测试剂盒(货号:A013-2)、内皮素(endothelin-1,ET-1)检测试剂盒(货号:H093),髓过氧化物酶检测试盒(货号:A044)购于南京建成公司;兔抗p-eNOS抗体(货号:9572)、兔抗 eNOS抗体(货号:35362)、兔抗 p-腺苷酸活化蛋白激酶 α(adenosine monophosphate activated protein kinaseα,AMPKα)抗体(货号:2535)、兔抗 AMPKα抗体(货号:5831)、兔抗甘油醛-磷酸脱氢酶(glyceraldehyde phosphatedehydrogenase,GAPDH)抗体 (货号:2118)及兔-IgG二抗(货号:7074)购自美国 CST公司;兔抗 ICAM-1抗体(货号:AF6088)、兔抗VCAM-1抗体(货号:DF6082)购自美国 Affinity公司;Trizol(货号:15596018)、二喹啉甲酸(bicinchoninic acid,BCA)蛋白定量试剂盒(货号:23250)购自 Thermofisher公司;Prime Script RT逆转录试剂盒(货号:RR037A)、SYBR Green qPCR Master Mix荧光定量PCR试剂(货号:638320)购自Takara公司;引物由Invitrogene公司合成.
1.2 细胞来源与培养
原代人静脉内皮细胞(human umbilical vein endothelial cells,HUVECs)购于 Cell applications公司,采用Lonza的EBM-2内皮细胞培养基培养,在37℃体积分数为5%CO2的恒温培养箱中培养,每2~3天换液1次,待细胞长满至80%~90%左右单层时传代,取第4到6代用于实验.
1.3 病例来源
病例选择及血清制备相关标准按文献[4-5].
病例选取2016年3月至2017年6月广州医科大学附属第二医院住院确诊者.高血压病诊断符合世界卫生组织/国际高血压学会统一的“高血压病”诊断标准,血瘀证诊断参照文献[6]的诊疗共识.其中高血压病血瘀证组:40例,其中2级高血压32例,3级高血压8例;男21例,女19例;平均收缩压(164.25±12.17)mmHg,平均舒张压(102.73±7.58)mmHg(1 mmHg=0.133 kPa);平均年龄(64.22±7.83)岁.本课题选用的血瘀证主要证型为:阴虚血瘀证、气虚血瘀证、痰湿血瘀证,其余少量为气滞血瘀证和热结血瘀证,所选病例能较好的代表血瘀证的各种兼证的临床分布情况.高血压病非血瘀证组:40例.其中2级高血压31例,3级高血压9例;男25例,女15例;平均收缩压 (166.19±7.56)mmHg,平均舒张压(103.53±8.47)mmHg;平均年龄(64.60±9.46)岁.两组患者均为原发性高血压患者,排除糖尿病,排除心、脑、肾等靶器官损害及并发症,检查前1周未服用影响血压的药物.两组患者的血压分级、平均血压、平均年龄、性别分布、血脂异常无统计学差异(P>0.05),具有基线可比性.
1.4 血清采集
试剂患者组及对照组均空腹取血,置入无菌带帽不抗凝干燥试管,自凝后离心(4℃,2 000 r/min,15 min),取上清液置无菌EP管,冻存于-20℃,备用.
1.5 NO、ET-1含量检测
将HUVECs接种于24孔培养板中,每组设3个复孔,分别给予体积分数为10%高血压病血瘀证或非血瘀证患者血清处理24 h,收集细胞上清,依NO及ET-1检测试剂盒说明书步骤,检测NO及ET-1的含量.
1.6 Western blot检测
将HUVECs接种于6孔培养板中,每组设3个复孔,分别给予高血压病血瘀证或非血瘀证患者的血清(体积分数均为10%)处理24 h,磷酸盐缓冲液(phosphate buffer saline,PBS)漂洗后收集细胞,加入适量的RIPA裂解液裂解,BCA蛋白定量试剂盒定量,加入上样缓冲液,质量分数为10%SDS-PAGE电泳,100 V,90 min进行转膜,脱脂奶粉封闭1 h,加入一抗4℃孵育过夜,1×(TBST)液洗涤3次,每次7 min,加入二抗,37℃孵育 1 h,1×TBST液洗涤 3次,每次 7 min.(Electro-Chemi-Luminescence,ECL)化学发光试剂盒显色,胶片曝光.
1.7 单核细胞黏附率检测
HUVECs接种于48孔培养板中,分别给予高血压病血瘀证或非血瘀证患者血清处理24 h后,PBS洗涤3次,加入新鲜分离的单核细胞1.00×105个,37℃ 孵育30 min,无血清培养基轻柔洗涤2次,去除未结合的粒细胞.每组4个复孔.根据髓过氧化物酶(myeloperoxidase,MPO)活性变化对黏附于内皮细胞上的粒细胞进行定量分析.
粒细胞黏附率(%)=黏附单核细胞MPO活性/总单核细胞数(1.00×105个)MPO活性.
1.8 荧光定量PCR检测
采用Trizol法提取细胞的总RNA,按照Prime Script RT逆转录试剂盒说明书合成cDNA,按照SYBR Green qPCR Master Mix荧光定量PCR试剂盒说明书进行操作.分别以 cDNA为模板,以GAPDH为内参,使用定量PCR仪进行荧光定量PCR反应.采用primer premier 5.0,根据肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)(NM_000594.3)、白细胞介素-1β(interleukin-1,IL-1β)(NM_000576.2)和 GAPDH(NM_001289745.2)的序列设计引物.引物序列为:TNF-α上游:5′-CCA GGG ACC TCT CTC TAA TCA-3′,TNF-α下游:5′-TCA GCT TGA GGG TTTGCT AC-3′;IL-1β上游:5′-ATG GAC AAG CTG AGG AAG ATG-3′;IL-1β下游:5′-CCC ATG TGT CGA AGA AGA TAG G-3′;GAPDH 上游:5′-GGT GTG AAC CAT GAG AAG TAT GA-3′;GAPDH下游 5′-GAG TCC TTC CACGAT ACC AAA G-3′.反应条件为:95℃预变性30 s;95℃ 5 s、60℃ 15 s,72℃ 30 s,共40个循环,最后进行熔解曲线的检测.结果以Ct值显示,Ct值为每个反应管内的荧光信号到达设定的阈值时所经历的循环数.采用相对定量法来比较上述基因表达的差异.
1.9 统计方法
采用SPSS 19.0统计软件进行分析,实验数据采用(均数±标准差)(±s),多组比较采用单因素方差(One-Way ANOVA),当P<0.05时,为差异具有统计学意义.
2 结果
2.1 高血压病血瘀证患者血清对血管内皮依赖性舒缩功能的影响
将HUVECs分为两组,分别给予体积分数为10%高血压病非血瘀证患者血清(对照组,Control)与体积分数为10%高血压病血瘀证患者血清(血瘀证组,blood stasis syndrome,BSS),刺激24 h后检测NO、ET-1以及p-eNOS的表达,观察高血压病血瘀证患者血清对血管内皮依赖性舒缩功能的影响.结果显示,高血压病血瘀证患者血清能显著升高ET-1、降低NO的含量和p-eNOS的表达,与高血压病非血瘀证血清比较,有统计学差异(P<0.05).提示高血压病血瘀证患者血清能诱导血管内皮依赖性舒缩功能异常.
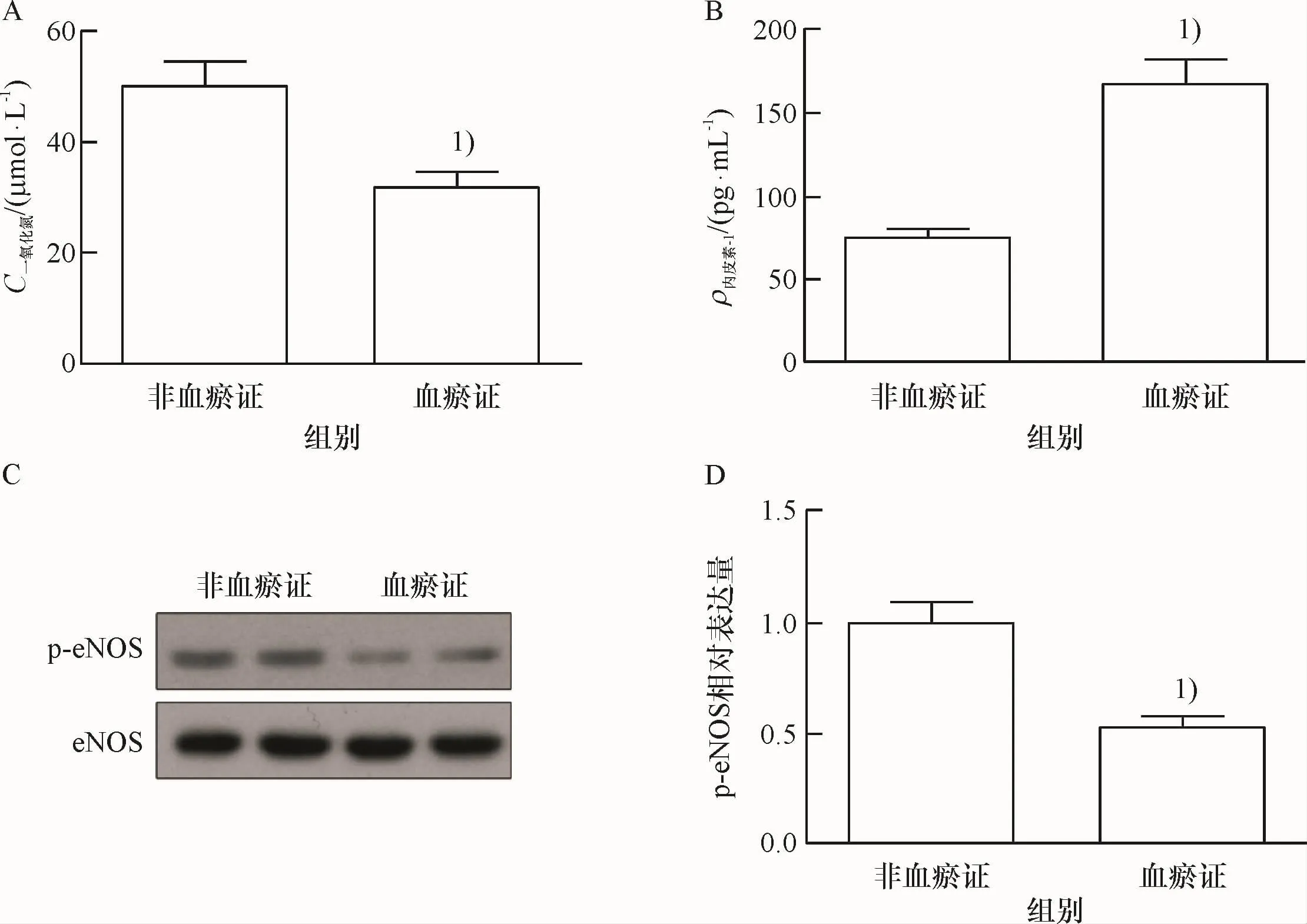
图1 高血压病血瘀证患者血清对血管内皮依赖性舒缩功能的影响Fig.1 The effects of the serum of on hypertensive patients with blood stasis syndrome on the endothelium dependent relaxation and contraction function
2.2 高血压病血瘀证患者血清对单核细胞黏附的影响
采用 Western blot法检测 ICAM-1、VCAM-1的表达量、单核细胞黏附实验检测单核细胞黏附率,观察高血压病血瘀证患者血清对单核细胞的影响.结果显示:高血压病血瘀证患者血清能显著升高黏附分子ICAM-1和VCAM-1的表达,与高血压病非血瘀证血清相比较,有统计学差异(P<0.05).进一步采用单核细胞黏附模型探索高血压病血瘀证患者血清对单核细胞黏附的影响,发现高血压病血瘀证患者血清能升高单核细胞黏附率,与高血压病非血瘀证血清比较,有统计学差异(P<0.05).提示高血压病血瘀证患者血清能诱导单核细胞黏附.

图2 高血压病血瘀证患者血清对单核细胞黏附的影响Fig.2 The effects of the serum of on hypertensive patients with blood stasis syndrome on themonocyte adhesion
2.3 高血压病血瘀证患者血清对内皮炎症反应的影响
采用qPCR法检测了炎症因子TNF-α、IL-1β的表达,以观察高血压病血瘀证患者血清对内皮细胞炎症的影响.结果显示,高血压病血瘀证患者血清能显著升高TNF-α和IL-1β的表达,与高血压病非血瘀证血清比较,有统计学差异(P<0.05).提示高血压病血瘀证患者血清能诱导内皮细胞炎症.

图3 高血压病血瘀证患者血清对内皮炎症反应的影响Fig.3 The effects of the serum of on hypertensive patients with blood stasis syndrome on the endothelial inflammation
2.4 高血压病血瘀证患者血清对内皮细胞AM PK活性的影响
为了探索AMPK在高血压病血瘀证诱导内皮功能障碍中的作用,本组进一步采用Westernblot法检测了高血压病血瘀证患者血清对AMPK激活的影响,发现高血压病血瘀证患者血清显著抑制磷酸化AMPKα的表达,与高血压病非血瘀证血清比较,有统计学差异(P<0.05).提示高血压病血瘀证可能与抑制AMPK有关.
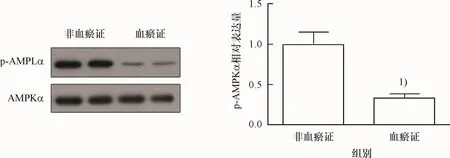
图4 高血压病血瘀证患者血清对内皮细胞AMPK活性的影响Fig.4 The effects of the serum of on hypertensive patients with blood stasis syndrome on the activation of AMPK
3 讨论
血瘀证是高血压病中医辨证分型中最常见的证型之一,是由多种病理因素所致的“血行失度”、“血脉瘀阻”的病理过程,形成机理复杂.“心主血脉”、“脉不通则血不流”、“脉道以通,血气乃行”等提示其机理的研究应更关注血管与血瘀证形成的关系,因此探讨“脉”以及“血”与“脉”的关系成为研究重点.血瘀证与血管内皮功能具有相关性[7],一方面血瘀证能加重血管内皮功能障碍,另一方面血管内皮功能障碍亦能造成脉道瘀血及“血瘀”的程度,两者相互促进,形成恶性循环.既往研究表明血瘀证者患冠心病的危险是非血瘀证者的8.959倍[8].本课题组前期研究发现,与高血压非血瘀证相比,高血压血瘀证血清对内皮细胞损伤程度更为严重[9-10].本研究从内皮依赖性的舒缩功能异常、血管内皮黏附功能异常和血管内皮炎症3个方面探索高血压病血瘀证血清对内皮功能的影响.研究结果表明,与高血压非血瘀证组比较,高血压病血瘀证患者血清能显著降低NO含量、eNOS的活性、升高ET-1的含量,这提示高血压病血瘀证患者血清能引起内皮依赖性的舒缩功能异常.本研究结果显示高血压血瘀证患者血清能够升高黏附因子ICAM-1、VCAM-1的表达量,明显提升单核细胞黏附率,提示高血压病血瘀证患者血清能诱导单核细胞黏附.另外,在内皮细胞炎症反应方面,高血压血瘀证患者血清能明显升高炎性因子TNF-α、IL-1β的表达水平,提示高血压血瘀证患者血清能加重内皮炎症反应;高血压病血瘀证患者血清能诱导血管内皮功能障碍.
腺苷酸活化蛋白激酶(adenosinemonophosphate activated protein kinaseα,AMPKα)是参与调节生物能量代谢关键分子,各种代谢相关的组织或细胞都有所表达[11].当机体受到细胞应激、运动和多种激素等刺激后,这将会使AMPK活化[12-13].AMPK具有调节eNOS活性以及NO生物合成,维持血管内皮的正常功能的作用.在内皮细胞中,活化的AMPK可以磷酸化和激活 eNOS(Ser1177)[14],这个位点被激活可以降低 eNOS对 Ca2+的敏感性[15],同时 eNOS促进血管内皮分泌 NO[16],继而舒张痉挛的血管,改善内皮功能,延缓心血管疾病进程.AMPK激动剂AICAR不仅能够抑制TNFα诱导的单核细胞与内皮细胞黏附,还可以抑制内皮细胞黏附分子ICAM-1、VCAM-1、E-选择素(E-selectin)的表达和分泌,而且上述效应可以被AMPK抑制剂 Compound C逆转或缓解[17-18].同时有研究表明AMPK活化可以抑制脂多糖(lipopolysaccharide,LPS)诱导的炎症反应[19].研究表明,临床上广泛用于治疗糖尿病[20]、降血压[21]等药物通过激活AMPK发挥心血管保护作用.本研究探索AMPK在高血压病血瘀证患者血清诱导血管内皮功能障碍中的作用,结果提示高血压病血瘀证患者血清显著抑制AMPKα的活性.由此,推测高血压血瘀证患者血清有可能是通过抑制AMPKα的活性,从而抑制内皮功能障碍.
本研究明确了高血压病血瘀证患者血清能诱导内皮功能障碍,同时,高血压病血瘀证患者血清显著抑制内皮细胞AMPK活性,其诱导内皮功能障碍作用可能与抑制AMPK有关.AMPK在心血管疾病防治中是一个重要的潜在靶点,而活血化瘀类中草药具有心血管保护的作用或许与激活AMPK相关.
[1]陈伟伟,刘力生,高润霖,等.《中国心血管病报告2016》概要[J].中国循环杂志.2017,32(6):521-530.CHENW W,LIU L S,GAO R L,et al.Summary of《China cardiovascular disease report2016》[J].Chinese Circulation Journal.2017,32(6):521-530.
[2]SHRESTH P L, SHRESTHA P A, VIVO R P.Epidemiology of comorbidities in patients with hypertension[J].Curr Opin Cardiol,2016,31(4):376-380.
[3]陈利国,胡小勤.论病证结合血瘀证血管内皮细胞损伤模型的建立[J].中国中西医结合杂志,2007,27(3):267-269.CHEN L G,HU X Q.Discussion on establishment of vascular endothelial cell injury model of blood stasis syndrome based on integration of disease identification and syndrome differentiation[J].Chinese Journal of Integrated Traditional and Western Medicine,2007,27(3):267-269.
[4]张竞之,陈利国,贾会欣,等.黄芪多糖对高血压病血瘀证患者血清损伤的人脐静脉内皮细胞形态学、活性的影响[J].中国实验方剂学杂志.2010,16(16):170-173.ZHANG J Z,CHEN L G,JIA H X,et al.Effects of astragalus polysaccharide on activity and morphological changes in HUVEC induced by serum from patients with blood stasis syndrome and hypertension[J].Chinese Journal of Experimental Traditional Medical Formulae,2010,16(16):170-173.
[5]张竞之,陈利国,胡小勤,等.黄芪多糖对原发性高血压病血瘀证患Toll样受体4、核转录因子-κB表达的影响[J].中医杂志,2011,52(15):1286-1289.ZHANG JZ,CHEN L G,HU X Q,et al.Influence of astragalus polysaccharide on the expression of toll-like receptor 4 and nuclear transcription factor-KB in essential hypertension patients with blood stasis[J].Journal of Traditional Chinese Medicine,2011,52(15):1286-1289.
[6]杜金行,史载祥.血瘀证中西医结合诊疗共识[J].中国中西医结合杂志,2011,31(6):839-844.DU JX,SHIZ X.Diagnosis and Treatment Guidance for Blood Stasis Syndrome by Integrative Medicine[J].Chinese Journal of Integrated Traditional and Western Medicine,2011,31(6):839-844.
[7]江泳,徐蓉娟,李红,等.血瘀证与血管内皮功能障碍的关系[J].辽宁中医药大学学报,2013,15(6):57-59.JIANG Y,XU R J,LI H,et al.The relationship between blood stasis syndrome and vascular endothelial dysfunction[J]. Journal of Liaoning University of Traditional Chinese Medicine,2013,15(6):57-59.
[8]林谦,王晓才,农一兵,等.冠心病中医证候与冠脉病变程度的相关性研究[J].北京中医药大学学报,2007,30(12):843-845.LIN Q,WANG X C,NONG Y B,et al.Correlation between TCM syndromes of CHD and pathological degree of coronary artery[J].Journal of Beijing University of Traditional Chinese Medicine,2007,30(12):843-845.
[9]彭志允,陈利国,贾会欣,等.丹参酮Ⅱ A对高血压病患者血清损伤后的内皮细胞的影响[J].中成药,2012,34(2):199-203.PENG Z Y,CHEN L G,JIA H X,et al.Effect of tanshinoneⅡA on endothelial cell injured by serum of patients with hypertension[J].Chinese Traditional Patent Medicine,2012,34(2):199-203.
[10]张竞之,陈小忆,金伟孝,等.丹皮酚对高血压病血瘀证患者血清损伤的HUVEC-C形态学、活性的影响[J].辽宁中医药大学学报,2012,14(6):29-31.ZHANG JZ,CHEN X Y,JINW X,et al.Effects of pea on activity and changes of HUVEC-C in patients with blood stasis syndrome of hypertension[J].Journal of Liaoning University of Tcm,2012,14(6):29-31.
[11]HARDIE D G,ROSS F A,HAWLEY S A.AMPK:a nutrient and energy sensor that maintains energy homeostasis[J].Nat Rev Mol Cell Bio,2012(13):251-262.
[12]DAY E A,FORD R J,STEINBERG G R.AMPK as a therapeutic target for treating metabolic diseases[J].Trens Endocrinol Metab,2017,8(28):1-16.
[13]HARDIE D G,SCHAFFER B E,BRUNET A.AMPK:An energy-sensing pathway with multiple inputs and outputs[J].Trends Cell Biol,2017,3(26):1-12.
[14]YOUN J,WANG T,CAIH.An Ezrin/Calpain/PI3K/AMPK/eNOSs1179 signaling cascade mediating VEGF-dependent endothelial nitric oxide production[J].Circ.Res,2009,104(1):50-59.
[15]MONTAGNANI M,CHEN H,BARR V A,et al.Insulin-stimulated activation of eNOS is independent of Ca2+but requires phosphorylation by Akt at Ser1179[J].JBiol Chem,2001,276(32):30392-30398.
[16]De CATERINA R,LIBBY P,PENG H B,et al.Nitric oxide decreases cytokine-induced endothelial activation.Nitric oxide selectively reduces endothelial expression of adhesion molecules and proinflammatory cytokines[J].J Clin Invest,1995,96(1):60-68.
[17]ZHANG Y,QIU J,WANG X,et al.AMP-activated protein kinase suppresses endothelial cell inflammation through phosphorylation of transcriptional coactivator p300[J].Arterioscler Thromb Vasc Biol,2011,31(12):2897-2907.
[18]JUNG C H,LEE M J,KANG Y M,et al.Vaspin inhibits cytokine-induced nuclear factor-kappa B activation and adhesion molecule expression via AMP-activated protein kinase activation in vascular endothelial cells[J].Cardiovasc Diabetol,2014,41(13):1-12.
[19]LI P,LI X,WU Y,et al.A novel AMPK activator hernandezine inhibits LPS-induced TNFαproduction[J].oncotarget,2017,8(40):67218-67226.
[20]NESTIL,NATALIA.Metformin effects on the heart and the cardiovascular system:A review of experimental and clinical data[J].Nutr Metab Cardiovasc Dis,2017,27(8):657-669.
[21]SUNG J Y,CHOI H C.Nifedipine inhibits vascular smooth muscle cell proliferation and reactive oxygen species production through AMP-activated protein kinase signaling pathway[J].Vascul Pharmacol,2012,56(1-2):1-8.
