子宫腺肌病EM I处MMP-7和E-Cadherin的表达及意义
2018-07-03廖瑜陈宇毅张哲珺徐建平
廖瑜, 陈宇毅, 张哲珺, 徐建平
(暨南大学 附属第一医院1.病理科;2.妇产科,广东广州510630)
子宫腺肌病(adenomyosis,ADS)是在子宫肌层中出现岛屿状异位的子宫内膜腺体及间质并伴有周围肌层细胞的肥大与增生,常导致进行性痛经、慢性盆腔疼痛以及不孕、月经过多等临床表现,至今仍没有很好的确诊检测方法,经阴道超声是术前最主要的检查手段[1].研究显示,子宫内膜—肌层连接处(the junctional zone,JZ)作为子宫内膜与肌层之间的屏障,其结构异常或分子学改变所致的子宫肌层收缩功能障碍与ADS的发生发展密切相关[2-3],而雌激素在调控其收缩的频率、强度和方向中发挥重要作用[4],表明子宫腺肌病与内异症相同,也属于性激素依赖性疾病.但更多的研究却发现它们常常各自独立发生.组织学方面,在多数病例中,腺肌病是由子宫内膜的非功能层(基底)组成,与子宫内膜-肌层界面(endometrial-myometrial inferface,EMI)处的关系异常密切,而子宫内膜异位症是由子宫内膜功能层组成的,故两者发病机制存在差异.子宫内膜向肌层深处侵袭和生长与恶性肿瘤细胞的行为类似,故本实验选取具有降解细胞外基质的基质金属蛋白酶和细胞黏附能力紧密相关的钙黏蛋白,研究子宫腺肌病病灶和内膜-肌层交界处MMP-7及E-cadherin的表达情况,探讨子宫腺肌病发病的可能原因及机制.
1 资料与方法
1.1 实验对象
选取2010年3月至2011年10月在暨南大学附属第一医院妇科因子宫腺肌病行全子宫切除或次全子宫切除的子宫标本共40例作为研究组.入选患者年龄为43~53岁,平均年龄(44.33±6.30)岁.选取同期因子宫良性病变(子宫肌瘤)行全子宫切除或次全子宫切除的子宫标本30例作为对照组.入选患者年龄为45~59岁,平均年龄为(48.10±6.05)岁.各组年龄经 Levene法方差齐性检验,无统计学差异,具有可比性(P=0.76).
全部研究对象的临床及病理资料完整,均无内分泌、免疫及代谢性疾病,术前6个月内未均使用过甾体类激素及免疫药物治疗,无高血压、糖尿病、肾病等慢性内科病史.
1.2 方法
1.2.1 样品制备
取子宫切除的标本,沿子宫前壁纵形切开子宫肌层至子宫体腔内,各切取子宫肌层内膜异位病灶及在位子宫内膜界面处1.5×1.5 cm2大小(标本包括子宫肌层与在位子宫内膜).对照组在子宫切除后以同样方法在距离子宫肌瘤2 cm以外的部位切取正常子宫肌层内膜界面处1.0×1.0 cm2大小(包括正常子宫肌层及正常子宫内膜).每例标本获取后随即放入体积分数为10%的甲醛溶液中固定,固定后的研究标本切为0.5×0.5×0.5 cm3的组织块,放入酒精 -甲醛液(体积分数为10%甲醛+体积分数为95%乙醇)中固定,再放入体积分数为95%的酒精中过夜,之后浸蜡包埋制成石蜡块备用,每份标本制备4μm厚的切片10张,60℃烘烤备用.
1.2.2 免疫组化染色
采用购自中杉金桥公司的鼠抗人MMP-7单克隆抗体及鼠抗人E-cadherin单克隆抗体,采用链霉菌抗生物素蛋白-过氧化物酶连接(SP)法,在同一时间、同一条件下进行检测.
1.2.3 结果判定
MMP-7的阳性表达呈棕黄色颗粒,定位于细胞浆,染色程度从浅黄色到深黄色不等,在肌细胞中几乎无表达;E-cadherin为细胞膜或细胞浆表达,呈现棕黄色颗粒,主要表达在腺体上皮细胞的胞膜上,在肌细胞中无表达.
1.2.4 图像分析
本研究应用Leica QW550图像分析系统,采用阳性单位(positive unit,PU)的概念来定量表达免疫组化阳性反应的程度[5].阳性单位(PU)的计算公式:PU=[(Gα-Gβ)/Gmax]×100,Gα、Gβ分别为待测区域和背景的平均灰度,Gmax等于256,为检测仪的最大灰度.每张切片随机选取16个视野作为测试点,测试两组病灶和内膜-肌层交界处腺上皮胞浆和胞膜的PU值.每个腺腔分别在其横轴、纵轴、对角轴交点处选取阳性测定位置的灰度值(记为Gα),在其临近空白部位作为背景取灰度值(记为Gβ),利用上述公式计算出MMP-7在研究组及对照组的PU值,以及E-cadherin在研究组及对照组的PU值.
1.3 统计学方法
采用IBM SPSSStatistics 23.0进行统计学分析,分别采用配对资料的t检验、方差分析、χ2检验,计量资料以(±s)表示,P<0.05有统计学差异.
2 结果
2.1 MMP-7免疫组化结果
MMP-7阳性表达于细胞浆,呈棕黄色颗粒,在子宫腺肌病病灶组织和界面大部分异位内膜腺上皮细胞胞浆中表达,在肌细胞中几乎无表达,在EMI界面一侧的在位内膜腺上皮细胞胞浆中表达MMP-7,其增生期和分泌期的PU值无统计学差别(P=0.402),腺肌病组病灶较在位内膜的表达增生期及分泌期均升高,有统计学差别(P=0.000,P=0.003).对照组的子宫内膜中,MMP-7表达在界面少部分内膜腺上皮细胞胞浆中,界面一侧的子宫肌层内未见有明显的MMP-7的表达,分泌期的表达较增生期升高,PU值有统计学差异(P=0.000).对照组增生期子宫内膜至子宫腺肌病组中的病灶(图1、图2、表1),MMP-7表达在上升,子宫腺肌病组PU值较高,其中以子宫腺肌病组病灶处的表达最高.
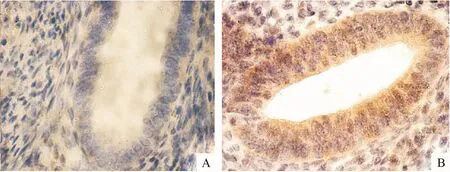
图2 MMP-7在子宫内膜-肌层交界处的表达(×200)Fig.2 MMP-7 expression in the EMIof uterine(×200)

表1 MMP-7在对照组及子宫腺肌病组的表达比较Table 1 The expression of MM P-7 in uterine adenomyosis and uterinemyoma
2.2 E-cadherin免疫组化结果
E-cadherin表达在内膜腺上皮细胞胞膜,胞浆及间质少许着色,而在肌细胞中不表达.在此次试验中,对照组界面的内膜E-cadherin表达比子宫腺肌病组高,PU值有统计学差别(P=0.000).在对照组中分泌期较增生期E-cadherin表达高,有统计学差别(P=0.000),在子宫腺肌病组中界面一侧在位内膜增生期、分泌期及病灶的E-cadherin表达无统计学差别(P=0.832,图3、图4,表2).
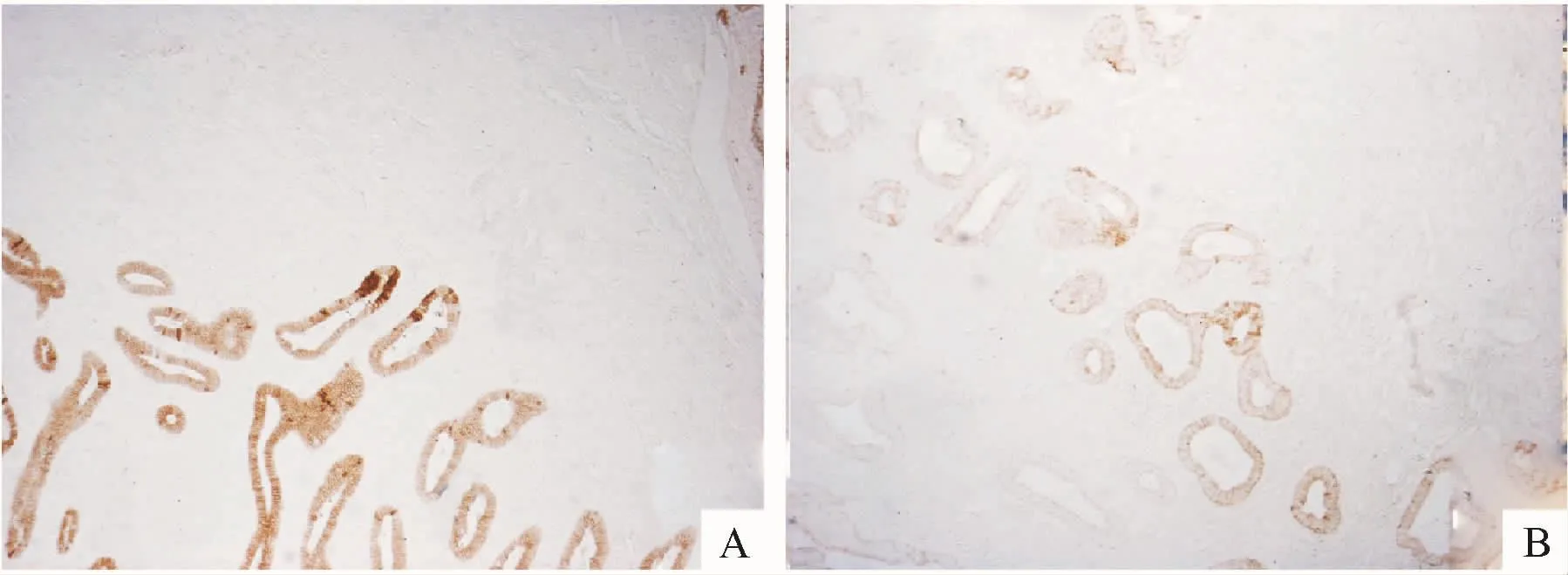
图3 E-cadherin在子宫内膜-肌层交界处的表达(×40)Fig.3 E-cadherin expression in the EMI of the uterine(×40)

图4 E-cadherin在子宫内膜-肌层交界处的表达(×200)Fig.4 E-cadherin expression in the EMI of the uterine(×200)
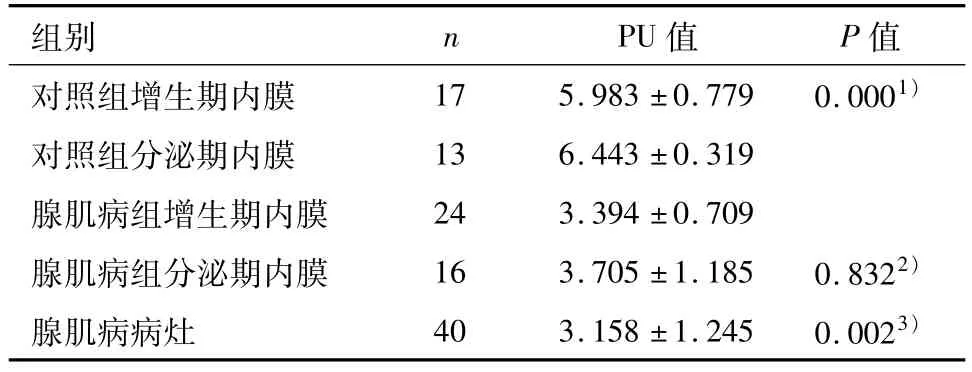
表2 E-cadherin在对照组及子宫腺肌病组的表达情况Table 2 The expression of E-cadherin in uterine adenomyosis and uterinemyoma
3 讨论
ADS是指子宫内膜细胞向子宫肌层良性浸润并弥漫性生长,产生相应的临床症状.子宫内膜与肌层的交界面在腺肌病的发生中起着重要的作用.子宫内膜与肌层的交界面与身体其他部位的黏膜肌层交界面不同,缺乏黏膜下层,内膜直接位于肌层表面.由于缺乏黏膜下层的保护作用,使子宫内膜细胞较易侵入子宫肌层.EMI的结构及功能损伤与子宫腺肌病的发生相关.动物实验研究发现,子宫腺肌病形成的最初改变是EMI肌层纤维卷曲,细胞体积缩小为原来的1/3,细胞间隙膨胀[6-7].在这病理改变的基础上,增加雌激素水平使子宫内膜腺体与间质细胞增生活跃,子宫内膜细胞出现反向生长,通过EMI侵入子宫肌层,继而发生子宫腺肌病.子宫内膜细胞侵入子宫肌层后必须经过黏附、侵袭、种植及新生血管形成等过程,每一个过程必须有多种细胞因子的参与方能完成.子宫内膜细胞侵入异位部位,在各种细胞因子的作用下发生种植、黏附、侵袭.
基质金属蛋白酶(MMPs)是一组调控细胞外基质降解和重建的蛋白水解酶,基质蛋白酶-7(MMP-7)属基质溶解素家族的重要一员,MMP-7主要降解蛋白聚糖、纤维连接蛋白、层粘连蛋白、弹性蛋白以及胶原IV等[8],并通过水解细胞外基质,以及提高细胞运动能力,参与多种恶性肿瘤的浸润转移过程[9].MMP-7既能有效降解基底膜成分,又对血管壁和淋巴管壁的主要成分弹性蛋白具有较强的分解特性.高表达MMP-7的肿瘤细胞更易突破血管壁及淋巴管壁,促使肿瘤细胞转移的发生,Acar等[10]通过ELISA法检测显示,MMP-7的确可以作为卵巢癌恶性程度的一个重要的血清学标志物.Sillanpaa等[11]通过检测284例原发性卵巢癌的肿瘤组织及随访这些患者的预后表明,MMP-7在肿瘤细胞中的高表达是卵巢癌的一个独立预后预测因子.
本研究结果显示,从对照组增生期内膜至子宫腺肌病组病灶,MMP-7表达在逐渐上升,子宫腺肌病组PU值较高,其中以子宫腺肌病组病灶处的表达最高,其次为EMI处子宫内膜腺体,说明腺肌病异位的内膜主要来自于基底层内膜,与以经血逆流为主要机制的功能层子宫内膜异位症不同.正常情况下,由于子宫内膜缺乏黏膜下层,因此阻挡子宫内膜细胞向肌层侵入的屏障作用较弱.而子宫肌层由含有细胞外基质成分的平滑肌束组成,是阻止子宫内膜细胞向深层次肌层侵入的主要屏障[12].MMP-7的表达增高,使子宫肌层的细胞外基质降解,屏障作用减弱,子宫内膜细胞则容易侵入子宫肌层生长并形成异位病灶,并且在分泌期表达升高,提示内膜细胞侵蚀力在分泌期升高,更容易在月经期因经血逆流种植至盆腔形成子宫内膜异位病灶.在子宫腺肌病组中MMP-7表达较同周期的对照组的表达高,但增生期与分泌期表达无差异,并未观察到分泌期升高的现象,可能是因为在子宫腺肌病组中的内膜细胞MMP-7表达升高并失去了周期性调控,导致侵袭能力升高并长期持续于高水平,子宫内膜细胞更容易侵入子宫肌层形成子宫腺肌病.
钙黏附蛋白(E-cadherin)属黏附分子家族,在细胞与细胞黏附中,E-cadherin以同种分子间“拉链”式结合的形式介导细胞黏附,主要分布在细胞周边尤其是细胞与细胞的连接处,在钙离子的存在下,同型分子作为配体或受体,自我相互结合,在临近细胞间建立分子连接,从而维持上皮组织正常的形态以及细胞的极性.E-cadherin的主要生理学功能是介导细胞间的黏附,其黏附作用具有亲同源性,即表达同源性钙黏附素的细胞将发生黏附.在病理情况下,E-cadherin活性的减弱,可导致子宫内膜上皮细胞黏附能力下降[13],从而使细胞侵蚀力增强,导致发病.在大多数恶性肿瘤中,如结肠癌、乳腺癌、肝癌、胃癌、前列腺癌、食管癌、皮肤癌、肾癌都存在E-cadherin介导的细胞黏附功能的削弱或丧失[14].
子宫腺肌病其根本的病理表现是子宫内膜组织侵袭到子宫肌层中,一方面子宫内膜细胞必须解除黏附从原发灶脱离,另一方面,又需要黏附到异位部位才能形成转移灶,在此过程中,由E-cadherin介导的细胞黏附系统对于维持细胞间的黏附很重要,E-cadherin的表达下降或者受到其他因素损害E-cadherin的黏附功能时,子宫内膜细胞就易于脱离原发灶,开始向周围组织侵入,并为“转移”提供了必要的条件.
本研究结果显示,在子宫腺肌病内膜中E-cadherin呈现阳性表达,其中增生期、分泌期内膜及病灶部位均有表达,3者之间无明显的差异.在对照组中观察到内膜的E-cadherin在分泌期升高,可能为保护因素,降低内膜细胞脱离内膜层的机会,其同样存在周期性,在子宫腺肌病组中周期性消失并且表达持续降低,推测E-cadherin表达的下调,直接导致细胞黏附能力下降,从而使细胞解聚,使子宫内膜细胞之间以及子宫内膜细胞与基质之间的黏附作用降低,从而变得易从在位部位解离.子宫内膜细胞更容易侵入,从而种植在肌层中,有利于内异症患者子宫内膜上皮细胞的移动、侵袭和种植.
子宫腺肌病的发病是一个多因素、多环节的过程,在子宫腺肌病发生、发展的各个阶段,可能有多个功能不同的细胞因子各自发挥不同的作用,在时间和空间上相互配合,协同促进了子宫内膜细胞的“转移”,而“转移”在EMI的变化尤为关键.由于MMP-7表达的增高,使子宫肌层细胞外基质降解,屏障作用减弱,同时E-cadherin表达下降,使间质细胞表型激活,促进上皮-间质转化(epithelial-mesenchymal transition,EMT)过程,子宫内膜细胞更容易脱落继而侵入肌层及生长,在伴有新生血管形成的同时逐渐形成内膜异位病灶.有研究表明,在体外培养的肿瘤细胞中加入MMP-7后,培养基中出现一种80 ku的E-cadherin可溶性片段(sE-cadherin),并且肿瘤细胞的浸润能力明显加强,说明MMP-7可使E-cadherin降解并促进肿瘤细胞的浸润[15].在用博来霉素治疗后的野生型小鼠支气管肺泡灌洗液中,脱落的E-cadherin可以被检测到,同等条件下的MMP-7基因敲除小鼠的肺中E-cadherin却不能被检测到[16].因此MMP-7不仅能降解细胞外基质,还能通过降解E-cadherin的途径来减少细胞-细胞间的黏附作用,降低细胞接触抑制的功能,从而加大细胞的扩散,在子宫腺肌病中子宫肌层局部MMP-7表达的逐渐升高并降解E-cadherin,使其作用减弱,导致异位的内膜细胞较容易脱落并向子宫肌层深部侵袭,使病情进一步加重,而在临床上则表现出子宫的不断增大,痛经进行性加重.
综上,子宫腺肌病组中的在位内膜、病灶的MMP-7的阳性表达上调及E-cadherin的阳性表达下调,提示子宫腺肌病的发生发展与MMP-7和E-cadherin的改变相关,并且两者有协同作用,在今后的治疗方面可能可以通过分子调控这两个因子来治疗子宫腺肌病的发病和发展.
[1]AHMADI F,HAGHIGHIH.Three-dimensional ultrasound manifestations of adenomyosis[J].Iranian Journal of Reproductive Medicine,2013,11(10):847-848.
[2]BENAGIANO G,BROSENS I,HABIBA M.Structural and molecular features of the endomyometrium in endometriosis and adenomyosis[J].Human Reproduction Update,2014,20(3):386-402.
[3]LEYENDECKER G, WILDT L, MALL G. The pathophysiology of endometriosis and adenomyosis:tissue injury and repair[J].Archives of Gynecology and Obstetrics,2009,280(4):529-538.
[4]王丽平,汪沙,张颖,等.雌二醇对子宫腺肌病患者子宫内膜-肌层交界区平滑肌细胞游离Ca2+调节模式的初步研究[J].中华妇产科杂志,2012,47(5):351-354.WANG L P,WANG S,ZHANG Y,et al.Preliminary study of estrogen effect on calcium free smooth muscle cells at the endometrial——myometrial inferface in uteri with adenomyosis[J].Chin J Obstet Gynecol,2012,47(5):351-354.
[5]SHEN H.Immunohistochemical positive unit quantitative theory,method and parsing of application[J].The proceedings of the 9th national conference on pathological,2007,(4):95-96.
[6]KAWAHARA R,MATSUDA M,MORIT.Increase in the number of integrinbeta1-immunoreactive monocyte-lineage cells in experimentally-induced adenomyosis in mice[J].Life Sci,2003,73(7):907-916.
[7]SCHAUSER K H,NIELSEN A H,WINTHER H,et al.Dominance of type 1 angiotensin II receptor in the nonpregnant and pregnant bovine uterus[J].Reprod Fertil,1999,116(2):403-413.
[8]HENRIET P,CORNET P B,LEMOINE P,et al.Circulating ovarian steroids and endometrial matrix metalloproteinases(MMPs)[J].Ann NYA Cad Sci,2002,955(1):119-138.
[9]VARRO A,KENNY S,HEMERS E,et al.Increased gastric expression of MMP-7 in hypergastrinemia and significance for epithelial-mesenchymal signaling[J].Am J Phisiol Gastro In Test Liver Physio,2007,292(4):1133-1140.
[10]ACAR A,ONAN A,COSKUN U,et al. Clinical significance of serum MMP-2 and MMP-7 in patients with ovarian cancer[J].Med Oncol,2008,25(3):279-283.
[11]SILLANPAA SM,ANTTILA M A,VOUTILAINEN K A,et al.Prognostic significance of matrixmet all oproteinase-7 in epithelial ovarian cancer and its relation to beta-catenin expression[J].Int J Cancer,2006,119(8):1792-1799.
[12]BISCHOF P,CAMPANA A.Trophoblast differentiation and invasion:its significance for human embryo implantation[J].Early Pregnancy,1997,3(2):81-95.
[13]LU M H,FAN M F,YU X D.NSD2 promotes osteosarcoma cell proliferation and metastasis by inhibiting E-cadherin expression[J].Eur Rev Med Pharmacol Sci,2017,21(5):928-936.
[14]NAORA H,MONTELL D J.Ovarian cancer metastasis:integrating insights from disparate model organisms[J].Nat Rev Cancer,2005,5(5):355-366.
[15]NOE V,FINGLETON B,JACOBSK,et al.Release of an invasion promoter E-cadherin fragment by matrilysin and stromelysin-1[J].JCell Sci,2001,114(1):111-118.
[16]LYNCH C C,MCDONNELL S.The role of matrilysin(MMP-7)in leukaemia cell invasion[J].Clin Exp Metastasis,2000,18(5):401-406.
