血清褪黑素检测在早产儿脑损伤中的临床意义
2018-07-02严彩霞张丙宏
严彩霞,张丙宏
(武汉大学人民医院 新生儿科,湖北 武汉 430060)
早产儿脑损伤是影响新生儿神经功能发育的主要原因之一。新生儿脑损伤生物标记物可能使临床医生能够对早产儿进行脑损伤筛查,监测疾病的进展情况,并评估神经保护策略在临床试验中的有效性。近年来研究发现血清褪黑素(melatonin)与神经系统疾病及严重性相关,脑损伤后,受损脑细胞中产生的褪黑素可能进入血液循环[1-2],但在早产儿脑损伤的报道甚少。本研究通过检测血清褪黑素水平,探讨其在早产儿脑损伤中的早期诊断价值,为早产儿脑损伤的早期干预及预后提供有利的生物学依据。
1 资料与方法
1.1 资 料
收集2016年1月至2017年7月NICU住院的胎龄在 27~34周,体重在1~2 kg,适于胎龄早产儿64例为研究对像。男性 37 例,女性27 例,平均出生体重 (15586±238)g,平均胎龄 (2.03±2.04)周。根据早产儿脑损伤诊断标准[3],34例早产儿无脑损伤(对照组),24例轻度脑损伤(轻度脑损伤组),6例重度脑损伤(重度脑损伤组)。三组一般情况比较见表1。

表1 对照组与脑损伤组一般情况比较Tab 1 Comparison of general information between control group and brain injury group (x±s)
1)与对照组比较,P<0.05;2)与轻度脑损伤组比较,P<0.05
排除遗传代谢性紊乱所致脑损害、严重先天性畸形、胆红素脑病、低血糖脑病、中枢神经系统感染等特定中枢神经系统疾病;单纯脑室稍扩大的早产儿。所有被检测对象均遵循知情同意且符合医学伦理要求。
1.2 褪黑素检测
所有入选的早产儿均在生后30 min内转入NICU,分别于生后第4天同时留静脉血3 mL,以3000 r/min速度离心10 min,取血清于-80 ℃低温保存待测,采用褪黑素ELISA试剂盒进行检测。试剂盒由武汉华美生物有限公司提供。
1.3 早产儿脑损伤诊断标准[3-4]
所有早产儿生后3天内行首次头颅超声检查,后隔周复查1次,直至出院。对头颅超声未见异常,但疑有颅内病变者依据患儿病情,生后1周至1个月行头颅MRI进一步确诊是否存在脑损伤。早产儿脑损伤可分为:(1)颅内出血(IVH);(2)脑室周围白质软化(PVL);(3)其他如脑梗死等。头颅超声疑似脑梗死者均行头颅MRI检查确诊。有上述改变之一者均纳入脑损伤组。其中Ⅰ~Ⅱ级 IVH和PVL为轻度脑损伤组,Ⅲ~Ⅳ级IVH和PVL为重度脑损伤组。
1.4 NBNA检测
所有早产儿均在矫正胎龄40周时行NBNA检测[5]。NBNA评分内容主要包括5个大项目:行为能力、被动肌张力、主动肌张力、原始反射、一般评估。其包含20个小项目,每项2分,共40分。
1.5 统计学方法
采用SPSS21.0统计学软件进行分析,所有计量资料结果采用x±s表示,患儿三组组内比较采用ANOVA方差分析,两组之间均数的比较采用两组独立样本的LSD-t检验;应用受试者工作特征(ROC) 曲线分析褪黑素对诊断早产儿脑损伤的敏感度、特异性。相关性分析采用pearson相关分析。P<0.05为差异有统计学意义。
2 结 果
2.1 三组血清褪黑素水平变化及NBNA评分比较
轻度脑损伤组和重度脑损伤组血清褪黑素水平及NBNA评分与对照组组间比较差异均有统计学意义(P<0.05)。见表2。

表2 三组血清褪黑素水平比较
1)与对照组比较,P<0.05;2)与轻度脑损伤组比较,P<0.05
2.2 三组血清褪黑素水平与NBNA评分的相关性分析
褪黑素与NBNA评分呈负相关(r=-0.518,P<0.05)。见图1。
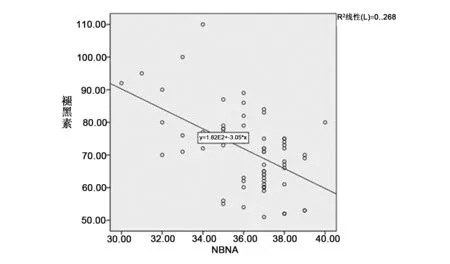
图1 褪黑素与NBNA评分的相关分析散点图Fig 1 Correlation analysis scatter diagram of melatonin and NBNA scores
2.3 褪黑素水平对早产儿脑损伤的诊断价值
应用ROC曲线分析发现,褪黑素水平诊断早产儿脑损伤的曲线下面积(AUC)为0.76;95%可信区间为(0.635,0.886);截断值为69.5 pg/mL,敏感度为86.7%,特异度为68.4%(P<0.05)。见图2。
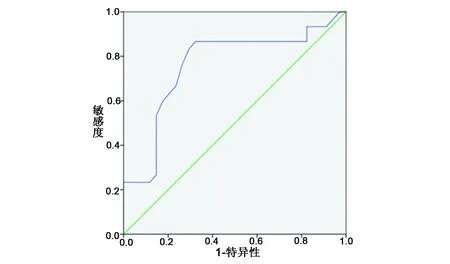
图2 褪黑素水平ROC曲线Fig 2 ROC curve of the melatonin level
3 讨 论
早产儿脑损伤,如脑室内出血(IVH),还包括对婴儿后期脑发育的复杂干扰。在早产儿中,最常见的脑损伤源是颅内出血(IVH)和脑室周围白质软化(PVL)。此外,出生体重不足1500 g的婴儿将有20%~25%出现IVH。此外,近60%的低出生体重新生儿将会出现低氧缺血性损伤。因此,在早产儿中,终生的神经发育障碍是经常发生的。预防或减少早产儿脑损伤需要发现能够鉴别婴儿受伤风险的生物标记物,监测损伤的进展情况,并评估神经保护临床试验的有效性[6]。
研究表明松果体可以直接释放褪黑激素进入第三脑室,再通过主动运输到达其他脑结构扩散到室管膜细胞和血管周围的空间[7]。脑脊液中高水平的褪黑素可以为大脑组织提供抗氧化和抗炎的保护。受伤的大脑很容易受到氧化损伤的影响,原因以下:脂质过氧化反应的丰富来源;活性自由基的产生;血脑屏障的通透性增加;血管性水肿和性微血管损伤。以往研究表明,在早产儿脑损伤中,过多的氧自由基通过级联炎症反应,主要包括大脑炎症反应与释放促炎细胞因子引起的细胞凋亡和线粒体功能障碍,最终导致细胞死亡[8-12]。
研究表明,在成人头部受伤患者的脑脊液和严重创伤性脑损伤患儿的血清中,均出现内源性褪黑素大量产生,表明褪黑激素具有抗氧化作用和神经保护作用[7,13]。在脑损伤模型的研究中表明褪黑素可以通过稳定内皮的渗透性,减少神经元的死亡[1-2,14-15]。最近还证实了褪黑素可经通过激活线粒体自噬细胞来去除受损的线粒体,从而抑制脑损伤诱发的炎症[16]。本研究的结果表明,早产儿脑损伤的程度越重, 褪黑素水平越高,与以往的研究是一致的,表明在早产儿脑损中过多的氧自由基通过级联炎症反应,引起的细胞凋亡和线粒体功能障碍,最终导致细胞死亡,褪黑素具有抗氧化作用和激活线粒体自噬细胞来去除受损的线粒体,从而抑制脑损伤诱发的炎症,也可以通过稳定内皮的渗透性,减少神经元的死亡从而保护神经损伤,我们推测褪黑素水平增高可能是机体的一种自我保护机制,且褪黑素与矫正胎龄40周NBNA评分呈负相关。表明脑损伤越重,褪黑素水平越高。总之,褪黑素水平检测可用于早产儿脑损伤的诊断,而且能够为判断疾病的严重程度提供参考。其敏感度为 86.7%,特异度为68.4%。
[1] Hu Y, Wang Z, Pan S,et al. Melatonin protects against blood-brain barrier damage by inhibiting the TLR4/NFκB signaling pathway after LPS treatment in neonatal rats[J]. Oncotarget, 2017, 8(19):31638-31654.
[2] Moretti R,Zanin A, Pansiot J,et al. Melatonin reduces excitotoxic blood-brain barrier breakdown in neonatal rats[J].Neuroscience,2015, 311(17):382-397.
[3] 刘敬,杨于嘉,封志纯.“早产儿脑损伤诊断与防治专家共识”解读[J].中国当代儿科杂志,2012,14(12):885-887.
[4] 黄玮玲,卢红艳,王秋霞,等.激活素A对胎龄小于34周早产儿脑损伤的早期预测价值[J].医学研究杂志,2017,46(6):99-101.
[5] 张海燕,乔林霞,朱文英,等.NBNA评分联合头颅MRI在新生儿重度高胆红素血症脑损伤中的诊断价值[J].中国儿童保健杂志,2017,25(2):164-166.
[6] DE Martha,MD Weiss.Biomarkers of brain injury in the premature infant[J].Front Neurol,2013,3(3):185-192.
[7] Marseglia L, D’Angelo G,Manti S, et al.Melatonin Secretion Is Increased in Children with Severe Traumatic Brain Injury[J]. Int J Mol Sci,2017,18(5): 1053-1063.
[8] Patra A, Huang H, Bauer JA, et al.Neurological consequences of systemic inflammation in the premature neonate[J].Neural Regen Res, 2017,12(6):890-896.
[9] Paton MCB, McDonald CA, Allison BJ, et al.Perinatal Brain Injury As a Consequence of Preterm Birth and Intrauterine Inflammation: Designing Targeted Stem Cell Therapies[J].Front Neurosci,2017, 11(4):200.
[10] Ginsberg Y, Khatib N, Weiss B, et al.Magnesium sulfate (MG) prevents maternal inflammation inducedoffspring cerebral injury evident on MRI but not via IL-1β[J].Neuroscience,2017, 353(6):98-105.
[11] Shimada A, Hasegawa-Ishii S.Histological Architecture Underlying Brain-Immune Cell-Cell Interactions and the CerebralResponse to Systemic Inflammation[J].Front Immunol,2017, 8(17):1-12.
[12] Endesfelder S, Weichelt U, Strau E, et al.Neuroprotection by Caffeine in Hyperoxia-Induced Neonatal Brain Injury[J].Int J Mol Sci, 2017,18(1): 187-211.
[13] Lorente L, Martín MM, Abreu-González P, et al. Serum melatonin levels in survivor and non-survivor patients with traumatic brain injury[J]. BMC Neurol,2017,17(1):138-145.
[14] Yao L, Lu P, Ling EA.Melatonin Suppresses Toll Like Receptor 4-Dependent Caspase-3 Signaling Activation Coupled with Reduced Production of Proinflammatory Mediators in Hypoxic Microglia[J].PLoS One,2016,11(11):e0166010-0166023.
[15] Colella M, Biran V, Baud O.Melatonin and the newborn brain[J].Early Hum Dev,2016,102(9):1-3.
[16] Lin C, Chao H,Li Z, et al. Melatonin attenuates traumatic brain injury-induced inflammation: A possible role for mitophagy[J]. J Pineal Res, 2016,61(2):177-186.
