黑糯玉米芯可溶性膳食纤维的提取、结构表征及抗氧化活性研究
2018-07-02皮双双王静祎陈亚淑谢笔钧孙智达
皮双双,王静祎,陈亚淑,胡 凯,谢笔钧,孙智达
(华中农业大学食品科技学院,湖北武汉 430070)
膳食纤维是继碳水化合物、蛋白质、脂肪、水、维生素、矿物质六大营养素之外的人体“第七营养素”[1]。根据在水中的溶解性,膳食纤维可分为两大类:可溶性膳食纤维(soluble dietary fibre,SDF)和不溶性膳食纤维(Insoluble dietary fibre,IDF)[2]。膳食纤维可以促进肠道蠕动,促进粪便的排出,增加饱腹感,能有效降低血清中胆固醇水平以及肠道对葡萄糖的吸收,增加对矿物质的吸收,消除外源性有害物质,降低结肠癌、心脑血管疾病的发病率等[3-4]。
玉米(ZeamaysL.)是禾本科玉米属一年生草本植物,全世界每年种植玉米1.77亿多公顷,总产量9.7亿多吨,约占全球粮食总量的30%~35%。我国玉米产量占全世界总产量的20%左右,居世界第二[5]。玉米芯作为玉米加工的副产物,具有安全、无毒、来源广泛、资源充足等优点。我国玉米芯资源丰富,然而长期以来,除了极少一部分被用作牛羊等饲料外,绝大部分被当做废弃物丢弃,不仅浪费资源,而且造成了环境的污染[6]。黑糯玉米是一种保健果蔬玉米,口感黏糯,外观乌黑发亮。玉米籽粒富含水溶性黑色素及各种人体必需的微量元素和各种氨基酸,营养成分含量明显高于其他谷类作物,黑糯玉米芯中也富含较多的花色苷[7]。我国的黑糯玉米资源十分丰富,每年生产加工过程中会产生大量的黑糯玉米芯废弃物。如能对其进行有效的开发利用,不仅可以避免资源浪费,也能增加天然食品色素的种类,促进食品工业的发展[8]。SDF在很多方面比IDF有更强的生理功能,由于玉米芯主要是纤维素和木质素组成,因此运用纤维素酶解法使IDF转化为SDF[9]。
本实验以玉米芯为原料,采用α-淀粉酶、糖化酶、中性蛋白酶对原料进行预处理,采用纤维素酶法制备膳食纤维,在单因素的基础上进行正交实验,确定了最佳提取工艺。然后对提取的膳食纤维进行结构表征,并用多种方法对膳食纤维进行了抗氧化分析,以期为以后深入开发利用黑糯玉米芯提供参考。
1 材料与方法
1.1 材料与仪器
黑糯玉米 吉林祥裕食品有限公司;华玉15号玉米 来源于华中农业大学;α-淀粉酶(10000 U/mL) 北京双旋微生物培养基制造厂;糖化酶(10万U/g)、中性蛋白酶(100 U/mg)、纤维素酶(50 U/mg) 上海源叶生物科技有限公司;无水乙醇、95%乙醇、氢氧化钠、盐酸、硫酸、亚甲蓝、甲基红、DPPH(1,1-二苯基-2-三硝基苯肼)等 上海国药化学试剂有限公司;福林酚试剂 美国Sigma公司;上述化学试剂均为分析纯。
ZK-82B型真空干燥箱 德国CHRIST公司;SHZ-82A恒温水浴振荡器 常州国华电器有限公司;分析天平 上海伦捷公司;818型pH计 瑞士Mettler-Toledo FE20;RE-111旋转蒸发仪 瑞士Buchi公司;5805AN冷冻离心机 德国Eppendorf公司;JP-100A-02型高速多功能粉碎机 上海久品工贸有限公司;JSM-6390LV扫描电镜 日本NTC公司;UV-2100型紫外可见分光光度计 上海尤尼柯仪器有限公司。
1.2 实验方法
1.2.1 玉米芯基本成分测定 水分含量测定参照GB 5009.3-2016直接干燥法;蛋白质含量测定参照GB 5009.5-2016凯氏定氮法;淀粉含量测定参照GB 5009.9-2016酶水解法;脂肪测定参照GB 5009.6-2016索氏抽提法;灰分含量测定参照GB 5009.4-2016直接灰化法;膳食纤维测定参照GB 5009.88-2014。
1.2.2 SDF制备工艺流程 黑糯玉米芯→干燥→粉碎→酶解→离心→滤液→减压蒸馏浓缩→醇沉→沉淀冷冻干燥→SDF
1.2.3 操作要点 干燥、粉碎:将黑糯玉米人工剥粒,取芯放入烘干箱中,在50 ℃下干燥至恒重后放入高速多功能粉碎机中破碎,过60目筛,密封放置备用。
酶解:称量一定质量的原料粉,按一定的料液比均匀分散在水中,用0.10 mol/L NaOH调节至pH5.0,加入原料粉质量4%的混合酶(α-淀粉酶∶糖化酶=1∶3),在60 ℃下水解60 min,沸水浴5 min灭酶。调节pH7.0,加入原料粉质量1%的中性蛋白酶,温度50 ℃水解60 min,沸水浴5 min灭酶。然后加入一定量的纤维素酶,在一定温度下水解一定时间,沸水浴5 min灭酶[10]。
离心:将酶解灭酶后的样液以7656×g离心10 min,使液渣分离,收集上清液。
蒸馏浓缩:将滤液放置在旋转蒸发仪上45 ℃蒸发浓缩至样液体积为原来三分之一停止。
醇沉:将浓缩后的样液用0.1 mol/L的NaOH调节pH7.0,加入预热到60 ℃的4倍其体积95%的乙醇进行沉淀过夜[11]。
离心:醇沉后的样液以7656×g离心10 min,沉淀进行真空冷冻干燥,即为可溶性膳食纤维。
1.2.4 黑糯玉米芯SDF提取工艺单因素实验
1.2.4.1 料液比对SDF提取得率的影响 称取黑糯玉米芯粉5 g,在pH为4.5,加酶量为1%,酶解温度为50 ℃,酶解时间70 min的条件下,研究料液比为1∶10、1∶15、1∶20、1∶25、1∶30 g/mL对SDF提取得率的影响。
1.2.4.2 加酶量对SDF提取得率的影响 称取黑糯玉米芯粉5 g,在料液比为1∶25 g/mL,pH为4.5,酶解温度为50 ℃,酶解时间70 min的条件下,研究加酶量为0.5%、1.0%、1.5%、2.0%、2.5%对SDF提取得率的影响。
1.2.4.3 酶解温度对SDF提取得率的影响 称取黑糯玉米芯粉5 g,在料液比为1∶25 g/mL,pH为4.5,加酶量为2.0%,酶解时间70 min的条件下,研究酶解温度为30、40、50、60、70 ℃对SDF提取得率的影响。
1.2.4.4 酶解时间对SDF提取得率的影响 称取黑糯玉米芯粉5 g,在料液比为1∶25 g/mL,pH为4.5,加酶量为2.0%,酶解温度50 ℃下,研究酶解时间为30、50、70、90、110 min对SDF提取得率的影响。
1.2.5 黑糯玉米芯SDF提取的正交实验 在单因素实验的基础上,以料液比、加酶量、酶解温度、酶解时间四个影响因素为自变量,以SDF提取得率为指标,采用L9(34)进行正交实验设计[9],因素水平见表1。

表1 酶解正交实验的实验因素和水平Table 1 Experimental factors and levelsTable of enzyme orthogonal test
1.2.6 SDF提取得率的计算
1.2.7 还原糖含量的测定 准确吸取1 mL不同浓度梯度的葡萄糖标准溶液(浓度为0、0.2、0.4、0.6、0.8、1.0 mg/mL),加入2 mL DNS(3,5-二硝基水杨酸)试剂,混匀后沸水浴5 min进行显色,然后迅速冷却,稀释10倍后在540 nm处测定其吸光度,并绘制标准曲线[12],得到其线性回归方程为y=0.5085x-0.0107,R2=0.9993。
配制一定浓度的黑糯玉米芯SDF和华玉15号SDF溶液,按上述方法测定其还原糖含量。
1.2.8 总酚含量的测定 准确吸取0.2 mL不同浓度梯度的没食子酸标准溶液(浓度为0、10、20、30、40、50、60、70 μg/mL),加入1 mL福林酚试剂,加入0.8 mL 7.5%的碳酸钠溶液,充分混匀后避光放置2 h,在765 nm处测定吸光值,并绘制标准曲线[13],得到其线性回归方程为y=0.008x+0.011,R2=0.999。
配制一定浓度的黑糯玉米芯SDF和华玉15号SDF溶液,按上述方法测定其总酚含量。
1.2.9 花色苷含量的测定 采用pH示差法[14],准确吸取1 mg/mL的样品溶液1 mL,分别用pH1.0(0.2 mol/L KCl∶0.2 mol/L HCl=25∶67,v/v)和pH4.5(0.2 mol/L NaAc∶0.2 mol/L HAc=45∶50,v/v)的缓冲溶液稀释至5 mL,40 ℃下静置平衡30 min,用蒸馏水加相应缓冲溶液为空白对照,分别在520 nm和700 nm波长下测定吸光值,总花色苷含量以矢车菊色素-3-葡萄糖苷计,计算公式如下:
花色苷含量(mg/L)=A×MW×DF×1000/(ε×L)
A=(A520-A700)pH1.0-(A520-A700)pH4.5
式中:ε为矢车菊-3-葡萄糖苷消化系数,26900 L·(cm·mg)-1;L为光程,1 cm;DF为稀释倍数;MW为矢车菊-3-葡萄糖苷相对分子质量,449.2。
1.2.10 热稳定性分析 准确称取SDF样品5 mg,将其均匀的平铺在铝坩埚底盘中,用压片机将坩埚盖与坩埚底盘紧密压合,用镊子将坩埚置于差示扫描量热仪中。设置加热温度范围为50~300 ℃,以15 ℃/min的加热速率升温,气氛为60 mL/min流量的高纯氮[15]。
1.2.11 红外光谱分析 称取2 mg干燥的SDF样品和100 mg的干燥溴化钾粉末,置于玛瑙研钵中,并在红外灯附近研磨均匀。用压膜机压制透明完整的样品薄片,置于红外扫描仪中,迅速扫描,得到样品的红外光谱图。
1.2.12 超微结构分析 取少量干燥的SDF粉末,过100目筛,用溅射镀膜法进行镀金处理,并置于扫描电镜(SEM)下观察[16]。
1.2.13 DPPH自由基的清除能力的测定 准确吸取不同质量浓度的样品溶液2 mL,加入0.2 mmo1/L的DPPH自由基乙醇溶液2 mL,使其充分均匀混合,在室温条件下避光反应30 min,置于紫外517 nm条件下测其吸光值,空白组用等体积无水乙醇代替DPPH自由基溶液,对照组用等体积蒸馏水代替样品溶液[17]。按以下方法计算SDF对DPPH自由基的清除率:
式中:A0为对照组吸光值;Ai为样品组吸光值;Aj为空白组吸光值。
1.2.14 总还原能力的测定 准确吸取不同质量浓度的样品溶液2.5 mL,依次加入2.5 mL0.2 mol/L磷酸盐缓冲液(PBS,pH6.6)2.5 mL和1%六氰合铁酸钾溶液(K3Fe(CN)6)2.5 mL,在50 ℃条件下水浴20 min后快速冷却,加入10%三氯乙酸溶液2.5 mL,以3000 r/min离心10 min,取上清液5 mL,加入5 mL蒸馏水、0.1%的三氯化铁溶液1 mL,混匀混合后静置10 min,于700 nm波长条件下处测定其吸光值(蒸馏水作参比,调零),吸光值越大即表示还原力越强[18]。
1.2.15 羟自由基清除能力的测定 准确吸取1 mL 4.5 mmo1/L的FeSO4,加1 mL浓度为4.5 mmol/L的水杨酸-乙醇溶液,再加入不同溶度的待测样液1 mL,最后加入1 mL浓度为4.4 mmol/L的H2O2,使其充分均匀混合。37 ℃下恒温水浴30 min,用蒸馏水调零,置于紫外510 nm条件下测其吸光值,空白组用等体积蒸馏水代替样品溶液,对照组用等体积蒸馏水代替H2O2[19]。按以下方法计算SDF对羟自由基的清除率:
式中:A0为对照组吸光值;Ai为样品组吸光值;Aj为空白组吸光值。
1.3 数据处理
采用正交设计助手设计正交实验方案,用Origin 8.0软件作图。
2 结果与分析
2.1 玉米芯基本成分
由表2可知,黑糯玉米芯中蛋白质、淀粉、灰分、SDF的含量均高于华玉15号,华玉15号玉米芯中的脂肪和TDF含量高于黑糯玉米芯。玉米芯基本成分的差异可能使它们具有不同的物理性质。

表2 玉米芯的基本成分(%,w/w)Table 2 Content of corncob proximate compositon(%,w/w)
2.2 单因素实验
2.2.1 料液比对SDF提取得率的影响 由图1可以看出,随着料液比从1∶10~1∶30 g/mL逐渐递增时,黑糯玉米芯SDF的提取得率先增大后减小。在料液比为1∶25 g/mL时,SDF提取得率最大为2.98%。因此料液比在1∶25 g/mL左右时具有较高的SDF提取得率,料液比在此时更能使玉米芯在水中充分溶解,有利于酶的水解作用。当料液比较小时,玉米芯不能充分扩散,不能与酶充分接触,不利于水解;当料液比过大时,溶液被稀释,酶的作用效果减弱,因此适宜料液比为1∶25 g/mL。

图1 料液比对SDF提取得率的影响Fig.1 Effect of the liquid ratio on the extraction rate of SDF
2.2.2 加酶量对SDF提取得率的影响 由图2可以看出,随着加酶量从0.5%~2.0%的增加,玉米芯SDF的提取得率逐渐增加;当加酶量继续增加时,玉米芯SDF的提取得率有所下降。当加酶量在2.0%时,SDF提取得率达到最大为3.63%。根据酶促动力学原理,底物浓度一定时,当加酶量达到底物所需浓度时,随着酶用量的增加,会加速酶解过程。但进一步增大酶用量,由于酶解反应会有一个诱导期,会在一定的程度上增加了酶之间的竞争作用,反而达不到增加产物的效果[20]。因此,适宜加酶量为2.0%。

图2 加酶量对SDF提取得率的影响Fig.2 Effect of the enzyme amount on the extraction rate of SDF
2.2.3 酶解温度对SDF提取得率的影响 由图3可以看出,随着酶解温度从30~70 ℃依次上升时,SDF提取得率先是增加然后降低,当酶解温度在50 ℃时,SDF的提取得率最高为4.34%。因为酶都有其最适温度范围,超过其最适范围随着温度不断上升,酶的活性有部分丧失,所以提取得率会下降。因此,酶解的适宜温度为50 ℃。

图3 酶解温度对SDF提取得率的影响Fig.3 Effect of the enzymatic hydorlysis temperature on the extraction rate of SDF
2.2.4 酶解时间对SDF提取得率的影响 由图4可以看出,随着酶解时间从30 min增加到90 min,SDF的提取得率随时间增加而增大,当酶解90 min时,提取得率达到最高为3.73%。SDF提取得率在90 min后随时间增加有所下降,因为随着时间的延长,酶的活力有所下降。因此,适宜酶解时间为90 min。

图4 酶解时间对SDF提取得率的影响Fig.4 Effect of the enzymatic hydorlysis time on the extraction rate of SDF
2.3 正交实验
由表3可知,对正交实验进行极差分析结果显示,影响黑糯玉米芯SDF提取得率因素的主次顺序为酶解温度>加酶量>料液比>酶解时间。通过正交实验结果可以得出黑糯玉米芯SDF提取的最优组合方案为A2B3C1D1,即料液比为1∶25 g/mL、加酶量为2.5%、酶解温度为45 ℃、酶解时间为70 min,此时SDF 提取得率最大为4.36%。

表3 正交实验设计及结果Table 3 Orthogonal experimental design and result
2.4 还原糖和总酚含量
按照黑糯玉米芯SDF最佳提取工艺分别提取两种玉米芯的SDF。由图5可以看出,黑糯玉米芯SDF的还原糖含量和总酚含量均高于华玉15号SDF。SDF1的还原糖含量为SDF2的1.65倍,SDF1总酚含量是SDF2的2.10倍。根据还原糖含量和总酚含量可以推测,SDF1的抗氧化性要高于SDF2。
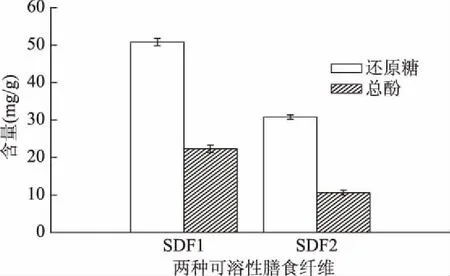
图5 两种膳食纤维中还原糖和总酚含量Fig.5 Content of glucose and total phenol in two kinds of dietary fiber注:SDF1为黑糯玉米芯可溶性膳食纤维, SDF2为华育15号可溶性膳食纤维;图8~图11同。
2.5 花色苷含量的测定
由表4可知,黑糯玉米芯中富含花色苷,含量为(33.14±1.24) mg/g,而华玉15号玉米芯不含花色苷。以这两种不同的原料提取的SDF中花色苷含量也不同,SDF1中含有少量花色苷,含量为(0.17±0.013) mg/g,而SDF2不含花色苷。花色苷的存在可能使SDF1具有更好的抗氧化活性和生理功能。

表4 不同原料中花色苷含量Table 4 Anthocyanin content in different materials
2.6 热稳定性分析
通过差示扫描量热法来测定玉米芯SDF的热稳定性。如图6所示SDF在114.79~171.83 ℃有一个大的吸热峰,126.23 ℃为最大热裂解温度,而SDF2的热裂解从118.62 ℃开始,到209.53 ℃基本完成,最大热裂解温度为130.08 ℃。结果表明SDF2起始和最大热裂解温度均高于SDF1,说明SDF2热稳定性略高于SDF1。

图6 SDF的热稳定性分析图Fig.6 Thermal stability analysis of SDF
2.7 红外光谱分析
两种玉米芯SDF的红外吸收光谱图如图7所示,由图可以看出,两种样品的光谱图大体相似,均具有多糖红外图谱的典型特征。图中3420 cm-1处呈现的吸收较强的宽峰是O-H的伸缩振动峰且SDF1的吸收强度显著大于SDF2,这可能是SDF1中所含花色苷苯环上的羟基引起的;2950 、2930cm-1处的弱峰是由糖类的-CH2-上C-H的收缩振动引起的;1730 cm-1是-C=O的伸缩振动峰,且SDF1的吸收强度强于SDF2,可能是由SDF1中含有的花色苷中的羰基所引起的;1200~1500 cm-1呈现的是C-H的变角振动峰;1100、1070 cm-1处最强吸收峰是糖类C-O的收缩振动峰。818 cm-1和802 cm-1处的吸收峰是呋喃糖衍生物的特征吸收峰[21]。
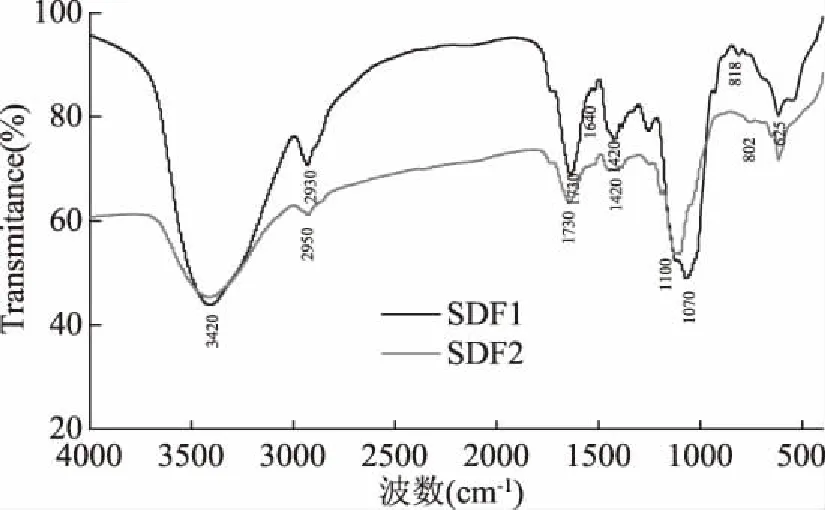
图7 SDF的红外图谱Fig.7 Infrared spectra of SDF
2.8 超微结构分析
通过不同放大倍数的扫描电镜观察两种SDF的样品表面结构如图8所示。由图a和b可以看出黑糯玉米芯SDF表面结构疏松,高倍镜下呈现有规律的多孔状网格结构,具有较大的表面积。由图c和d可以看出华玉15号玉米芯SDF表面较平滑紧密,但无规则,高倍镜下只有数量较少的孔状结构,大部分呈大小不一结构。以上均表明黑糯玉米芯SDF结构具有更大的表面积,与其他物质结合时可以形成更多的结合位点,从而较华玉15号玉米芯SDF有更强的生物活性。

图8 玉米芯可SDF的扫描电镜图Fig.8 SEM micrograph of corncob SDF
2.9 DPPH自由基的清除能力的测定
DPPH自由基是一种很稳定的氮中心的自由基,具有未成对电子。它的醇溶液呈现紫色,在517 nm处有最大吸收,吸光度与浓度呈线性关系。向其中加入自由基清除剂时,可以结合或替代DPPH自由基,使自由基数量减少,吸光度变小,溶液颜色变浅,借此可评价清除自由基的能力[22]。由图9可以看出,两种SDF均具有一定的清除DPPH自由基的能力,且随着浓度的增加,清除率呈现先增大后趋于平缓的趋势,且SDF1和SDF2对DPPH自由基的清除能力顺序为:SDF1>SDF2,它们的IC50值分别为0.59、0.80 mg/mL。

图9 玉米芯SDF清除DPPH自由基能力Fig.9 Corncob SDF scavenging effects on DPPH radical
2.10 总还原能力的测定
由图10可知,两种SDF具有一定的总还原能力,且随着浓度的升高,溶液的吸光值提高,即总还原力提高。两种SDF的总还原力顺序为:SDF2>SDF1,它们的A0.5分别为3.25、3.70 mg/mL。由此可得,黑糯玉米芯SDF的总还原力弱于华玉15号玉米芯SDF。
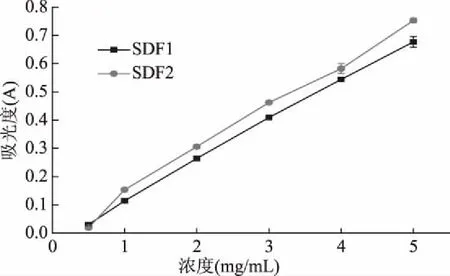
图10 玉米芯SDF的总还原力Fig.10 The reduction ability of corncob SDF
2.11 羟自由基清除能力的测定
羟自由基是活性最强的氧自由基,也是最活泼、毒性最大的自由基,半衰期短,反应迅速。H2O2和Fe2+发生Fenton反应,可生成很高活性的羟基自由基。水杨酸能有效捕捉羟自由基并生成有色物质,在510 nm处有最大吸收。反应体系中含有具有清除羟自由基的物质会与水杨酸竞争,从而减少有色物质的产生。由图11可知,SDF1和SDF2的羟自由基清除能力都随浓度升高而增强,并且SDF1的清除率远高于SDF2。当浓度为1.5 mg/mL时,SDF1对羟自由基的清除率为44.90%±3.66%,而SDF2对羟自由基的清除率为9.05%±1.54%;SDF1的IC50值为1.70 mg/mL,而SDF2对羟自由基的清除能力很弱,其IC50值>3.50 mg/mL。因此SDF1对 羟自由基的清除能力远大于SDF2。

图11 玉米芯SDF清除羟自由基能力Fig.11 Corncob SDF hydroxyl radical scavenging ability
3 结论
黑糯玉米芯SDF的提取最佳条件为:料液比为1∶25 g/mL,纤维素酶加酶量为2.5%,酶解温度在45 ℃,酶解时间为70 min,以此条件提取SDF,测定提取得率为4.36%。在此条件下提取黑糯玉米芯和华玉15号玉米芯的SDF,实验表明黑糯玉米芯SDF的酚含量和还原糖含量比华玉15号玉米芯SDF高,原因可能在于黑糯玉米芯SDF当中含有花色苷;比较两者的红外光谱分析和热稳定性分析,发现两种SDF均具有多糖的红外吸收,并且华玉15号玉米芯SDF的热稳定性要强于黑糯玉米芯SDF;比较两种SDF的表面结构,发现黑糯玉米芯SDF表面呈疏松、有规律的多孔状结构,而华玉15号玉米芯SDF表面较平滑结构无规则,高倍镜下只有数量较少的孔状结构,大部分呈大小不一结构,可以看出黑糯玉米芯SDF结构具有更大的表面积,与其他物质结合时可以形成更多的结合位点,从而较华玉15号玉米芯SDF有更强的生物活性。抗氧化活性实验表明:与华玉15号玉米芯SDF相比,黑糯玉米芯SDF除总还原能力稍弱外,对DPPH自由基的清除能力,羟自由基清除能力均更高,显示了良好的抗氧化活性。
[1]邓建仙. 膳食纤维及其生理功能[J]. 粮食与油脂,1994(1):1-4.
[2]Mckee LH,Latner T. Underutilized sources of dietary fibre:A review[J]. Plant Foods Human Nutr,2000,55(4):285-304.
[3]Yang J,Xiao A H,Wang C W. Novel development and characterisation of dietary fibre from yellow soybean hulls[J]. Food Chemisty,2014,161:367-375.
[4]Rodriguez R,Jimenez A,Fernandezbolanos J,et al. Dietary fibre from vegetable products as source of functional ingredients[J]. Trends in Food Science & Technology,2006,17(1):3-15.
[5]石长波,马永强,韩春然,等. 木聚糖酶法制备水溶性玉米膳食纤维的工艺研究[J]. 食品科学,2007,28(4):121-125.
[6]杨玉玲,杨晓蓉. 利用玉米秸芯研制膳食纤维[J]. 冷饮与速冻食品工业,2000,6(4):10-12.
[7]张钟,宫坤,陈守江. 黑糯玉米芯色素的提取及性质研究[J]. 中国粮油学报,2004,19(2):62-63.
[8]周洁. 黑糯玉米的研究现状[J]. 安徽农业技术师范学院学报,2000,14(2):76-77.
[9]李昌文,纵伟,李江涛,等. 玉米芯制备水溶性膳食纤维工艺条件研究[J]. 食品工业,2014(2):33-35.
[10]于丽娜,杨庆利,毕洁,等. 花生壳水溶性膳食纤维不同提取工艺及其抗氧化活性研究[J]. 食品科学,2009,30(22):27-32.
[11]康丽君,寇芳,沈蒙,等. 响应面实验优化小米糠膳食纤维改性工艺及其结构分析[J]. 食品科学,2017,38(2):240-247.
[12]崔辉梅,石国亮,安君和. 马铃薯还原糖含量测定方法的比较研究[J]. 安徽农业科学,2006,34(19):4821-4823.
[13]颜小捷,谷陟欣,卢凤来,等. FOLIN-酚比色法测定裸花紫珠中总酚含量[J]. 中国实验方剂学杂志,2013,19(18):74-78.
[14]刘晓燕,李金星,刘志刚,等. 中压液相色谱与大孔树脂联用纯化蓝莓果渣中花色苷[J]. 食品科技,2014,39(6):207-213.
[15]董文成.柑橘果实膳食纤维物化特性及其性能表征研究[D].杭州:浙江大学,2015.
[16]郭婷婷.米糠可溶性膳食纤维降脂功能及应用研究[D].武汉:华中农业大学,2015.
[17]周玮婧,隋勇,孙智达,等. 荔枝皮原花青素与VC、VE的协同抗氧化研究[J]. 食品科学,2012,33(3):5-8.
[18]Liang C H,Syu J L,Mau J L. Antioxidantproperties of solid-state fermented adlay and rice by Phellinus[J].Food Chemistry,2009,116(4):841-845.
[19]钟艳萍. 水溶性膳食纤维的制备及性能研究[D]. 广州:华南理工大学,2011.
[20]崔立,刘忠. 酶水解纤维素条件的优化[J]. 天津科技大学学报,2010,25(2):41-44.
[21]张灿,孙梦洋,胡凯,等. 黑白两种糯米米糠可溶性膳食纤维的特性及对淀粉体外消化吸收的影响[J]. 华中农业大学学报,2017,36(5):81-89.
[22]孙梦洋,张灿,陈亚淑,等. 黑糯玉米芯花色苷提取工艺优化及抗氧化活性研究[J]. 食品工业科技,2017,38(10):307-312.
