怀菊花中总黄酮的提取及其抗氧化性研究
2018-07-02李金凤刘华敏谷令彪刘孝宁宋晓龙庞会利秦广雍
李金凤,刘华敏,谷令彪,隋 博,刘孝宁,宋晓龙,庞会利,*,秦广雍
(1.郑州大学物理工程学院,河南郑州 450001; 2.河南工业大学粮油食品学院,河南郑州 450001; 3.安阳工学院生物与食品工程学院,河南安阳 455000; 4.焦作市云台山农业科技有限公司,河南焦作 454350)
怀菊花(HuaijuChrysanthemum)为“四大怀药”之一,产自河南焦作武陟县,历史悠久,是药用菊花的始祖[1],有良好的清热祛风[2]、抗炎抗菌[3]、平肝明目[2]、解毒[4]、降血脂[5]、降血糖[5]、降血压[6]、抗病毒[4]、抗氧化[7-8]和抗凝血[7]等功效。
研究表明,菊花的抗氧化活性跟其所含的总黄酮成分有相关性。孙静等[3]研究发现,河北香菊中5种黄酮类成分在清除DPPH自由基上呈现出较好的活性,活性顺序从高到低为木犀草素、木犀草苷、芹菜素、金合欢苏、金合欢苷;并且得出河北香菊所具有的抗氧化活性与其所含总黄酮成分清除自由基有关。孔琪等[9]研究发现,菊花黄酮对猪油的氧化有显著的抑制作用,且其抗氧化能力随着质量分数的增加而增强。Kim等[10]借助DPPH自由基和超氧阴离子自由基清除系统,来研究二咖啡酰奎宁酸的抗氧化作用。
亚临界水是指在一定压力下,将水加热到100 ℃以上、临界温度374 ℃以下,仍然保持在液体状态的水[11]。在此状态下,水的极性、表面张力和黏度均有所降低,对黄酮类物质的溶解能力大大提升[12]。
本研究采用亚临界水萃取技术,提取了焦作云台冰菊中的总黄酮,对提取过程进行了单因素及响应面优化实验,并利用可见分光光度计考察了总黄酮的抗氧化性活性,以期为怀菊花黄酮的提取及应用,提供一定数据参考。
1 材料与方法
1.1 材料与仪器
怀菊花 由河南省焦作市云台山农业科技有限公司提供的云台冰菊,为2016年收获并烘干的样品;芦丁标准品(CAS153-18-4)、DPPH(CAS:1898-66-4) 上海源叶生物科技有限公司;无水乙醇、亚硝酸钠、硝酸铝、氢氧化钠、二水合磷酸二氢钠、十二水合磷酸氢二钠、邻苯三酚、37%浓盐酸、七水合硫酸亚铁、水杨酸、30%过氧化氢、铁氰化钾、三氯乙酸、三氯化铁 分析纯,天津市凯通化学试剂有限公司。
DTD-6R型超声清洗机 鼎泰生化科技设备制造有限公司;722型可见分光光度计、MP5002型电子天平(0.01 g) 上海舜宇恒平科学仪器有限公司;HWCL-1型集热式恒温磁力搅拌浴、SHB-Ⅲ型循环水式多用真空泵、R-1001VN型旋转蒸发仪、WB-2000型水浴锅 郑州长城科工贸有限公司;EL204型电子天平(实际分度值0.0001 g) 梅特勒-托力多仪器有限公司;DZKW-4型电子恒温水浴锅 北京中兴伟业仪器有限公司;FX101-3型电子鼓风干燥箱 上海树立仪器仪表有限公司;TG16型台式高速离心机 长沙英泰仪器有限公司;JR350型多功能轻便型粉碎机 上海长沙工贸有限公司。
1.2 实验方法
1.2.1 工艺流程 怀菊花→挑选→干燥→粉碎→亚临界水提取→离心→抽滤→减压浓缩→醇沉→减压滤过→减压浓缩→总黄酮提取液→4 ℃冰箱保存备用。
筛选出无霉变、无虫蛀及无杂质的颜色鲜艳的新鲜干菊花,60 ℃干燥60 min,最终含水率为7.9%,用粉碎机将其粉碎并过40目筛;在利用亚临界水提取过程中,要注意高温耐压瓶不可接触槽内底部、侧壁及温度传感器探头,夹在支架上的温度传感器探头插入溶液中不得少于5 cm,但不能影响搅拌。
1.2.2 总黄酮的提取 将恒温干燥过的菊花粉碎,过40目筛,称取2 g菊花粉置于高温耐压瓶中,按单因素实验设计的提取温度、提取时间、液固比和磁力搅拌速率进行提取。提取结束后提取液经3000 r/min离心10 min,上清液趁热真空抽滤,弃去滤渣,再减压浓缩至30 mL,加入4倍体积80%乙醇溶液在4 ℃冰箱醇沉12 h,使多糖充分沉淀,真空抽滤,滤液在45 ℃下减压浓缩至30 mL,储存于4 ℃冰箱中待用[13]。
1.2.3 亚临界水提取菊花黄酮的单因素实验 在提取时间为50 min,液固比为50∶1 mL/g,磁力搅拌转速为1400 r/min,提取温度为110、120、130、140、150 ℃条件下进行提取;提取结束后离心除杂、醇沉、减压浓缩,计算黄酮提取量。
在提取温度为130 ℃,液固比为50∶1 mL/g,磁力搅拌转速为1400 r/min,提取时间为20、30、40、50、60 min条件下进行提取;提取结束后离心除杂、醇沉、减压浓缩,计算黄酮提取量。
在提取温度为130 ℃,提取时间为50 min,磁力搅拌转速为1400 r/min,液固比为30∶1、40∶1、50∶1、60∶1、70∶1 mL/g条件下进行提取;提取结束后离心除杂、醇沉、减压浓缩,计算黄酮提取量。
在提取温度为130 ℃,提取时间为50 min,液固比为50∶1 mL/g,磁力搅拌转速为200、600、1000、1400、1800 r/min条件下进行提取;提取结束后离心除杂、醇沉、减压浓缩,计算黄酮提取量。
1.2.4 响应面实验 单因素实验可看出,磁力搅拌转速对黄酮提取量的影响较小,提取量变化不大,因此选择提取温度、提取时间、液固比为自变量,根据Design-Expert V8.0.6.1软件中的Box-Behnken实验设计原理,进行3因素3水平的响应面实验,对云台冰菊中总黄酮类的提取条件进行优化。实验设计见表1。

表1 响应面设计因素水平表Table 1 Factors and levelsTable of Box-Behnken experimental design
1.2.5 验证实验 根据响应面实验结果预测得到的最佳条件进行提取验证实验,重复3次。
1.2.6 总黄酮测定方法及标准曲线的绘制 精密取芦丁标准品4 mg于10 mL容量瓶中,用60%乙醇溶液稀释至刻度,摇均,即得浓度为0.4 mg/mL的芦丁标准溶液。分别取上述溶液0、0.5、1、2、2.5、4 mL于10 mL容量瓶中,加60%乙醇溶液定容至4 mL,各加5%亚硝酸钠溶液0.4 mL,摇匀,放置反应6 min,再各加10%硝酸铝溶液0.4 mL,摇匀,放置6 min,各加4%氢氧化钠溶液4 mL,用60%乙醇定容至刻度,摇匀,放置15 min,以蒸馏水做空白对照,利用可见分光光度计在510 nm波长处测量吸光度,以质量浓度x(mg/mL)为横坐标,吸光度y为纵坐标,绘制标准曲线,见图1,得到线性回归方程y=3.8031x+0.0125,R2=0.9961。表明在0~0.16 mg/mL,总黄酮浓度和吸光度的线性良好。

图1 芦丁标准曲线Fig.1 Standard curve of rutin
样品总黄酮的测定:取1 mL提取液于50 mL离心管中,稀释30倍,按照制作标准曲线时方法进行显色反应,测定吸光度,带入回归方程计算总黄酮量,按下列公式计算总黄酮提取量:
式(1)
式中:C为稀释后测定的提取液浓度(mg/mL);n为稀释的倍数;V为样品液的体积(mL);W为样品的质量(g)。
1.2.7 超氧阴离子的清除率的测定 利用邻苯三酚自氧化法来评定总黄酮清除超氧阴离子的能力[14-15]。
式(2)
式中:A0为加入蒸馏水空白体系的吸光值;Ai为加入样品液的吸光值;Ai0为不加邻苯三酚的样品溶液本底的吸光值。
1.2.8 羟基自由基清除率的测定 利用邻菲罗啉法测定总黄酮清除羟基自由基的能力[16]。
式(3)
式中:A0为空白对照液的吸光度;Ai为加入样品溶液的吸光度;Ai0为不加显色剂H2O2的样品溶液本底的吸光度。
1.2.9 还原能力的测定 采用普鲁士兰法测还原能力[17]。
还原能力的大小ΔA=A-A0
式(4)
式中:A为样品的吸光值;A0为空白组的吸光值。
1.2.10 DPPH自由基清除率的测定 利用DPPH自由基法测定其抗氧化活性[10]。
式(5)
式中:A0为1.0 mL蒸馏水+3.0 mL DPPH乙醇溶液的吸光值;As为1.0 mL样液+3.0 mL DPPH乙醇溶液的吸光值;Ac为1.0 mL样液+3.0 mL无水乙醇的吸光值。
1.2.11 数据统计分析 用Microsoft Excel和Origin 9.0数据分析软件进行数据处理和差异显著性分析,通过软件Design-Expert 8.0.6得出怀菊花总黄酮提取的最佳条件,并进行验证实验。
2 黄酮提取的单因素实验和优化实验
2.1 单因素实验
2.1.1 提取温度对黄酮提取量及其抗氧化活性的影响 提取温度对黄酮提取量及其抗氧化活性的影响如图2所示。
由图2可以看出,随着提取温度的升高,黄酮的提取量不断增加,在120 ℃达到最大值(58.157 mg/g),而后提取量呈下降的趋势。这是因为,在一定范围内,提取温度的提升使得分子运动加快,溶质的传质系数及扩散速度均有所升高,从而有助于黄酮的溶出;然而过高的提取温度,会使总黄酮部分分解,多糖和蛋白质等非提取成分浸出并形成泡沫,包裹在物料表面,致使提取不充分[18]。
由图2中的a、b、c可看出,随着浓度的增加,超氧阴离子自由基与羟基自由基的清除作用、相对还原能力也逐渐增大,并且表现出一定的量效关系,分别在120 ℃达到最大值,这与杨琳琳[19]对黑心菊花瓣的抗氧化活性研究相一致;图2d可以看出,在提取温度120 ℃时,黄酮提取量最大(58.157 mg/g),其DPPH自由基清除率(66.7%)低于在提取温度为130 ℃时的DPPH自由基清除率(67.8%);随着黄酮浓度的增加,DPPH自由基的清除率开始有轻微下降。这可能因为某些内源性抗氧化物质可能发生一定降解,因而清除DPPH自由基的能力反而下降。

图2 提取温度对黄酮提取量及其抗氧化活性的影响Fig.2 Effect of temperature on extraction yield and antioxidant activity
2.1.2 提取时间对黄酮提取量及其抗氧化活性的影响 提取时间对黄酮提取量及其抗氧化活性的影响如图3所示。
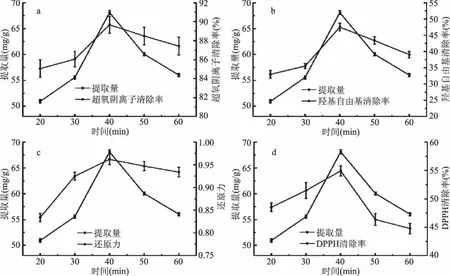
图3 时间对黄酮提取量及其抗氧化活性的影响Fig.3 Effect of time on extraction yield and antioxidant activity
由图3看出,一定时间范围内,随着提取时间的增加,黄酮提取量不断上升,在提取时间为40 min时黄酮量达到最大值(68.096 mg/g),此后开始缓慢下降。原因可能是在饱和溶液中,时间的延长不会增加溶质的量;此外,时间过长还会导致黄酮的分解[20]。同时,由图3可知,在提取时间为40 min时,超氧阴离子清除率、羟基自由基清除率、相对还原能力及DPPH自由基清除率均达到峰值,分别为89.7%、47.5%、0.962和55.0%,其后随着提取时间的延长,黄酮提取量的减少,各指标均开始呈不同程度下降趋势,这可能因为某些抗氧化物质发生了一定的降解;另外,在一定浓度范围内,随浓度的增加,超氧阴离子清除率、羟基自由基清除率、相对还原能力及DPPH自由基清除率均有增大趋势,并表现出一定的量变效应,这与杨琳琳[19]对黑心菊花瓣的抗氧化活性研究相一致。
2.1.3 液固比对黄酮提取量及其抗氧化活性的影响 液固比对黄酮提取量及其抗氧化活性的影响如图4所示。

图4 液固比对黄酮提取量及其抗氧化活性的影响Fig.4 Effect of liquid-solid ratio on extraction yield and antioxidant activity
由图4可知,液固比在40∶1 mL/g时,黄酮提取量最大,液固比过高时,一方面增加了提取操作时的加热时间,影响后续操作;二则会提取出水溶性多糖和蛋白质,导致总黄酮溶出受阻[12]。从图4中的a、b、c、d可以得出,总黄酮类具有一定的抗氧化活性,在液固比为40∶1 mL/g时,黄酮提取量为68.46 mg/g,达到最大值,超氧阴离子清除率、羟基自由基清除率、相对还原能力及DPPH自由基清除率均达到最高值,分别为94.07%、49.88%、0.975和73.61%,随着液固比继续增加,黄酮提取量减少,各抗氧化指标开始下降。
2.1.4 磁力搅拌转速对黄酮提取量及其抗氧化活性的影响 磁力搅拌转速对黄酮提取量及其抗氧化活性的影响如图5所示。

图5 转速对黄酮提取量及其抗氧化活性的影响Fig.5 Effect of magnetic stirring speed on extraction yield and antioxidant activity
由图5可知,磁力搅拌转速在200~1400 r/min时,随着转速的增加,黄酮的提取量增加,在1400 r/min时达到最大值,这可能是因为在此阶段加大转速能提高混合效果,在1400 r/min下菊花粉末与亚临界水能迅速混匀,因而可以使提取量达到最大值;在1400~1800 r/min范围内,提取量呈下降趋势,可能因为过大的转速使提取过程中物料飞溅在耐压瓶壁上,造成损失,致使提取不充分[21];另外,磁力搅拌转速与抗氧化活性在一定程度上有量效应,在1400 r/min时,超氧阴离子清除率、羟基自由基清除率、相对还原能力及DPPH自由基清除率均达到顶峰,分别为92.62%、47.64%、0.956、57.89%,其后开始下降。
2.2 响应面实验
2.2.1 响应面实验设计及结果 响应面实验设计及结果如表2所示。

表2 响应面实验设计及结果Table 2 Design and results of Box-Behnken experiment
各因素经多元回归拟合,得到多元回归方程为Y=-738.50569+9.54039A-0.9438B+6.91147C+0.082109AB+0.058662AC-0.047774BC-0.058136A2-0.084318B2-0.13439C2
式(6)
式(6)中方程的二次项系数均为负值,得出方程代表的抛物面开口朝下,具有极大值点,可进行优化分析[22]。

表3 二次回归方程模型方差分析Table 3 ANOVA for the quadratic regression model
2.2.2 响应曲面图分析与优化 根据回归方程,作响应曲面图,考察所拟合的响应曲面形状,分析提取温度、液固比、提取时间对黄酮提取量的影响。该模型的3D响应面图及2D轮廓图如图6~图8所示。

图6 提取温度和液固比对黄酮提取量影响的 3D响应面图及2D轮廓图Fig.6 3D response surface and 2D contours plots of effect of temperature and liquid to solid ratio on flavonoids extraction

图7 提取温度和提取时间对黄酮提取量影响的 3D响应面图及2D轮廓图Fig.7 3D response surface and 2D contours plots of effect of temperature and time on flavonoids extraction

图8 提取时间和液固比对黄酮提取量影响的 3D响应面图及2D轮廓图Fig.8 3D response surface and 2D contours plots of effect of time and liquid to solid ratio on flavonoids extraction
由各图中3D轮廓图可看出,响应曲面坡度的陡峭度,表示伴随着影响因素的变化,其相应响应值的变化情况,响应曲面愈陡峭,2个因素间的交互作用对黄酮提取量的影响越大。
上述3个图中响应曲面都较陡峭,说明提取温度和液固比、提取时间和提取温度及提取时间和液固比之间的交互作用对黄酮提取量影响较大。
2D轮廓图的形状可反映出交互效应的强弱,椭圆形表示两因素交互作用显著,而圆形则不显著[24]。结合二次回归模型方差分析中的p值,比较3组图可以得出,3个因素间两两交互作用都达到了较显著水平。从3个图的等高线还可以看出,提取温度对黄酮提取量的影响要高于液固比;提取时间对黄酮提取量的影响要高于提取温度;提取时间对黄酮提取量的影响要高于液固比。
比较3D响应面图中最高点和2D轮廓图可得,在所选范围内有极大值点,即响应面最高点,也是2D轮廓图最小椭圆的中心点。经规范分析和计算得较佳反应时提取温度为130 ℃、液固比为44.63∶1 mL/g、提取时间为46.17 min,估测黄酮提取量为71.856 mg/g。
由于实验条件限制,优化最优条件为提取温度130 ℃、液固比44∶1 mL/g、提取时间46 min,在此条件下实验,得到黄酮提取量为(71.796±0.24) mg/g,这与预测值71.806 mg/g接近。
3 结论
本研究以云台冰菊为材料,采用亚临界水法提取怀菊花中总黄酮,考察了提取时间、提取温度、液固比及磁力搅拌转速对黄酮提取量及其抗氧化活性的影响,并根据Box-Behnken实验设计原理对提取过程进行了响应面优化,得出了以下结论:怀菊花中总黄酮的抗氧化活性,在超氧阴离子自由基清除作用、羟基自由基清除作用、相对还原能力及DPPH自由基清除率上,均表现了一定的量变效应;怀菊花中黄酮的最佳提取工艺条件为:提取温度130 ℃、提取时间46 min、液固比为44∶1 mL/g,此时菊花中黄酮类物质的实际提取量为71.796 mg/g。本研究较为系统地研究怀菊花中黄酮及其抗氧化功效,为生产实践提供参考。
[1]王德群,梁益敏,刘守金,等. 中国药用菊花的品种演变[J]. 中国中药杂志,1999,24(10):584-587.
[2]国家药典委员会.中华人民共和国药典[M]. 北京:中国医药科技出版社,2010.
[3]孙静,黄芸,孙桂波,等. 河北香菊中黄酮类成分体外抗氧化活性研究及构效关系探讨[J]. 中国中药杂志,2012,37(13):1958-1962.
[4]樊高洁. 野菊花保肝微丸质量标准及野菊花黄色素提取分离工艺研究[D]. 郑州:郑州大学,2017.
[5]Jing S,Chai W,Guo G,et al. Comparison of antioxidant and antiproliferative activity between Kunlun Chrysanthemum flowers polysaccharides(KCCP)and fraction PII separated by column chromatography[J]. Journal of Chromatography B Analytical Technologies in the Biomedical & Life Sciences,2016,1019(15):169-177.
[6]齐芳芳,颜美秋,鲁文杰,等. 复方野菊花降压颗粒提取工艺及制剂工艺研究[J]. 浙江中医药大学学报,2017,41(4):323-328.
[7]He J,Wu X,Kuang Y,et al. Quality assessment of Chrysanthemum indicum,flower by simultaneous quantification of six major ingredients using a single reference standard combined with HPLC fingerprint analysis[J]. Asian Journal of Pharmaceutical Sciences,2016,11(2):265-272.
[8]Deng G F,Lin X,Xu X R,et al. Antioxidant capacities and total phenolic contents of 56 vegetables[J]. Journal of Functional Foods,2013,5(1):260-266.
[9]孔琪,吴春. 菊花黄酮的提取及抗氧化活性研究[J]. 中草药,2004,35(9):1001-1002.
[10]Kim HJ,Lee YS. Identification of new dicaffeoylquinic acids from Chrysanthemum morifolium and their antioxidant activities[J]. Planta Medica,2005,71(9):871-876.
[11]祁英. 亚临界水技术研究天山雪菊的活性成分[D]. 乌鲁木齐:新疆大学,2014.
[12]周丽,张博雅,张永忠. 亚临界水提取葛根中总异黄酮的研究[J]. 中草药,2012,43(3):492-495.
[13]王婷婷,王少康,黄桂玲,等. 菊花主要活性成分含量及其抗氧化活性测定[J]. 食品科学,2013,34(15):95-99.
[14]Yuan J,Hao L J,Wu G,et al. Effects of drying methods on the phytochemicals contents and antioxidant properties of chrysanthemum flower heads harvested at two developmental stages[J]. Journal of Functional Foods,2015,19:786-795.
[15]Zheng C,Dong Q,Chen H,et al. Structural characterization of a polysaccharide from Chrysanthemum morifolium flowers and its antioxidant activity[J]. Carbohydrate Polymers,2015,130(4):113-121.
[16]宋丽. 长白山野菊花油提取工艺研究及成分分析[D]. 长春:吉林农业大学,2016.
[17]艾小钰,高玮,黄霞,等. 不同茶饮产品的抗氧化能力分析及感官评价[J]. 食品工业科技,2015,36(20):164-167.
[18]刘淑兰,张永忠,姚琪,等. 亚临界水法提取大豆酱渣饼中总异黄酮的研究[J]. 中国油脂,2010,35(11):64-67.
[19]杨琳琳. 黑心菊花瓣中黄酮类化合物的提取及抗氧化活性研究[D]. 长春:吉林农业大学,2013.
[20]郭娟,杨日福,范晓丹,等. 肉桂精油的亚临界水提取[J].林产化学与工业,2014,34(3):92-98.
[21]王晓东,李廷举,金俊泽,等. 磁力搅拌法的研究与开发[J]. 材料科学与工艺,2000,8(4):1-5.
[22]乔小瑞,烟利亚,刘兴岚,等. 荔枝壳多酚提取工艺的响应面法优化及自由基清除活性研究[J]. 中国食品学报,2010,10(5):22-30.
[23]谢三都,熊荣华. 响应面法优化金银花水溶性多糖提取工艺条件[J]. 农产品加工·创新版,2013(1):38-41.
[24]王卫东,李超,崔恒薇,等. 响应面法优化微波辅助提取芦笋黄酮的研究[J].中国食品添加剂,2010(6):72-76.
