戊糖片球菌NCU301对豆粕强化发酵工艺优化及营养成分的测定
2018-07-02关倩倩肖阳生
王 浩,熊 涛,彭 珍,关倩倩,肖阳生
(南昌大学食品科学与技术国家重点实验室,江西南昌 330047)
抗生素被批准作为饲料添加剂以来,以其能有效地促进畜禽生长和提高饲料的利用率等优点在全球范围内得到了广泛的应用,但同时也带来了药物残留和抗药性等一系列严峻的社会问题[1-2],寻找抗生素替代品已成为当务之急,开发绿色、高效、安全的饲料添加剂是发展现代畜牧业的基础[3]。目前抗生素替代品主要有益生菌、益生元、酸化剂、酶制剂、中草药饲料添加剂等[4]。其中益生菌具有抑制动物肠道病原菌的生长、提高动物的免疫力及生产性能等优点,现已成为饲料添加剂的研究热点[5-6]。
豆粕作为大豆的副产品,蛋白含量高、氨基酸组成合理,是一种廉价优质的植物性蛋白饲料[7]。但豆粕中含有多种抗营养因子,这些抗营养因子不仅会降低豆粕的利用率,还会影响动物对豆粕营养成分的消化、吸收、代谢,造成动物免疫力下降和生产性能降低等问题[7]。采用益生菌发酵豆粕不仅可以降低豆粕中的抗营养因子还能够提高豆粕中营养成分利用率[8-10]。陈中平[11]采用米曲霉固态发酵豆粕,发酵后豆粕中小肽和氨基酸总量分别提高260.23%和634.62%;吴胜华等[12]利用酵母菌固态发酵豆粕,发酵后豆粕中的胰蛋白酶抑制因子降解率达56.2%;史艳丽等[13]采用枯草芽孢杆菌固态发酵豆粕,结果表明发酵后豆粕中抗原蛋白残留率仅为5.9%。乳酸菌也是一类可作为饲料添加剂的益生菌,目前的报道多集中在采用乳酸杆菌作为发酵菌株,郑裴采用植物乳杆菌固态发酵豆粕(灭菌),结果表明植物乳杆菌能够显著降低豆粕中的脲酶活性,然而关于采用乳酸片球菌强化发酵豆粕的研究还鲜有报道[14-16]。
本实验以实验室前期筛选保藏的益生菌株-戊糖片球菌NCU301作为强化发酵菌株,对未灭菌的豆粕进行接种强化发酵,以乳酸菌总活菌数作为指标,研究发酵时间、发酵温度、料水比、接种量等因素对乳酸菌总活菌数的影响,同时测定豆粕经接种发酵和自然发酵后的营养成分及抗营养因子的变化,旨在确定发酵豆粕的最佳工艺条件,以期为生产实践中豆粕的发酵提供理论支撑和应用依据。
1 材料与方法
1.1 材料与仪器
戊糖片球菌NCU301(PediococcuspentosaceusNCU301) 由南昌大学食品科学与工程国家重点实验室保藏;二级豆粕(含氮量43%) 市售;牛胰蛋白酶 美国Amresco公司;盐酸、氢氧化钠、二甲基亚砜、CaCl2、尿素、磷酸氢二钠、磷酸氢二钾、K2SO4,NaCl,CuSO4、H2SO4、硼酸等 均为分析纯;MRS液体培养基;MRS固体培养基按照文献[17]中的方法配制。
Airtech生物安全柜 苏净集团安泰公司;DNP-9272型生化培养箱 上海精宏实验设备有限公司;ME204E电子天平 梅特勒-托利多仪器(上海)有限公司;DHG-9246A电热恒温鼓风干燥箱 上海精宏实验设备有限公司;K9840型自动凯氏定氮仪 济南海能仪器股份有限公司;S433D-全自动氨基酸分析仪 赛卡姆科学仪器有限公司。
1.2 实验方法
1.2.1 自然发酵工艺 称取未灭菌的豆粕50 g,加入50 mL去离子水,搅拌混匀,置于30 ℃恒温培养箱固态发酵50 h。
1.2.2 菌种活化及发酵 将保藏在甘油管的菌种以2%的接种量种接入MRS液体培养基,37 ℃恒温培养24 h,活化两次。将活化好的菌种按10%的接种量接种到一定料水比的50 g豆粕基础培养基中,在37℃下发酵48 h,发酵结束后测定乳酸菌总活菌量。
1.2.3 单因素实验
1.2.3.1 发酵时间 以50 g豆粕作为基础培养基,料水比1∶1,接种量10%(8.60~8.69 lg(CFU/g)),培养温度37 ℃,分别发酵24、36、48、60、72 h。
1.2.3.2 发酵温度 以50 g豆粕作为基础培养基,料水比1∶1,接种量10%,分别在27、32、37、42、47 ℃下恒温发酵48 h。
1.2.3.3 料水比 以50 g豆粕作为基础培养基,接种量10%,培养温度37 ℃,分别设定1∶0.4、1∶0.6、1∶0.8、1∶1、1∶1.2的料水比发酵48 h。
1.2.3.4 接种量 以50 g豆粕作为基础培养基,料水比1∶1,培养温度37 ℃,分别以4%、6%、8%、10%、12%的接种量进行发酵48 h。
1.2.4 响应面实验 根据单因素实验结果,选取对乳酸菌总活菌量影响较大因素,以乳酸菌总活菌量为响应值,应用design-expert8.0.6的Box-Behnken设计3因素3水平的实验方案。以确定各因素对发酵豆粕中乳酸菌总活菌量影响的显著性和发酵条件的最优组合,实验设计的因子编码及各自变量水平见表1。
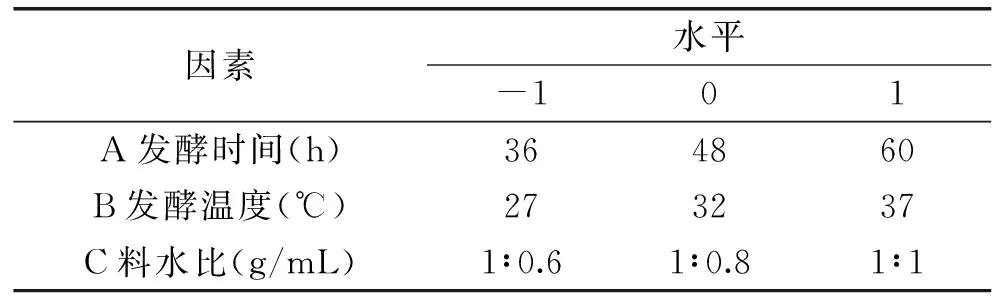
表1 响应面因素水平及编码Table 1 Codes and levels of response surface
1.2.5 测定乳酸菌活菌量 乳酸菌活菌数测定:称取1 g样品溶于9 mL无菌生理盐水中,振荡混匀,梯度稀释至适当的倍数,涂布于MRS固体培养基上,37 ℃恒温培养24 h,计数。
1.2.6 营养成分及抗营养因子检测 粗蛋白含量测定:采用国标《GB/T6432-1994》[18];酸溶性蛋白含量测定:采用国标《GB/T22492-2008》[19];游离氨基酸含量测定:参照李琪等方法[20];脲酶含量测定:参照陈雷方法[21];胰蛋白酶抑制因子含量测定:参照李文立等方法[22];小肽含量=酸溶性蛋白含量-游离氨基酸含量。
1.3 统计分析
数据分析采用IBM SPSS Statistics 23.0;作图软件应用Origin 8.6;响应面优化设计及分析应用Design-Expert 8.0.6。
2 结果与分析
2.1 单因素实验结果
2.1.1 发酵时间对乳酸菌总活菌量的影响 如图1所示,在接种NCU301固态强化发酵豆粕中,随着发酵时间的变化,乳酸菌总活菌数一直保持在9.54 lg(CFU/g)以上,在发酵48 h时达到最大值,为9.84 lg(CFU/g),发酵48 h和60 h的乳酸菌总活菌数无显著性差异(p>0.05),但与其它时间段的活菌数存在显著性差异(p<0.05)。由此选择适宜的发酵时间48 h。
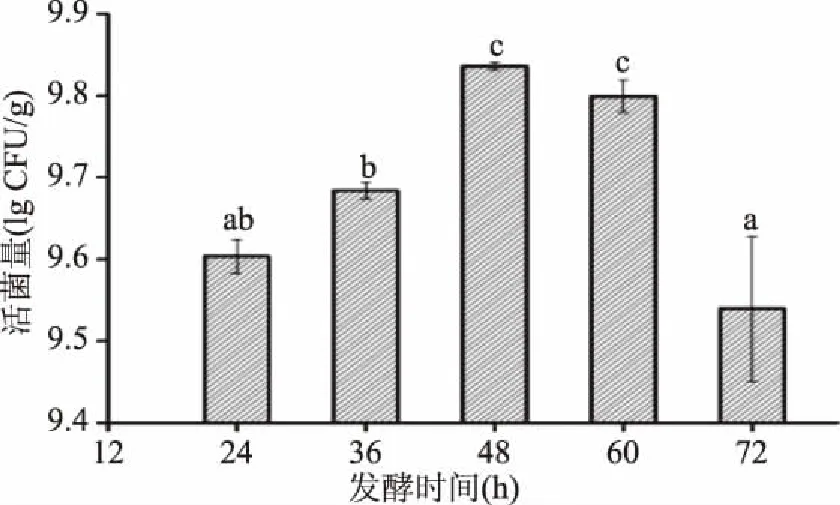
图1 发酵时间对乳酸菌总活菌数的影响Fig.1 Effect of fermentation time on total number of lactobacillus viable cells注:图中不同字母表示差异性显著(p<0.05), 相同字母表示差异性不显著(p>0.05)(图2~图4同)。
2.1.2 发酵温度对乳酸菌总活菌量的影响 微生物的生长对温度较为敏感,所以发酵过程中温度是影响微生物生长和产物合成的重要因素[23]。由图2可知,豆粕发酵过程中乳酸菌总活菌数随着温度的升高呈现先缓慢增加后降低的趋势,这是因为温度升高反应速率加快,微生物的生长代谢也随之加快,但温度过高会降低反应速率,微生物的生长代谢活性也随之降低,不利于发酵的进行[24]。确定适宜的温度为32 ℃。
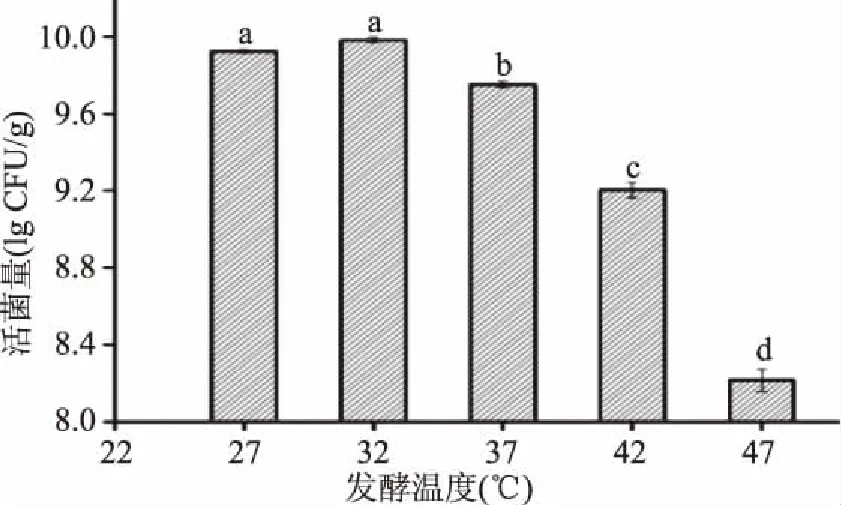
图2 发酵温度对乳酸菌活菌数的影响Fig.2 Effect of fermentation temperture on total number of lactobacillus viable cells
2.1.3 料水比对乳酸菌总活菌量的影响 料水比是影响发酵过程的另一重要因素,水分含量过低,基质过于干燥,不利于微生物对营养物质的吸收和代谢产物的分泌且影响化学反应速率。而含水量过高则会造成基质结块,空气流通不畅,染菌机率增加等不良影响[25]。由图3可知,随着料水比的比例增大,豆粕发酵过程中乳酸菌总活菌数呈现先上升,后缓慢降低的趋势,在料水比1∶0.8的条件下,乳酸菌总活菌量最高,因此适宜的料水比为1∶0.8。
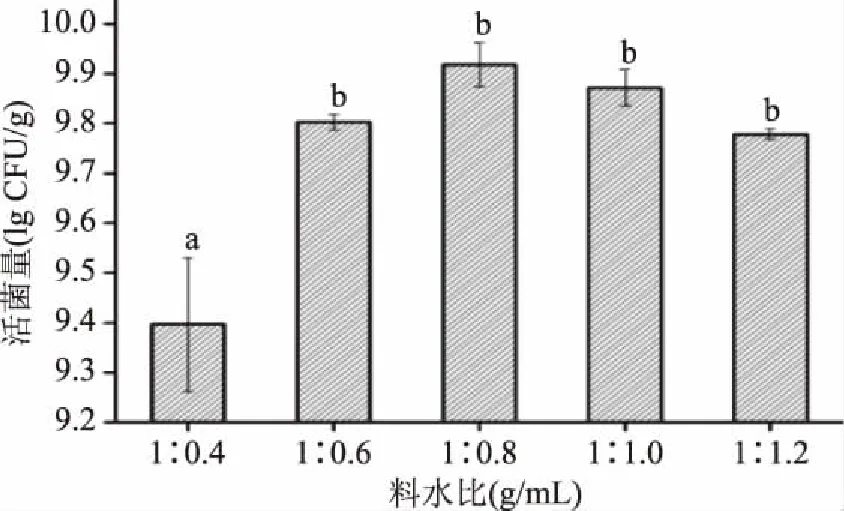
图3 料水比对乳酸菌活菌数的影响Fig.3 Effect of material to water ratio on total number of lactobacillus viable cells
2.1.4 接种量对乳酸菌总活菌量的影响 发酵过程中,接种量过小,会延长微生物生长的迟缓期;接种量过大,发酵基质中的营养物质、水分等不能满足微生物正常生长所需[26]。由图4可知,豆粕发酵过程中接种量对乳酸菌总活菌量无显著性差异(p>0.05),在8%时活菌量最高,因此选择8%作为最适接种量。
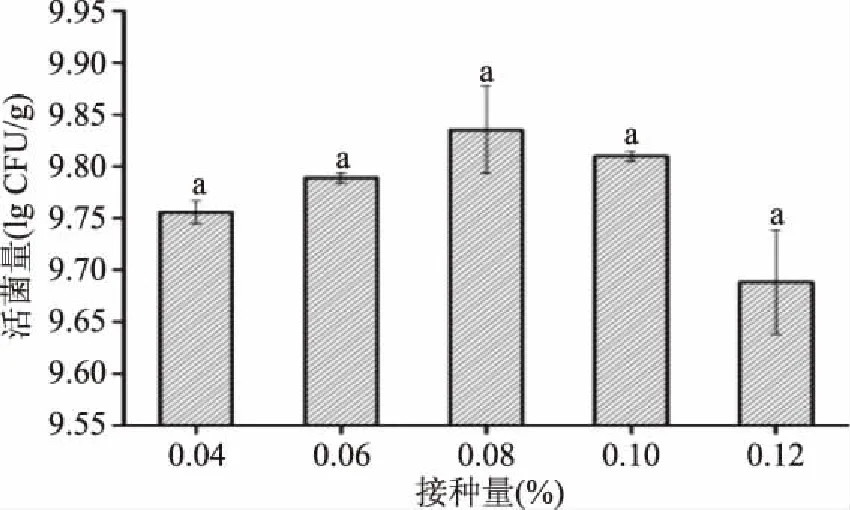
图4 接种量对乳酸菌活菌数的影响Fig.4 Effect of inoculation on total number of lactobacillus viable cells
2.2 响应面优化结果
在单因素实验基础上,以发酵时间、发酵温度、料水比为自变量,以发酵结束后豆粕中乳酸菌总活菌数(Y)为响应值,确定最佳工艺条件,实验设计及结果见表2。
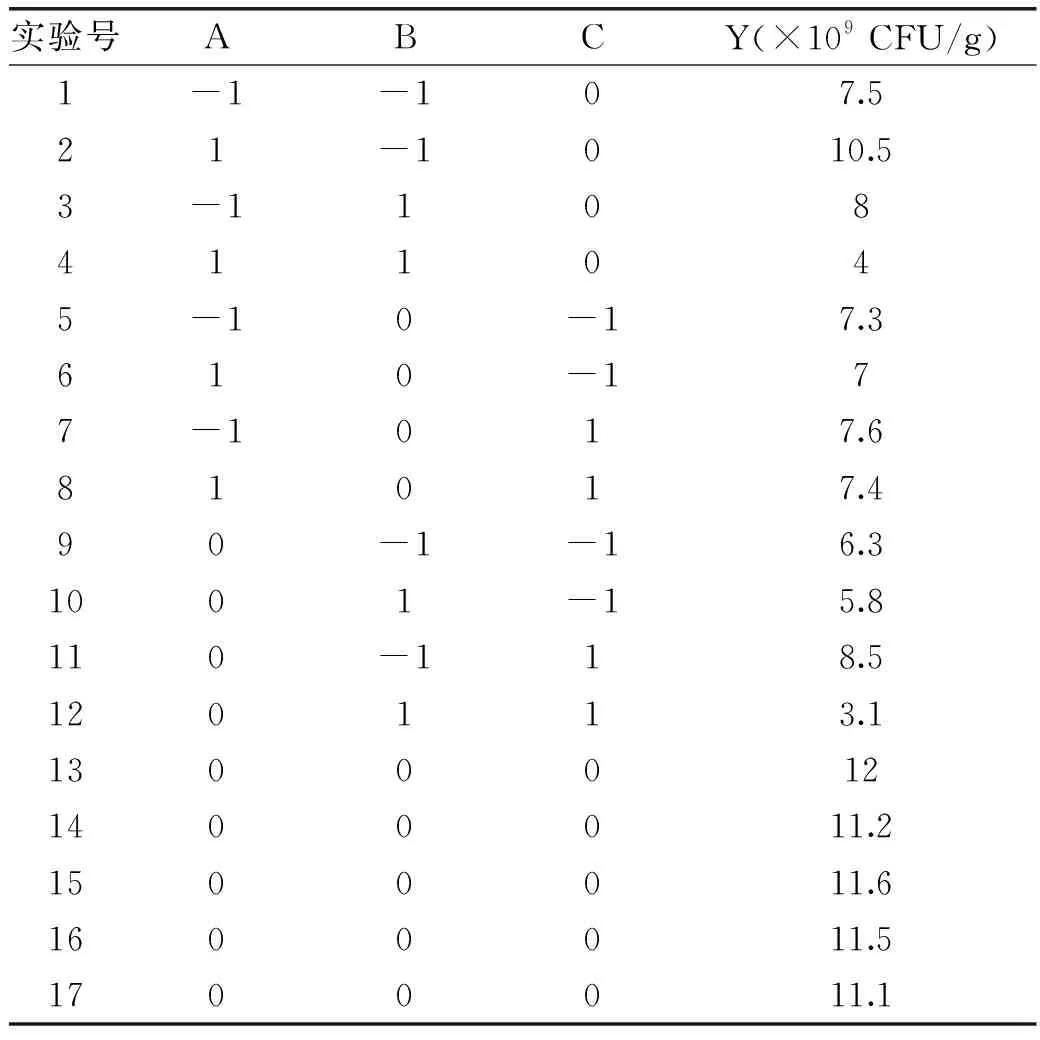
表2 BOX-Behnken实验设计及结果Table 2 Design and results for BOX-Behnken
使用Design-Expert 8.06软件对数据进行分析,建立乳酸菌总活菌数(Y)与发酵时间(A)、发酵温度(B)、料水比(C)关系的二次多元回归模型:
Y=11.48-0.19A-1.49B+0.025C-1.75AB+0.025AC-1.23BC-1.29A2-2.69B2-2.86C2
回归方差分析见表3,回归模型(p<0.0001)差异极为显著,表明该模型有效;失拟项是用来描述合适模型附近数据的变动,此失拟项的结果为0.6704,差异不显著(p>0.05),表明拟合的模型效果较好;决定系数R2=0.9859,说明此方程的拟合度良好,能够对NCU301固态发酵豆粕的理论值进行预测。
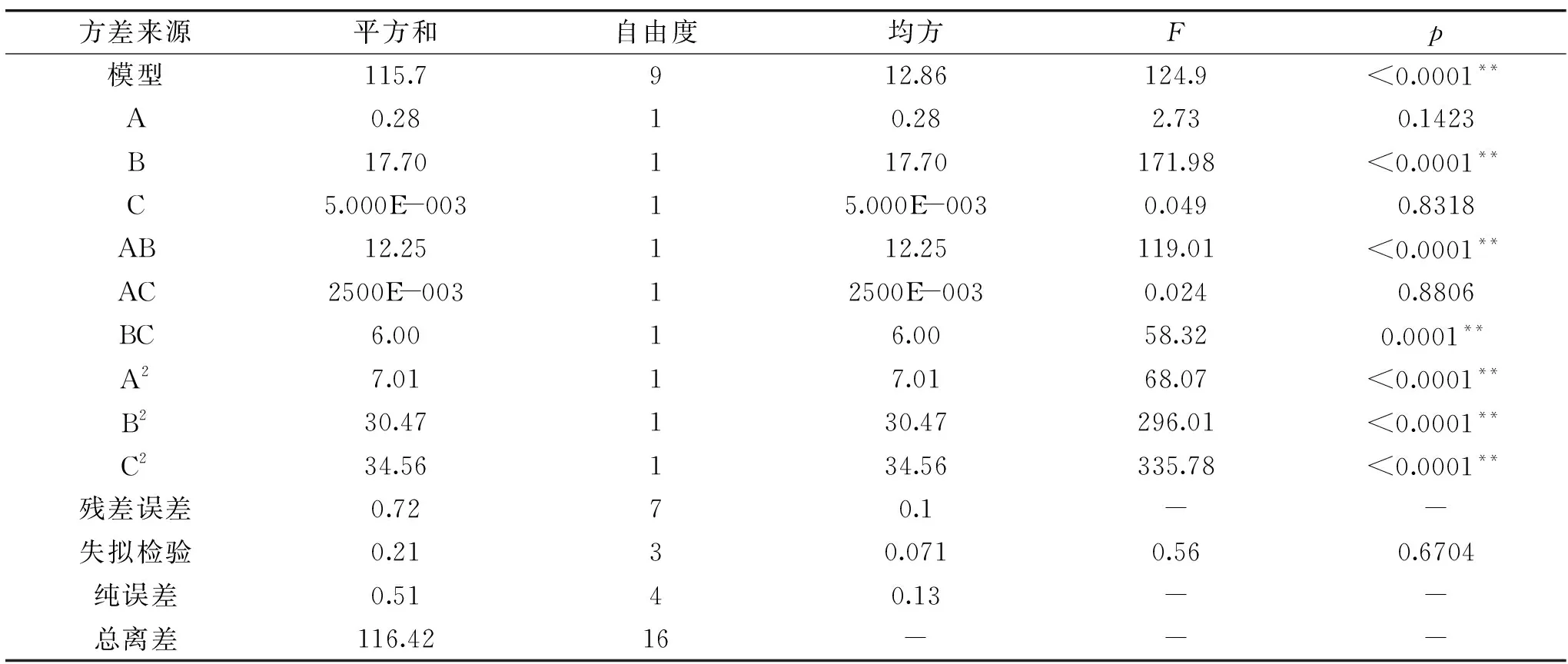
表3 回归模型方差分析Table 3 Analysis of variance for the regression model
根据回归分析和回归拟合方程绘制相应的响应面分析图及对应的等高线图,如图5所示。结果表明,发酵时间和发酵温度及发酵温度和料水比的交互作用对乳酸菌总活菌数的影响显著。通过软件分析得到最佳发酵工艺条件为:发酵时间50.0 h、发酵温度30.0 ℃、料水比1∶0.82,在接种量8%的条件下,预测乳酸菌活菌数达到11.7×109CFU/g。以此条件进行三次实验验证,所得的乳酸菌活菌数为11.5×109CFU/g,与预测值的吻合度达到98.29%。

图5 两两因素相互作用对乳酸菌 活菌数的等高线和响应面图Fig.5 Counter chart and response surface for total number of lactobacillus viable cells under two factors interact
2.3 发酵前后营养成分及抗营养因子的变化
从表4可知,豆粕经过自然发酵和接种强化发酵后的营养成分均发生了变化,其中粗蛋白分别提高了4.13%和4.78%(p<0.05),可能是因为在发酵期间,基质中的养分被微生物消耗而导致粗蛋白所占的相对比例发生变化,同时微生物将基质中的非蛋白氮吸收转化为菌体蛋白[27];由于强化发酵后的豆粕中微生物的总活菌量高于自然发酵豆粕中的微生物总活菌量,所以,豆粕经强化发酵后粗蛋白的含量高于自然发酵。豆粕经过自然发酵和强化发酵后,酸溶性蛋白分别提高了42.67%和36.04%(p<0.05),小肽含量分别显著性的提高57.49%和52.21%(p<0.05),可能是因为发酵期间,微生物分泌的一些酶类物质将大分子蛋白降解为小分子的多肽和氨基酸[28];自然发酵期间豆粕中含有大量能够分泌蛋白酶的霉菌等微生物,而在强化发酵期间,这类微生物的生长受到乳酸菌抑制[29],因此,自然发酵后豆粕中的酸溶性蛋白和小肽含量要高于强化发酵后豆粕中的酸溶性蛋白和小肽含量。游离氨基酸经强化发酵提高19.10%,而经自然发酵下降12.36%,这可能是因为自然发酵中某些微生物利用氨基酸作为氮源[30],以及发酵过程中的美拉德反应和酯化反应消耗了氨基酸[31],而在强化发酵中乳酸菌及其代谢物能够抑制这类微生物的生长繁殖[32]。
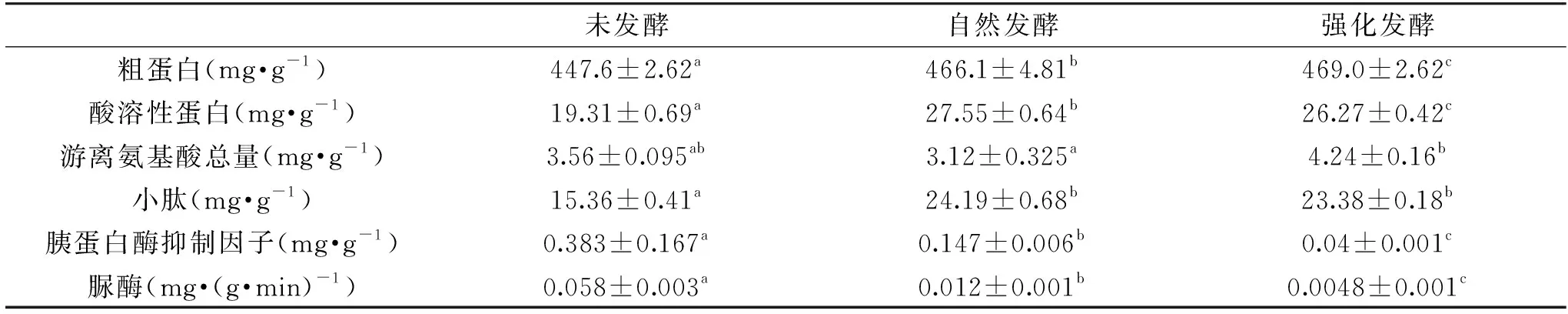
表4 豆粕发酵前后营养成分及抗营养因子的变化Table 4 Changes of nutrients and anti-nutritional factors of fermented soybean and unfermented soybean
豆粕中存在多种会造成畜禽生产性能下降和饲料利用率降低的抗营养因子,而微生物发酵法可有效的降低这些抗营养因子的含量[33]。由表4知,胰蛋白酶抑制因子经自然发酵和强化发酵后分别降低了61.62%和89.56%(p<0.05),脲酶含量也下降了79.31%和91.72%(p<0.05),表明豆粕中胰蛋白酶抑制因子的含量和脲酶含量呈正相关关系,这与尹慧君的研究结果一致[34]。
3 结论
本实验以NCU301作为强化发酵菌株,优化了豆粕固态强化发酵的生产工艺,最终确定最适的发酵条件为:发酵时间50.0 h、发酵温度30.3 ℃、料水比1∶0.82、接种量8%,发酵结束后,豆粕中乳酸菌总活菌量提高至1.15×1010CFU/g。豆粕经接种强化发酵后与未发酵相比,其中粗蛋白、酸溶性蛋白、小肽、游离氨基酸总量与分别提高4.78%、36.04%、52.21%、19.10%,胰蛋白酶抑制剂活性和脲酶活性分别下降89.56%、91.72%,而与自然发酵后豆粕中的粗蛋白、游离氨基酸总量相比分别提高0.6%、35.89%,酸溶性蛋白、小肽,胰蛋白酶抑制剂活性和脲酶活性分别下降4.64%、3.35%、72.79%、60%。该发酵产品可以提高动物对饲料的消化性,增加动物的生产性能,同时富含益生菌等有益成分可以改善动物的胃肠道菌群,提高动物的免疫力,与灭菌的发酵豆粕相比,可以降低生产成本,这为发展现代畜牧业提供了理论基础。
[1]Companyó R,Granados M,Guiteras J,et al. Antibiotics in food:Legislation and validation of analytical methodologies[J]. Analytical & Bioanalytical Chemistry,2009,395(4):877-91.
[2]Mwangi W. Antibiotic residues in food[M]. Lap Lamb Academic Publishing,2013.
[3]黄卫强,张和平. 饲用微生态制剂替代抗生素的研究进展[J]. 中国微生态学杂志,2015,27(4):488-494.
[4]姜洪起,李鹏. 饲用抗生素替代品的研究进展[J]. 饲料研究,2011(2):25-27.
[5]郑德富,李凤兰,陈赫书,等. 活性益生菌饲料添加剂的开发[J]. 中国猪业,2010(8):50-51.
[6]邓耀军. 饲用益生菌的筛选及其菌剂制备技术研究[D].南昌:南昌大学,2015.
[7]翁晓辉,王敏,杜红方,等. 发酵豆粕在动物生产中的应用[J]. 饲料广角,2014(21):12-15.
[8]White C E,Campbell D R,Mcdowell L R. Effects of dry matter content on trypsin inhibitors and urease activity in heat treated soya beans fed to weaned piglets[J]. Animal Feed Science & Technology,2000,87(1):105-115.
[9]付弘赟. 微生物固态发酵豆粕的研究[D]. 合肥:安徽农业大学,2008.
[10]姚琨,李富伟,李兆勇. 发酵豆粕概述[J]. 饲料与畜牧:新饲料,2011(12):32-38.
[11]陈中平. 米曲霉发酵对豆粕营养特性的影响[D]. 成都:四川农业大学,2010.
[12]吴胜华,李吕木,张邦辉,等. 酵母菌单菌固态发酵豆粕的研究[J]. 中国粮油学报,2009,24(7):41-44.
[13]史艳丽,曹新民,马明振,等. 枯草芽孢杆菌固态发酵豆粕产品质量评定[J]. 黑龙江畜牧兽医,2015(14):128-129.
[14]唐翔宇. 益生菌发酵豆粕营养分析及应用[D]. 天津:天津科技大学,2008.
[15]郑裴,吕峰,徐玉霞,等. 植物乳杆菌发酵豆粕及其抗营养因子的研究[J]. 安徽农学通报,2009,15(10):63-64.
[16]药璐. 益生菌发酵乳发酵工艺优化与品质研究[D]. 长春:吉林农业大学,2013.
[17]GB4789.35-2010 食品微生物学检验,乳酸菌检验[S]. 北京:中国标准出版社,2010.
[18]GB/T 6432-1994.中华人民共和国国家标准饲料中粗蛋白质含量的测定法[S].北京:中国标准出版社,1994.
[19]QB/T 2653-2004.中华人民共和国轻工行业标准大豆肽粉[S].北京:中国轻工业出版社,2005.
[20]李琪,李广,张会妮. 柱后衍生法测定兰州百合中氨基酸含量[J]. 中国食物与营养,2013(2):68-71.
[21]陈雷. 北方温度条件下启动豆粕固体发酵技术的研究[D]. 哈尔滨:东北农业大学,2016.
[22]李文立,孙振钧,任慧英. 组合微生物发酵提高豆粕品质的方法与优化工艺研究[J]. 中国粮油学报,2013,28(1):88-92.
[23]Chundakkadu Krishna. Solid-state fermentation systems-an overview[J]. Critical Reviews in Biotechnology,2008,25(2):1-30.
[24]陈茜. 发酵法制备大豆抑菌液的过程优化及分离鉴定[D]. 天津:天津科技大学,2015.
[25]刘国娟,刘大程,卢春芳,等. 复合菌固态发酵培养基及发酵工艺的优化[J]. 动物营养学报,2014,26(4):1019-1027.
[26]刘春晓. 内蒙传统发酵奶油制品中CLA产生菌的筛选及发酵条件优化[D]. 呼和浩特:内蒙古农业大学,2016.
[27]王米,孟新宇,赵枝新,等. 小肽在畜牲业上的应用研究[J]. 江西饲料,2005(2):10-13.
[28]胡瑞,陈艳,王之盛,等. 复合益生菌发酵豆粕生产工艺参数的优化及酶菌联合发酵对豆粕品质的影响[J]. 动物营养学报,2013,25(8):1896-1903.
[29]魏爱彬. 益生乳酸菌L. casei Zhang和L. plantarum 1MAU10120在豆粕中发酵特性的研究[D]. 呼和浩特:内蒙古农业大学,2012.
[30]孙常雁. 自然发酵黄豆酱中主要微生物酶系的形成及作用[D]. 哈尔滨:东北农业大学,2007.
[31]武俊瑞,顾采东,田甜,等. 豆酱自然发酵过程中蛋白质和氨基酸的变化规律[J]. 食品科学,2017,38(8):139-144.
[32]Ni K,Wang F,Zhu B,et al. Effects of lactic acid bacteria and molasses additives on the microbial community and fermentation quality of soybean silage[J]. Bioresource Technology,2017,238:706.
[33]孙喆,赵元,贺承光,等. 大豆主要抗营养因子检测方法的研究进展[J]. 中国石油和化工标准与质量,2012,32(1):23-24.
[34]尹慧君,宋俊梅. 发酵豆粕营养价值变化的研究[J]. 粮食科技与经济,2011,36(3):54-56.
