咖啡果皮可溶性膳食纤维的制备及其表征
2018-07-02胡荣锁张海德周文化朱新儒
李 雄,胡荣锁,张海德,*,周文化,曾 颖,朱新儒,余 垒
(1.海南大学,海南海口 570228; 2.中国热带农业科学院香料饮料研究所,海南万宁 571533; 3.特医食品加工湖南省重点实验室,湖南长沙 410004)
目前,咖啡在云南省的种植面积已达12.2万公顷,年产副产物超过40万吨,其中少量作为肥料,大量堆积废弃。针对上述现象本实验决定采用云南省咖啡的主要品种:云南小粒种咖啡,一般也称阿拉比卡。
国内对咖啡副产物的研究尚停留在较为低级的阶段,多将副产物集中在一起用于农业生产中堆肥等,而国外对咖啡副产物研究有进一步的细分,包括咖啡果皮、咖啡银皮、咖啡渣[1]等,用途丰富。胡荣锁等利用响应面法优化了咖啡果皮可溶性膳食纤维(SDF,Soluble dietary fiber)的提取工艺,同时缺乏对产品的比较及其结构特性进一步的探究[2]。Usha[3]利用葡糖醋杆菌在咖啡果皮中提取到比天然纤维素具有更高结晶度的细菌纤维素。Pourfarzad在咖啡银皮研究中,其水溶性膳食纤维含量达到总膳食纤维的86%,并将其应用到焙烤食品中[4]。咖啡渣的用途更广泛,包括改善土壤条件、作为工业锅炉的燃料、用作动物饲料、生产生物柴油[5]等等。
本研究利用四种预处理方法,分别是:超声波、微波、湿磨和高压爆破来结合纤维素酶提取咖啡果皮(CP,coffee peel)中的膳食纤维,比较探讨不同的预处理方法对SDF的功能特性和结构的影响,以针对性获得各SDF产品适合的实际应用的领域,旨在为咖啡果皮高品质SDF的产业化开发应用提供参考。
1 材料与方法
1.1 材料与仪器
云南小粒种咖啡果皮 由云南农业大学热带作物学院协助收集;果胶酶(酶活力≥3×104U/g)、胰酶(酶活力为USP级)、溴化钾(光谱级) 美国阿拉丁公司;纤维素酶(酶活力≥10×104U/g) 郑州明瑞化工产品有限公司;三氟乙酸、无水吡啶 均为色谱纯;盐酸、三氯甲烷、氢氧化钠、氯化羟胺、乙酸酐 均为分析纯。
AL104分析天平、FE20实验室pH计、梅特勒DSC 1 梅特勒-托利多国际贸易(上海)有限公司;电子恒温不锈钢水浴锅 上海宜昌仪器纱筛厂;步琪R-215旋转蒸发仪 瑞士步琪实验设备公司;CW-2000超声-微波协同萃取仪 新拓微波溶剂测试技术有限公司;IKA magic LAB乳化分散机 IKA集团;HOP-L7湿法超细粉碎机 无锡赫普轻工设备技术有限公司;I WAVE精密色差仪 深圳市威福光电科技有限公司;Nicolet 6700傅立叶红外光谱 美国赛默飞世尔科技有限公司;Agilent 7890A气相色谱仪 美国安捷伦科技公司;MCR302流变仪 奥地利安东帕(中国)有限公司。
1.2 实验方法
1.2.1 咖啡果皮中SDF的制备
1.2.1.1 CP的前处理 收集经过湿法加工[6]后的CP,采用日晒法,将其水分含量降至10%以下,趁热放入干燥器。提取前,将水分烘干至水分含量为5%左右,使用中药粉碎机来粉碎,过40目筛,备用。
1.2.1.2 SDF的酶法提取 参考文献[7],a.纤维素酶提取SDF(C-SDF):咖啡果皮经过果胶酶除果胶和胰酶处理后,调节pH5.5,添加6%的纤维素酶,在50 ℃下反应2 h,沸水浴10 min灭活,过滤,滤液恒温55 ℃减压浓缩至原液体积的1/6,定容至100 mL,4倍体积无水乙醇静置沉淀2 h,抽滤得到SDF,70 ℃恒温烘干,得干燥产品。
b.超声波辅助酶法提取SDF(UC-SDF):咖啡果皮经过果胶酶除果胶和胰酶处理后,超声波协助处理25 min,功率300 W,后续处理同C-SDF,得干燥产品。
c.微波辅助酶法提取SDF(MC-SDF):咖啡果皮经过果胶酶除果胶和胰酶处理后,微波协助处理15 min,功率100 W,后续处理同C-SDF,得干燥产品。
d.胶体磨辅助酶法提取SDF(WC-SDF):咖啡果皮经过果胶酶除果胶和胰酶处理后,皮渣液在胶体磨中循环15 min,后续处理同C-SDF,得干燥产品。
e.高压爆破辅助酶法提取SDF(HC-SDF):咖啡果皮经过果胶酶除果胶和胰酶处理后,皮渣液在胶体磨中循环10 min,在25 MPa压力下用均质机处理5次,后续处理同C-SDF,得干燥产品。
1.2.2 产品得率的测定 将C-SDF及四种预处理手段协助得到的UC-SDF、MC-SDF、WC-SDF、HC-SDF收集,设定鼓风干燥箱为60 ℃,时间2 h,称重。

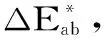
1.2.4 咖啡果皮SDF的物理特性
1.2.4.1 持水力参考Esposito等[8]的方法,称取1.0 g样品于50 mL的离心管中,加入20 mL的去离子水,室温下,用磁力搅拌器搅打40 min,3000 r/min离心15 min,弃去上清液并用滤纸吸干管壁,称重。
持水力(g/g)=样品湿质量(g)-样品干质量(g)/样品干质量(g)
1.2.4.2 对脂肪吸附能力 参照Caprez等[9]的方法。取0.2 g产品置于40 mL大豆油中,室温静置12 h,2000 r/min离心15 min,去除上清液,称取吸油后的质量。
对脂肪吸附能力(g/g)=样品湿质量(g)-样品干质量(g)/样品干质量(g)
1.2.4.3 溶胀性 参照Sowbhagya等[10]的方法,取0.5 g产品置于20 mL去离子水中,室温静置24 h,记录SDF吸水前后的体积。
溶胀性(mL/g)=吸水后的体积(mL)-吸水前的体积(mL)/样品干质量(g)
1.2.5 咖啡果皮SDF的表征
1.2.5.1 傅里叶变换红外光谱(FTIR,fourier transfer infrared spectrum)分析 参照李安平等[11]的方法,取干燥SDF样品各2 mg分别与干燥200 mg KBr混合研磨至均匀细粉状,使用油压机以10 MPa的压力进行压片1 min,得到均匀透明薄片,放入夹具槽位,傅里叶变换红外光谱扫描范围4000~400 cm-1,扫描次数为32,分辨率为4 cm-1,观察样品官能团的特征吸收峰。
1.2.5.2 单糖组成 分析前处理方法参考黄鹏等[12]方法,利用气相色谱-质谱(GC-MS,gas chromatograph-mass spectrum)测定SDF中单糖的种类,称取50 mg干燥后的SDF样品于试管中,加入2 mol/L三氟乙酸(TFA)2 mL封管,置于110 ℃烘箱中水解2 h,冷却至室温,滤去残渣,并用少量去离子水冲洗2遍,合并上述滤液,减压干燥,通过减压蒸发除去残存的TFA。
乙酰化:取上述干燥后的样品,加入10 mg盐酸羟胺及1 mL无水吡啶,振荡待其充分溶解后,封口,于90 ℃水浴反应30 min,冷却至室温,加入1 mL无水醋酸酐,于90 ℃水浴反应30 min,冷却后加入1 mL去离子水搅拌,用2 mL三氯甲烷分别萃取3次,合并萃取液,加足量无水硫酸钠除尽水分,吸取1 mL下层三氯甲烷液体,即可进行气相色谱测定,条件如下:
GC-MS测试方法:DB-5MS色谱柱(30 m×250 μm×0.25 μm),升温程序:起始温度50 ℃,保持3 min,以10 ℃/min上升到150 ℃保持3 min,再以4 ℃/min上升至220 ℃保持3 min,最后以10 ℃/min上升至280 ℃。进样量1 μL,不分流。
质谱条件:离子源温度230 ℃,扫描质量范围25~300 u。
采集到的总离子流图与NIST标准谱库对照,对组分定性,仅报道保留指数与参考保留指数误差小的鉴定结果,并用峰面积归一化法计算各单糖的相对含量[13]。
1.2.5.3 热稳定性分析 利用差示扫描量热仪(DSC,differential scanning calorimeter)对各产品进行分析。参考纪绪前[14]的方法适当调整,方法如下:物料经过干燥及粉碎过筛。称取8 mg样品置于40 μL标准铝坩埚中,然后经过压样机压盖密封。将压好盖的坩埚移入仪器样品槽,准备检测。温度从25 ℃升至400 ℃,升温速率为15 ℃/min,分析热变化规律。
1.2.5.4 流变学性质的研究 采用高精度流变仪Φ60 mm不锈钢平行板测量系统,分别取0.2 g SDF g充分溶解于10 mL水,制成20 mg/mL的混合溶液,完全溶解后,溶液在4 ℃下平衡过夜以允许消除被夹带的空气[15]。每次取样约4 mL于测试板,选择稳态剪切模式,测定溶液粘度及剪切应力随剪切速率的变化。测试方法:取点时间按对数规律变化,起始值10 s,最终值1 s;剪切速率按对数规律变化,起始值1 s-1,最终值100 s-1。测试前,设定平板系统温度为25 ℃,稳定5 min开始检测。
2 结果与分析
2.1 SDF得率的测定结果
由图1可知,空化、加热、剪切、高压等这些预处理效应使得SDF得率均显著高于对照组(p<0.05),其中得率最高的胶体磨协同酶法是14.65%,与常规酶法7.98%相比,增加了83.58%。空化、剪切作用能破坏植物细胞,降低植物组织中各成分之间结合紧密程度,同时使待提取物更快渗透到提取液中,提高提取效率[16-17]。高压使膳食纤维的结构变的更加疏散,利于不溶性纤维转化为可溶性物质[18],而微波能短时间内使物料内外同时进行加热,促进物质中分子的运动而提高膳食纤维含量[19]。

图1 不同预处理方法对SDF得率的影响Fig.1 Effects of different pretreatment methods on SDF yield注:C-SDF:对照组,UC-SDF:超声波预处理组, MC-SDF:微波预处理组,WC-SDF:湿磨预处理组, HC-SDF:高压爆破预处理组,图2~图5 及图7~图8同,表1、表3、表4同。 图中不同小写字母表示各组差异显著(p<0.05), 相同小写字母表示组间差异不显著(p>0.05),图2~图4同。
2.2 SDF色差值的测定结果
四种预处理手段结合酶法及酶法制备的SDF的颜色值的测定结果如表1所示。

表1 不同预处理方法对SDF色差值的影响Table 1 Effects of different pretreatment methods on SDF color difference
由表1,样品整体亮度适中,颜色红棕,适度偏黄,各颜色值之间存在显著差异(p<0.05),其中微波预处理的SDF产品的总色差值最大,湿磨预处理制得的产品与常规酶解工艺产品总色差最小,可能是湿磨对细胞结构破坏程度不深,色素类物质含量积累较少。另外,超声预处理和微波预处理制得的产品无论在明度差异、红/绿差异、黄/蓝差异上均与对照组有显著差异性(p<0.05),可能短时热效应对产品色素的积累具有推动作用。
2.3 咖啡果皮SDF的物理特性测定结果
2.3.1 持水力 由图2可知,超声,微波预处理使得膳食纤维的持水力有一定提高,来源于其对物料细胞壁破坏并产生强烈的加速度,进一步释放和增加SDF的含量,而可溶性膳食纤维具有大量的亲水基团因而表现出较好的亲水性[20],持水能力强。湿磨预处理得到的膳食纤维持水力最强,为10.37 g/g,与对照7.34 g/g相比提高了41.28%,推测其对膳食纤维的网状结构破坏较小[21],而高压爆破获得的产品并没有王晓梅等[22]利用高压均质技术得到的产品持水力那么好,推测可能是高压、高温、乳化作用对膳食纤维的网状结构产生了一定的破坏,导致持水力下降[23]。

图2 不同预处理方法对SDF持水力的影响Fig.2 Effects of different pretreatment methods on water holding capacity of SDF
2.3.2 对脂肪吸附能力 从图3可知,各种方式使持油性都有不同程度的降低。相比较而言,湿磨方式对膳食纤维的持油性影响最大,推测其SDF较多的亲水基团影响其对油的吸附。高压爆破破坏了膳食纤维的网状结构,使脂肪在物料中的保留时间缩短[24],结合脂肪能力降低,但是降低的程度和其他实验组相比是最低的。至于微波和超声则对结构破坏严重,吸油能力衰减较大。

图3 不同预处理方法对SDF吸油能力的影响Fig.3 Effects of different pretreatment methods on the oil absorption capacity of SDF
2.3.3 溶胀性 由图4,高压爆破处理使得产品溶胀性显著提高,达9.52 mL/g。而其他处理对溶胀性有一定提升,但差异显著(p<0.05)。高压爆破之所以对于膨胀力的提高具有显著影响(p<0.05),是因为在均质机循环中高压能促进膳食纤维的微粒化,使物料的紧密组织变得松散,产生更多的毛细孔,利于水分渗入,提高物料的膨胀力[21]。

图4 不同预处理方法对SDF溶胀能力的影响Fig.4 Effects of different pretreatment methods on swelling capacity of SDF
2.4 傅里叶红外光谱分析结果
由图5可知,各样品的红外图谱几乎完全一致,咖啡果皮可溶性膳食纤维具有多糖的特征吸收峰。3200~3600 cm-1处出现的宽展圆滑的吸收峰是O-H的伸缩振动,说明SDF中有较多羟基以及结合水分子[25]。2930 cm-1处为糖类甲基和亚甲基的C-H伸缩振动峰,1407 cm-1处附近是C-H变角振动峰,这些都为糖类的特征峰[26]。1650 cm-1处的吸收峰是羰基的吸收峰,说明咖啡果皮可溶性膳食纤维中存在糖醛酸[27],1538 cm-1处吸收峰是由C=C键骨架振动引起的[28],1000~1200 cm-1是糖类C-O的收缩振动,其中1068 cm-1是C-O-C环内醚中C-O伸缩振动和C-O-H的O-H的变角振动,是多糖的另一特征吸收峰[29],617 cm-1是糖分子中β-型的C-H直立键的变角振动吸收[30]。峰的数量、位置、峰形均没有发生显著变化,说明5种SDF的主要成分及总体化学结构没有发生明显改变。

图5 咖啡果皮SDF傅里叶红外光谱Fig.5 Infrared spectra of soluble dietary fibers from coffee peel
2.5 SDF单糖组成分析
由图6、表2、表3可以看出,咖啡果皮SDF主要由鼠李糖、阿拉伯糖、塔罗糖、甘露糖、半乳糖5种单糖来组成,其余还有少量赤藓糖、岩藻糖和葡萄糖。其中赤藓糖是四碳糖,阿拉伯糖是五碳糖,占比较小,其他部分均为六碳糖,这些六碳糖占比超过总体的80%,在各实验组和对照组中,除了HC-SDF,塔罗糖占比最高,均超过30%,其次是甘露糖,而在HC-SDF中刚好相反,甘露糖比塔罗糖占比稍多,也超过30%。咖啡果皮SDF中葡萄糖和半乳糖含量很小,说明在SDF中可能存在的果胶含量很少,果胶作为一组聚半乳糖醛酸往往会被水解成大量葡萄糖、半乳糖等单糖,且被证实具有明显降胆固醇的作用[31]。
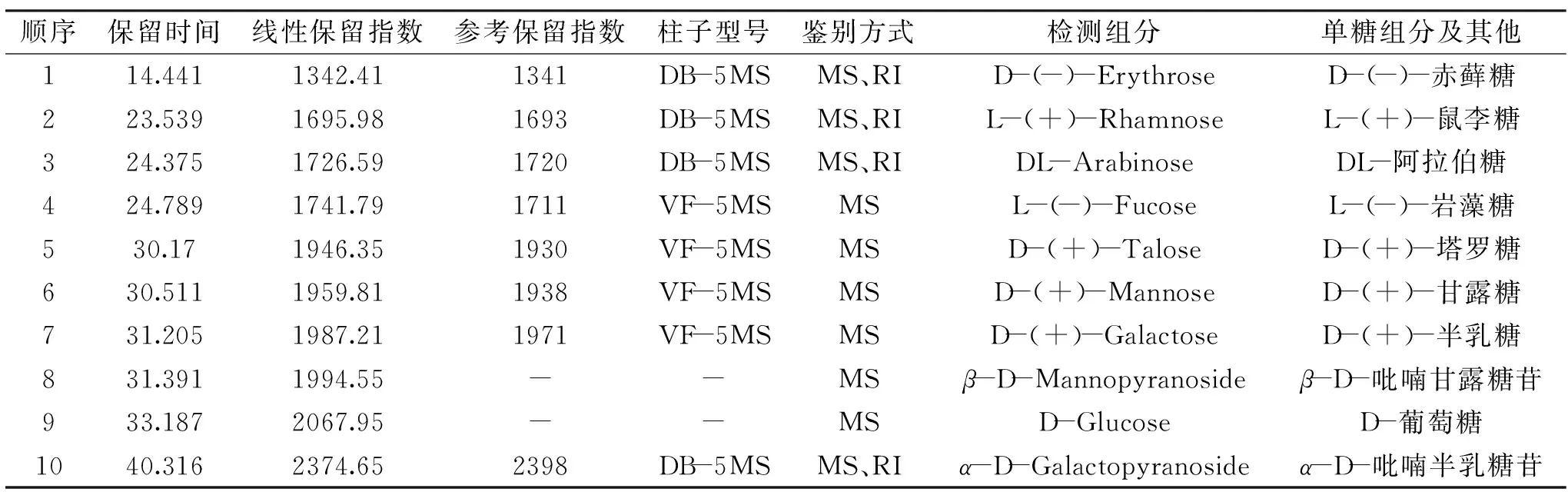
表2 检测组分与保留指数Table 2 Detection of components and retention indices

表3 单糖种类与比例Table 3 Monosaccharide composition of coffee peel SDF

图6 咖啡果皮SDF样品的总离子流色谱图Fig.6 Total ion chromatogram of coffee peel SDF sample
2.6 SDF热稳定性分析结果
由图7与表4可知,经各种预处理手段结合酶提取的SDF与对照组酶法SDF的DSC曲线趋势基本一致。各个SDF产品起始温度、峰值温度基本一致,结束温度HC-SDF与吸收的热量H与其他组有明显差异。初始温度在50~100 ℃表现为产品水分的吸热[32],最高吸收峰均在80 ℃左右,200 ℃后没有出现明显吸放热的变化,说明在200 ℃后产品具有热稳定性,其中C-SDF、UC-SDF、WC-SDF较早进入热稳定状态,其次是MC-SDF,最晚是HC-SDF,这说明高压爆破手段对于提取咖啡果皮SDF产品来说,可能会较明显影响其产品的热稳定性,这对于作为烘焙食品工业的膳食纤维添加剂有重要意义。
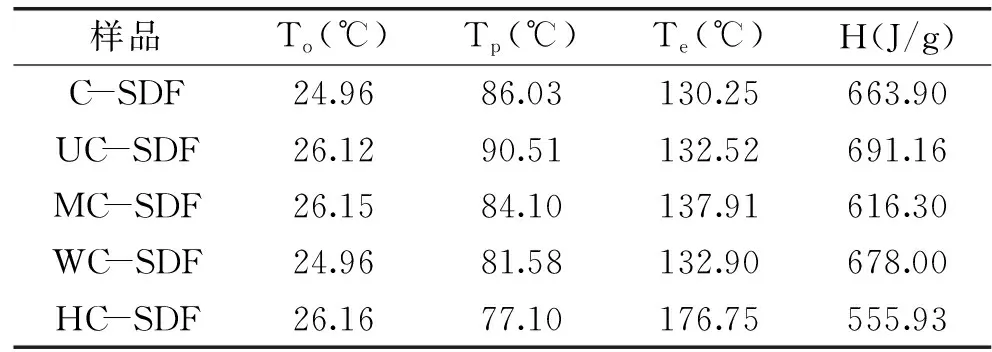
表4 咖啡果皮SDF的热稳定性Table 4 Thermal properties of the coffee peel SDF
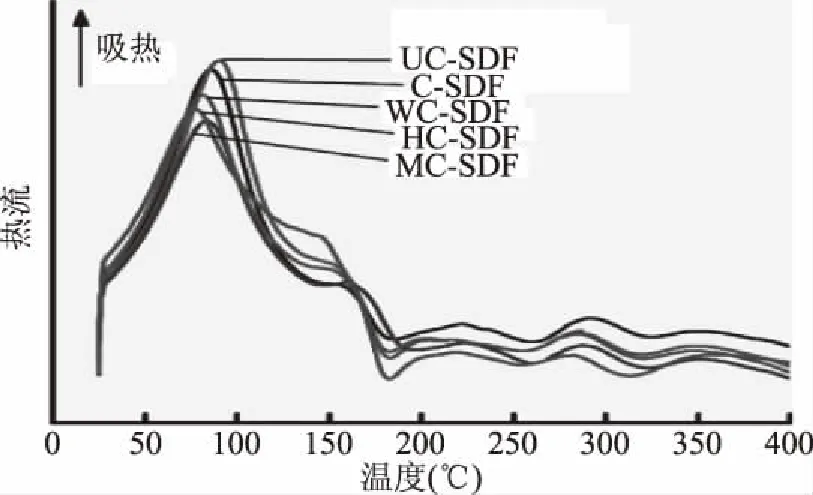
图7 咖啡果皮SDF差式热量扫描曲线Fig.7 Differential scanning calorimetry curves of coffee peel SDF
2.7 SDF产品的流变性研究结果
从图8a中可以看出随着剪切速率的增加,各SDF产品的剪切应力逐渐增强并与剪切速率呈线性关系,说明近似于牛顿流体[33],常规酶解方法和预处理手段结合酶的方法对SDF溶液的流体类型无明显影响。当剪切速率一致时,剪切应力大小:C-SDF>UC-SDF>WC-SDF>HC-SDF>MC-SDF,与此情况相对应的是,黏度大小:C-SDF>UC-SDF>WC-SDF>HC-SDF>MC-SDF。各SDF产品在剪切速率较低的范围内都随着剪切速率的增大粘度减小,有剪切稀化的现象,具有假塑性[33],具有假塑性的流体大多含有高分子的胶体粒子,这些粒子多由巨大的链状分子构成[33]。在静止或低流速时,它们互相钩挂缠结,黏度较大,显得黏稠,但当流速增大时,也就是由于流层之间的剪切应力的作用,使比较散乱的链状粒子滚动旋转而收缩成团,减少了相互钩挂,这就出现剪切稀化现象[33]。综上,不同的预处理手段,对最终SDF产品的流变特性影响程度不一,但反应流变特性的应力与黏度在一定流动速率下都会趋于降低,降低程度为:MC-SDF>HC-SDF>WC-SDF>UC-SDF>C-SDF。

图8 不同提取SDF的流变特性(a)剪切应力 与剪切速率的关系(b)黏度与剪切速率的关系Fig.8 Folw behavior of different SDF(a)shear stress as a function of the shear rate(b)viscosityas a function of shear rate
3 结论
咖啡果皮SDF的提取,不同的预处理手段,包括超声处理、微波处理、湿磨处理、高压爆破处理都能显著提升产品得率,提升程度:WC-SDF>HC-SDF>UC-SDF>MC-SDF>C-SDF。得到的SDF整体亮度适中,颜色红棕,各颜色值存在显著差异(p<0.05)。物理特性方面,WC-SDF组持水力最优,对脂肪吸附能力最差。HC-SDF组溶胀性最好,持水力偏弱,表明高压爆破对其物理特性的影响较显著。结构表征方面,各SDF产品红外图谱几乎一致,都具有多糖的特征吸收峰,主要由鼠李糖、阿拉伯糖、塔罗糖、甘露糖、半乳糖5种单糖组成。高压爆破预处理对SDF热稳定表现影响最明显。各SDF产品在剪切速率较低的范围内随着剪切速率的增大都黏度减小,并且表现出剪切稀化的现象,具有显著的假塑性,同时预处理对SDF产品流变特性的影响很明显,程度为:MC-SDF>HC-SDF>WC-SDF>UC-SDF>C-SDF
[1]Ballesteros L,Teixeira J,Mussatto S. Chemical,functional,and structural roperties of spent coffee grounds and coffee silverskin[J]. Food Bioprocess Technol,2014,7(12):3493-3503.
[2]胡荣锁,周晶,董文江,等. 响应面法优化咖啡果皮可溶性膳食纤维提取工艺和功能特性研究[J]. 热带农业科学,2015,35(9):66-72.
[3]Rani M U,Appaiah K A A. Production of bacterial cellulose byGluconacetobacterhanseniiUAC09 using coffee cherry husk[J]. Journal of Food Science & Technology,2013,50(4):755-762.
[4]Pourfarzad A,Mahdavian-mehr H,Sedaghat N. Coffee silverskin as a source of dietary fiber in bread-making:Optimization of chemical treatment using response surface methodology[J]. Food Science and Technology,2013,50(2):599-606.
[5]Mussatto S I,Machado ES,Martins S,et al. Production,composition and application of coffee and its industrial residues
[J]. Food Bioprocess Technol,2011,4:661-672.
[6]文志华,高玉梅,何红艳,等. 咖啡湿法加工对咖啡品质影响探究[J]. 农村经济与科技,2016,12(27):53-54.
[7]程力,张献梅,顾正彪,等. 纤维素酶法制备马铃薯渣可溶性膳食纤维的理化及功能性质[J]. 食品与发酵工业,2015,41(11):41-46.
[8]Espositof,Arlottib G,Bnifati A M,et al. Antioxidant activity and dietary fiber in durum wheat bran by products[J]. Food Research Inter-national,2005,38:1167-l173.
[9]Caprez A,Arrigoni E,Amadò R,et al. Influence of different types of thermal treatment on the chemical composition and physical properties of Wheat bran[J]. Journal of Cereal Science,1986,4(3):233-239.
[10]HB Sowbhagya,P Florence Suma,S Mahadevamma,et al. Spent residue from cumin-a potential source of dietaryfiber[J]. Food Chemistry,2007,104(3):1220-1225.
[11]李安平,谢碧霞,王俊,等. 竹笋膳食纤维的制备及其功能结构比较[J]. 中国食品学报,2010,10(1):86-92.
[12]黄鹏,刘畅,玉珏,等. 沙棘水溶性膳食纤维的提取及结构分析[J]. 食品科技,2011,36(2):203-211.
[13]宋国彬,张弘,郑华,等. 玛咖可溶性膳食纤维的制备及其表征[J]. 食品科学,2013,34(24):11-18.
[14]纪绪前,陈野,高辰,等. 压差式膨化加工对豆渣可溶性膳食纤维的影响[J]. 天津科技大学学报,2013,28(2):6-10.
[15]Ziqian Feng,Wei Dou,Sierkemideke A,et al. Modified soluble dietary fiber from black bean coats with its rheological and bile acid binding properties[J]. Food Hydrocolloids,2017,62(32):94-101.
[16]岳辉吉,朱杰. 天然色素的超声提取研究[J]. 现代生物医学进展,2006(5):11-13.
[17]吴素萍,王萍. 超声提取长枣红色素及其稳定性研究[J].中国酿造,2008,193(16):53-56.
[18]赵健,郑刚,赵国华. 超高压处理对红薯渣膳食纤维理化性质的影响[J]. 食品科学,2009,30(17):109-112.
[19]刘素稳,郭朔,刘畅,等. 微波辅助提取苹果渣可溶性膳食纤维[J]. 中国食品学报,2010,10(5):152-159.
[20]郑建仙. 功能性膳食纤维[M]. 北京:化学工业出版社,2005:4-9.
[21]何李. 加工处理对膳食纤维理化及发酵特性的影响[D]. 重庆:西南大学,2008.
[22]王晓梅,木泰华,孙红男,等. 3种不同破碎方式提取甘薯膳食纤维的物化功能性质比较研究[J]. 食品科技,2013,38(8):207-212.
[23]祝威. 挤压蒸煮法改善玉米膳食纤维功能特性的研究[D]. 长春:吉林农业大学,2003.
[24]赖爱萍,陆国权. 蒸煮加工对甘薯渣膳食纤维特性的影响[J]. 食品工业科技,2014,35(21):107-114.
[25]涂宗财,段邓乐,王辉,等. 豆渣膳食纤维的结构表征及其抗氧化性研究[J]. 中国粮油学报,2015,30(6):22-26.
[26]项凤影,张莹,路祺,等.水浴和超声法制备菠萝渣可溶性膳食纤维及其性能的表征[J]. 食品工业科技,2014,35(10):150-158.
[27]刘志广,张华,李亚明. 仪器分析[M]. 大连:大连理工大学出版社,2007:273-292.
[28]王大为,李娜,赵鑫. 欧李果汁果渣与果酒果渣膳食纤维的理化性质及结构研究[J]. 食品科学,2016,35(7):11-15.
[29]邵娟娟. 豌豆皮水溶性膳食纤维的制备及性质研究[D]. 无锡:江南大学,2011:20-30.
[30]王庆玲,朱莉,孟春棉,等. 番茄皮渣膳食纤维的理化性质及其结构表征[J]. 现代食品科技,2014,30(11):60-64.
[31]Wikiera A,Irla M,Mika M. Health-promoting properties of pectin[J]. Postepy Higieny i Medycyny Doswiadczalnej,2014,68:590-596.
[32]纪绪前,陈野,高辰,等. 压差式膨化加工对豆渣可溶性膳食纤维的影响[J]. 天津科技大学学报,2013,28(2):06-10.
[33]王磊,袁芳,向俊,等. 椪柑渣可溶性膳食纤维的功能特性及流变性[J]. 中国食品学报,2015,15(3):24-31.
