枸杞硒多糖的合成及对人体肝癌HepG2细胞增殖的体外抑制作用评价
2018-07-02李梅林杜津昊刘建飞邸多隆刘晓风
李梅林,杜津昊,刘建飞,邸多隆,*,刘晓风,*
(1.兰州理工大学生命科学与工程学院,甘肃兰州 730050; 2.中国科学院兰州化学物理研究所,中国科学院西北特色植物资源化学 重点实验室和甘肃省天然药物重点实验室,甘肃兰州 730000)
枸杞子是茄科植物枸杞(LyciumbarbartumL.)的干燥成熟果实,不仅是我国传统的名贵中药材,也是《中华人民共和国食品卫生法(试行)》中第一批被批准为药食同源的物品之一,已有2000多年的食用、药用历史,被历版的《中国药典》所收载。现代药理学表明,枸杞多糖(LBP)是枸杞的主要活性成分,具有免疫调节、抗氧化、抗肿瘤及抗心血管疾病等多种药理作用[1]。尤其是抗肿瘤活性,受到众多学者的广泛关注。
硒是人体必需的微量元素,具有提高机体免疫力、抗衰老、拮抗有害重金属和防止心脑血管疾病[2]等活性,被誉为人体微量元素中的“抗癌之王”。由于无机硒具有蓄积性毒性和致突变作用,使其应用受到了极大的限制。硒多糖作为一种有机硒化合物,使用安全且兼有硒和多糖二者的活性,成为近年来研究的热点。将多糖制备成硒多糖,不仅能够有效的提高硒的生物利用度,降低无机硒的毒性,而且硒与多糖活性结合,能够更好的发挥抗肿瘤作用。目前,已经成功获得了灵芝硒多糖[3]、香菇硒多糖[4]、螺旋藻硒多糖[5]和大蒜硒多糖[6]等,由于硒的引入,显著提高了母体多糖的生物活性。Qiu等[7]合成了9种枸杞硒多糖,并利用L9(34)正交实验法优化了硒化条件,生物活性评价实验表明枸杞硒多糖能够显著提高自由基清除能力,并且明显升高了小鸡血液中GSH-Px和SOD的含量,降低了MDA水平;孙汉文[8]合成了一种枸杞硒多糖,并用MTT法测定了其对人宫颈癌细胞的抑制能力,结果发现与未硒化的相比,枸杞硒多糖能够显著抑制人宫颈癌细胞,且呈浓度依赖性。
枸杞多糖对肝癌细胞具有良好的抑制作用[9-10],我们前期的研究也证实了枸杞多糖能够显著抑制人体肝癌HepG2细胞的生长。硒多糖作为有机硒的重要类型,也表现出较好的抗肿瘤活性。通过以上综述内容的分析,未见枸杞硒多糖抑制肝癌细胞增殖的研究。基于此,本实验采用HNO3-Na2SeO3方法,以高纯度枸杞多糖和亚硒酸钠为原料合成一系列枸杞硒多糖,并用响应面法优化反应条件,MTT法评价枸杞硒多糖对肝癌细胞HepG2的抑制作用。
1 材料与方法
1.1 材料与仪器
枸杞(干燥品) 购于宁夏回族自治区中宁县,经兰州大学药学院马志刚教授鉴定为茄科植物(Solanaceae)枸杞(LyciumburbrumL.)的成熟果实;供试细胞株 人肝癌细胞HepG2为兰大医学院提供;MD34MM(3500 Da)透析袋 北京博奥拓达科技有限公司;硝酸、亚硒酸钠、无水碳酸钠、苯酚、硫酸、盐酸 分析纯,四川西陇化工有限公司;氯化钡 分析纯,天津市光复科技发展有限公司;去离子水 自制。
DF-101S型即热式恒温加热磁力搅拌器 郑州长城科工贸有限公司;手提式多功能粉碎机 上海广沙工贸有限公司;T6型新世纪紫外可见分光光度计 北京普析通用仪器有限公司;SK-2003A型原子荧光光度计 达丰瑞仪器仪表有限公司;Rotavapor R-3型旋转蒸发仪 BUCHI公司;BSA2245-CW型分析天平 北京赛多利斯仪器系统有限公司;HWS26型电热恒温水浴锅 上海-恒科技术有限公司;HD2015W型电动搅拌器 上海司乐仪器有限公司;TGL-15B型离心机 上海安亭科学仪器厂;真空冷冻干燥机 赛飞中国有限公司。
1.2 实验方法
1.2.1 枸杞多糖的制备 将干燥的枸杞果实用粉碎机粉碎后过30目筛,并称取200 g置于5000 mL圆底烧瓶中,加入乙醇200 mL,加热回流1 h,趁热过滤乙醇。残渣加入蒸馏水2000 mL,120 r/min搅拌下,60 ℃提取2 h,趁热过滤,残渣用100 mL热水洗涤,合并滤液和洗涤液,用旋转蒸发仪将枸杞提取液浓缩至500 mL,在均匀搅拌下,缓慢加入95%乙醇使其溶液的最终乙醇浓度为75%,静置6 h。待固液完全分层后,沉淀用400 mL蒸馏水复溶,再次醇沉到乙醇浓度为75%。重复此步骤2次,将得到的沉淀用丙酮洗涤,冷冻干燥即得枸杞粗多糖[11]。
将枸杞粗多糖配成1 g/20 mL的溶液,加入1/3体积Sevage试剂(氯仿∶正丁醇=4∶1),离心后分层,分去有机层,弃去两相交界处蛋白。如此反复,直到分层后两相交界处无蛋白为止。将脱蛋白所得多糖溶液,用浓氨水调节pH,使溶液的pH为8.0~9.0,置于50 ℃水浴中,边搅拌边加入过氧化氢直至溶液的颜色与脱色前相比变浅后,10000 r/min离心5 min,去沉淀[12]。置于3500 Da的透析袋透析2 d,冷冻干燥得到白色絮状固体粉末,即枸杞多糖(LBP,Lyciumbarbarumpolysaccharide)。
1.2.2 枸杞硒多糖的制备 称取制备的LBP 1 g,置于三口烧瓶中,加入1% HNO3溶液200 mL,使LBP充分溶解。分别加入Na2SeO3和BaCl2各1 g,120 r/min搅拌下缓慢升温至所需设定反应温度,继续搅拌反应至设定时间,停止反应。反应结束后冷却至室温,用饱和Na2CO3溶液调节pH至5~6,加入Na2SO3除去Ba2+,10000 r/min离心5 min,取上清液,用3500 Da透析袋自来水透析2 d,蒸馏水透析1 d,浓缩冷冻干燥,得枸杞硒多糖[13-14]。
在硒多糖的制备过程中,主要影响因素是反应时间、反应温度和硒化剂的添加量[15-16]。因此,本实验以硒含量为评价指标,分别选择反应时间、反应温度和Na2SeO3加入量为考察因素,利用响应面法优化最佳工艺条件[17],响应面实验因素水平见表1。

表1 响应面实验因素水平表Table 1 Factors and levels of response surface method
1.2.3 枸杞硒多糖的硒含量测定 精确称取100 mg枸杞硒多糖样品,用HNO3-H2O2法消解,取消解液1.0 mL于25 mL比色管中,依次加入2 mL 4 mol/L盐酸,3 mL 1 mol/L碘化钾,3 mL 2 mol/L乙酸钠,2 mL 1%聚乙烯醇及1 mL 0.04%孔雀绿溶液,定容至刻度,摇匀。放置40 min后,在波长670 nm测定吸光度值,根据硒标准曲线计算样品硒的含量[13]。
1.2.4 枸杞硒多糖的结构表征 称取5 mg枸杞多糖和枸杞硒多糖用KBr压片,进行红外吸收光谱测定,测定范围为400~4000 cm-1[18]。
1.3 MTT实验
根据最大溶解度并参照文献中测定肿瘤细胞抑制率的方法[19],预实验确定枸杞硒多糖Se-LBP1~Se-LBP17最佳抑制HepG2细胞浓度为160 μg/mL。本实验用MTT法检测枸杞硒多糖对人肝癌细胞HepG2体外生长抑制作用。将肿瘤细胞悬液以5×104细胞/每孔接种到96孔板中,待细胞80%融合后,加入160 μg/mL枸杞硒多糖溶液,培养4 h后,每孔加入50 μL MTT溶液。培养4 h后,再加入150 μL的DMSO,振荡10 min,使用酶标仪在570 nm 波长下测定各孔OD值。根据以下公式计算抑制率:

1.4 数据统计分析
采用Excel对数据进行处理和绘图,响应面实验采用Design-Expert V8.0软件进行设计与分析。
2 结果与分析
2.1 响应面设计与结果
按照响应面实验因素所得结果见表2。将所得实验数据采用Design-Expert V8软件进行多元回归拟合,得枸杞硒多糖硒含量对反应时间(A)、反应温度(B)、Na2SeO3加入量(C)的二次多项回归方程:

表2 响应面实验设计及结果Table 2 Results and design of response surface method
Y=636.53+54.47A+15.46B+11.07C+8.20AB-3.46AC-2.69BC-61.35A2-39.01B2-28.35C2
由表3可知,模型F值为60.74,p<0.0001,表明响应面回归模型达到了极显著水平。失拟项p值=0.0532>0.05,表示实验失拟不显著,模型的决定系数R2=0.9874,说明该回归模型能解释98.74%响应值的变化,可以分析和预测此模型对枸杞多糖硒化的优化。由回归模型和方差分析可知,方程一次项A、B,方程二次项A2、B2、C2对枸杞多糖的硒化影响达到极显著水平(p<0.01);方程一次项C对枸杞多糖的硒化的影响达到显著水平(p<0.05),交互项AB、AC、BC对枸杞多糖的硒化的影响不显著(p>0.05)。根据F值可知,各个因素对枸杞多糖的硒化影响的大小顺序为:反应时间(A)>反应温度(B)>Na2SeO3加入量(C)[20]。

表3 回归模型和方差分析Table 3 Regression model and analysis of variance
图1~图3为所得的响应面及其等高线图,响应面图是响应值对各因子A、B、C所构成的三维空间曲面图,从分析图上能比较直观和形象的看出最佳因素参数及各因素之间的交互作用。各因素交互作用对枸杞多糖的硒化影响的大小分别为反应时间(A)>反应温度(B)>Na2SeO3加入量(C)。响应面图均为开口向下的凹形曲面,且相应的等高线图呈明显的椭圆形,说明两因素之间交互作用较显著,若呈圆形说明两因素交互作用不显著。最小椭圆的中心在所选三个因素水平的范围之内,说明响应值(硒含量)在其范围内存在最大值[21]。

图1 反应时间和反应温度对枸杞硒多糖硒含量的等高线和响应面Fig.1 The contour and response surface of reaction time and reaction temperature in selenium-containing Lycium barbarum polysaccharides

图2 反应温度和Na2SeO3加入量量对枸杞硒多糖硒含量的等高线和响应面Fig.2 The contour and response surface of reaction temperature and sodium selenite addition selenium in selenium-containing Lycium barbarum polysaccharides
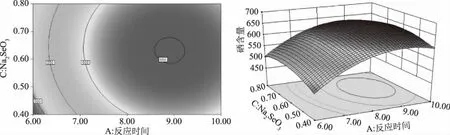
图3 反应时间和Na2SeO3加入量对枸杞硒多糖硒含量的等高线和响应面Fig.3 The contour and response surface of reaction time and sodium selenite addition to selenium in selenium-containing Lycium barbarum polysaccharides
经过Design-Expert软件计算,结果表明:反应时间(A)>反应温度(B)>Na2SeO3加入量(C),理论上分别取8.89 h、74 ℃、0.62 g时,可得理论上的最大硒含量得率为651.46 μg/g。结合实际操作条件修正反应时间A为9 h、反应温度B为74 ℃、Na2SeO3加入量C为0.62 g,做三次平行得实际硒含量为:648.65 μg/g。由此可见真实值与回归方程所预测值相差也不大,表明响应面优化的研究是合理可行的[22]。
2.2 FT-IR结果分析


图4 枸杞多糖及枸杞硒多糖的红外光谱图Fig.4 FT-IR spectra of LBP and Se-LBP
2.3 枸杞硒多糖对人肝癌细胞HepG2的抑制作用
将160 μg/mL的枸杞多糖和枸杞硒多糖作用于HepG2肝癌细胞,作用时间为24 h,结果见图5。由图5可知,枸杞多糖和枸杞硒多糖对HepG2细胞均有一定的抑制作用,其中,枸杞多糖作用24 h后对肿瘤细胞HepG2的抑制率为22%左右,而所有枸杞硒多糖的抑制作用明显高于枸杞多糖,并且Se-LBP4组,即硒含量最高组对肿瘤细胞HepG2的抑制率最明显,抑制率为38.15%,与枸杞多糖组比较,有明显差异性(p<0.05)。同时,和低硒含量组(Se-LBP10)比较,也有统计学意义(p<0.05)。枸杞硒多糖中硒含量的大小顺序与其对HepG2细胞的抑制作用强弱顺序相同,均为:Se-LBP4>Se-LBP7>Se-LBP11>Se-LBP3≥Se-LBP8≥Se-LBP2>Se-LBP12≥Se-LBP16>Se-LBP13>Se-LBP6>Se-LBP1≥Se-LBP15>Se-LBP10,说明枸杞硒多糖抑制HepG2增殖能力与其硒的含量呈正相关。此外,枸杞多糖和枸杞硒多糖对HepG2细胞抑制作用具有可重复性(表4)。
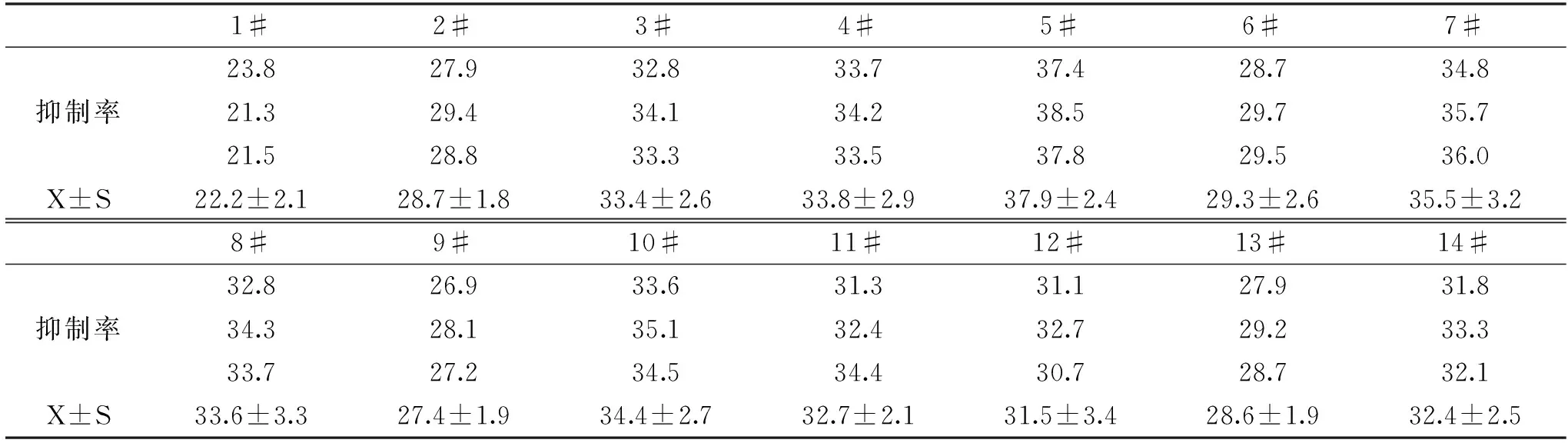
表4 枸杞硒多糖对HepG2细胞抑制作用(%)Table 4 The inhibitory effect of Se-LBP on HepG2 cells(%)

图5 枸杞硒多糖对HepG2细胞增殖抑制作用Fig.5 The proliferation inhibition of different sample No. 1-14 in HepG2 cells
3 结论
人体缺硒会产生很多危害。枸杞多糖有许多药理活性,将枸杞多糖与硒有机结合成的硒多糖不但把无机硒转化成了有机硒,且具有毒性更低、生物利用度更高等特点,其化学结构形成了特殊的硒氧键,使得生物活性普遍高于多糖和硒。本研究以枸杞硒多糖的硒含量为评价指标,利用响应面法分别考察反应时间、反应温度和Na2SeO3加入量对硒含量的影响,结果表明:各因素的影响效果依次为反应时间>反应温度>Na2SeO3加入量。最佳制备条件为:按照LBP为1 g计算,加入0.62 g Na2SeO3,用1%HNO3充分溶解,再加入BaCl21 g,74 ℃反应9 h。在该优化条件下,枸杞硒多糖的硒含量为648.65 μg/g。在此基础上,利用MTT法评价枸杞硒多糖对HepG2人肝癌细胞的抑制作用,结果表明枸杞多糖和枸杞硒多糖对HepG2细胞均有一定的抑制作用,所有枸杞硒多糖的抑制作用明显高于枸杞多糖,并且硒含量最高的Se-LBP4组对肿瘤细胞HepG2的抑制率最明显,抑制率为38.15%,与枸杞多糖组和低硒含量枸杞硒多糖组比较,均有明显差异性(p<0.05)。同时,枸杞硒多糖中硒含量的大小顺序与其对HepG2细胞的抑制作用强弱顺序相同,均为:Se-LBP4>Se-LBP7>Se-LBP11>Se-LBP3≥Se-LBP8≥Se-LBP2>Se-LBP12≥Se-LBP16>Se-LBP13>Se-LBP6>Se-LBP1≥Se-LBP15>Se-LBP10,说明枸杞硒多糖抑制HepG2增殖能力与其硒的含量呈正相关。将无机硒转化为有机硒的同时,也为今后硒化枸杞多糖开发成药物或保健食品奠定了基础。但其硒化多糖抑制肿瘤细胞的作用机制尚不清楚,安全性评价有待进一步研究。
[1]Jin M L,Huang Q S,Zhao Ke,et al. Biological activities and potential health benefit effects of polysaccharides isolated fromLyciumbarbarumL[J]. International Journal of Biological Macromolecules 2013,54(1):16-23.
[2]Mao G H,Ren Yi,Li Qian,et al. Anti-tumor and immunomodulatory activity of selenium(Se)-polysaccharide from Se-enrichedGrifolafrondosa[J]. International Journal of Biological Macromolecules,2016,82:607-613.
[3]Shang D J,Zhang J N,Wen Lei,et al. Preparation,characterization,and antiproliferative activities of the Se-containing polysaccharide SeGLP-2B-1 from Se-enrichedGanodermalucidum[J]. Journal of Agricultural & Food Chemistry,2009,57(17):7737-7742.
[4]Wu Yun,Ding Li,Li S P,et al. The analysis of selenoprotein and Se-polysaccharide in selenium-enrichedLentinanedodes[J].Advanced Materials Research,2012,524-527(1):2325-2329.
[5]尚俊英,谢裕安,陈文彰,等. 螺旋藻硒多糖组分的提纯及其体外抗肿瘤作用[J]. 中国肿瘤生物治疗杂志,2010,17(6):630-633.
[6]刁娟娟,李莉,阳胜,等. 氢化物原子荧光法测定大蒜及其制品中的硒[J]. 食品科学,2009,30(4):166-168.
[7]Qiu S L,Chen Jin,Chen Xi,et al. Optimization of selenylation conditions forLyciumbarbarumpolysaccharide based on antioxidant activity[J]. Carbohydrate Polymers,2014,103(1):148-153.
[8]赵燕燕,许城燕,孙汉文,等. 硒化枸杞多糖硫酸酯的制备及其抗氧化活性对人宫颈癌Hela细胞生长的体外抑制作用[J]. 中国药学杂志,2012,47(6):423-426.
[9]Cui B K,Chen Y F,Liu Su,et al. Antitumour activity ofLyciumchinensispolysaccharides in liver cancer rats[J]. International Journal of Biological Macromolecules,2012,51(3):314-318.
[10]Zhang Min,Tang X L,Wang Fang,et al. Characterization ofLyciumbarbarumpolysaccharide and its effect on human hepatoma cells[J]. International Journal of Biological
Macromolecules,2013,61(10):270-275.
[11]杜津昊,刘建飞,刘晓风,等.高速剪切技术辅助提取枸杞多糖工艺[J]. 食品工业,2017(3):128-132.
[12]易晓敏,周春晖,黄惠华.猴头菇多糖粗提液的壳聚糖法脱蛋白及分离纯化研究[J]. 食品工业科技,2016,37(21):119-123.
[13]Wang J L,Li Q Y,Bao A J,et al. Synthesis of selenium-containingArtemisiasphaerocephalapolysaccharides:Solution conformation and anti-tumor activitiesinvitro[J]. Carbohydrate Polymers,2016,152:70-78.
[14]Hou R R,Chen Jin,Yue C J,et al. Modification of lily polysaccharide by selenylation and the immune-enhancing activity[J]. Carbohydrate Polymers,2016,142:73-81.
[15]Chen W X,Chen J Y,Hu F D,et al. Optimization of selenylation condition for a petic polysaccharide and its structural characteristic[J]. International Journal of Biological Macromolecules,2014,69(8):244-251.
[16]Angelo Antonio D’Archivio,Maria Anna Maggi,Fabrizio Ruggieri. Extraction of curcuminoids by using ethyl lactate and its optimisation by response surface methodology[J]. Journal of Pharmaceutical and Biomedical Analysis,2018,149:89-95.
[17]汪泽,崔丽虹,唐冰,等. 响应面法优化菠萝叶纤维多酚提取工艺[J]. 食品工业科技,2017,38(1):219-223.
[18]Liu Fei,Zhu Z Y,Sun X L,et al. The preparation of three selenium-containingCordycepsmilitarispolysaccharides:Characterization and anti-tumor activities[J]. International Journal of Biological Macromolecules,2017,99:196-204.
[19]Liu J F,Chen S W,Sang C Y,et al. Synthesis and cytotoxic activity on human cancer cells of carbamate derivatives of 4β-(1,2,3-triazol-1-yl)podophyllotoxin[J]. European Journal of Medicinal Chemistry,2014,64:621-628.
[20]Davinder Pal Singh Oberoi,Dalbir Singh Sogi. Utilization of watermelon pulp for lycopene extraction by response surface methodology[J]. Food Chemistry,2017,232:316-321.
[21]刘新,陈卫中,韩琴. 响应面法优化超声波辅助提取芒果核中原花青素的研究[J]. 食品工业科技,2012,33(3):227-231.
[22]吴燕,盛尊来,高凌飞,等. 响应面法优化丁香叶总酚酸提取工艺[J]. 食品工业科技,2015,36(2):286-290.
[23]葛明明,胡北,孙丽娜,等. 硒化蒲公英多糖的制备工艺及硒含量测定的研究[J]. 食品工业科技,2014,35(18):276-280.
[24]武童,汪振炯,华春,等.蛹虫草基质多糖纳米硒复合物的制备研究[J]. 食品工业科技,2017,38(5):49-53,59.
[25]Wei D F,Chen Tong,Yan M F,et al. Synthesis,characterization,antioxidant activity and neuroprotective effects of selenium polysaccharide fromRadixhedysari[J]. Carbohydrate Polymers,2015,125:161-168.
[26]Li Qian,Wang Wei,Zhu Yun,et al. Structural elucidation and antioxidant activity a novel Se-polysaccharide from Se-enrichedGrifolafrondosa[J]. Carbohydrate Polymers 2017,161:42-52.
