糖尿病对于冠心病患者置入生物可降解聚合物涂层药物洗脱支架长期预后的影响
2018-06-30王娟乔树宾管常东胡奉环杨伟宪袁建松郭超段欣高润霖徐波
王娟, 乔树宾, 管常东, 胡奉环, 杨伟宪, 袁建松, 郭超, 段欣, 高润霖, 徐波
近年来,随着人们物质生活水平提升,饮食结构改变,糖尿病发病率逐年升高,且呈现年轻化趋势[1]。糖尿病作为冠状动脉粥样硬化性心脏病(CAD)的主要危险因素被大家广泛接受,糖尿病患者中冠心病的发病率比非糖尿病患者高出 2~4 倍[2,3]。高血糖直接引起血管内皮损伤, 促进管壁炎症反应加剧, 易于动脉粥样硬化的发生和发展[4]。早期研究显示冠心病合并糖尿病患者较对照患者其冠状动脉病变更为弥漫、严重,常累及多支血管,患者经皮冠状动脉介入治疗(PCI)术后更易出现支架内再狭窄和主要不良心血管事件(MACE)[4-6]。故进一步改善冠心病合并糖尿病患者 PCI 术后的预后成为临床热点,随着药物洗脱支架(DES)的出现,尤其是新一代生物涂层可降解支架的问世,糖尿病患者PCI术后长期预后如何仍悬而未定。本研究人群来自前瞻性、多中心、比较BuMA与EXCEL生物可降解聚合物雷帕霉素洗脱支架在“真实世界”中安全性和有效性的前瞻性、多中心、随机对照临床试验(PANDAⅢ) ,旨在探讨是否合并糖尿病对冠心病患者PCI术后长期预后的影响。
1 资料与方法
研究对象:PANDAⅢ临床试验是一项前瞻性、多中心、“全人群”、随机对照研究,对比两种不同药物释放速率和聚合物降解机制的西罗莫斯药物洗脱涂层可降解支架系统在治疗冠心病中的安全性和有效性。研究从2013-12到2014-08共入选了来自46家医学中心的2 348例患者,其中糖尿病(组)患者570例,非糖尿病(组)患者1 778例。所有患者均书面签署知情同意书。
入选标准:本研究选用所有符合PCI适应证的成年受试者。(1)年龄≥18岁;(2)在参考血管直径为2.5~4.0 mm的冠状动脉血管上至少有一个目测直径狭窄≥50%的病变;(3)受试者具有冠心病的临床症状,包括慢性稳定性心绞痛、不稳定性心绞痛或急性冠状动脉综合征;(4)受试者可接受药物支架置入术及后续双联抗血小板抗凝治疗;(5)无冠状动脉旁路移植术(CABG)禁忌证者;(6)同意并签署知情同意书。
排除标准:(1)怀孕或哺乳期或计划1年内怀孕的女性受试者;(2)对研究中可能使用的药物洗脱支架系统或方案要求的伴随药物过敏者(如:雷帕霉素、阿司匹林、氯吡格雷、造影剂等);(3)在当次PCI术后6个月计划外科手术者;(4)受试者有严重的疾病(如癌症、精神疾患),或研究者认为不适合入组的受试者。该项研究获得伦理委员会批准,且所有患者提供书面通知,并签订知情同意书。该研究已在ClinicalTrials登记注册,注册号为NCT02017275。
手术及用药:所有受试者术前均给予双联抗血小板治疗。择期PCI患者术前连续6天给予氯吡格雷75 mg/d和阿司匹林肠溶片100 mg/d 或术前给予氯吡格雷300~600 mg和阿司匹林肠溶片300 mg的负荷剂量,术后氯吡格雷75 mg/d至少服用12个月,同时服用阿司匹林100 mg/d,长期服用;糖蛋白Ⅱb/Ⅲa受体抑制剂的使用则由心脏介入医师据术中血栓负荷而定。所有介入操作均按照正规流程由有丰富经验的临床介入医师完成。所有受试者术后均按照冠心病介入治疗术后的标准进行二级预防干预。
随访及研究终点:所有患者在1、6、9个月及1、2年时通过门诊或电话随访。研究主要终点为靶病变失败(TLF),包括心原性死亡,靶血管心肌梗死和缺血驱动的靶病变血运重建。次要终点包括学术研究联盟(ARC)定义的支架血栓、出血事件和MACE,定义为全因死亡,心肌梗死和所有的血运重建。
统计学方法:应用SAS®9.1.3软件进行统计学分析,基线特征连续变量采用均数±标准差描述,分类变量用百分比描述。两组间比较连续变量采用t检验,分类变量采用卡方检验。计数资料以率表示,两组间比较采用χ2检验。多因素分析用COX回归模型分析。以性别、体重指数(BMI)、高血压、高脂血症、脑血管病史、吸烟史、既往PCI史、靶血管(受试者水平)、靶病变总数、术前SYNTAX评分为匹配变量,将糖尿病组和非糖尿病组进行倾向值匹配分析。Kaplan-Meier 法用以计算生存率,logrank 检验生存率差异有无统计学意义,以P<0.05 为差异有统计学意义。
2 结果
两组患者基线资料比较(表1):PANDAⅢ临床试验共入组2 348例患者,接受PCI治疗平均年龄(61.16±10.58)岁,男性1 658例,占70.6%;其中1 174例置入BUMA支架,1 174例置入EXCEL支架。与非糖尿病组比较,糖尿病组患者的年龄偏高,但差异无统计学意义(P=0.09)。糖尿病组女性所占比例、既往PCI、高血压、高脂血症、脑血管疾病发病率高于非糖尿病组(P<0.05)。
两组患者靶血管病变和术中操作特征(表2):患者的靶血管位置、靶血管病变程度、靶病变总数、病变长度、置入支架总长度在两组间差异均有统计学意义(P均<0.05);糖尿病组术中无复流发生率较非糖尿病组低(P<0.05),但术中血栓、急性闭塞、慢血流方面两组间差异无统计学意义。另外,糖尿病组患者术前SYNTAX评分及术后残余SYNTAX评分均高于非糖尿病组(P<0.05)。糖尿病组患者中弥漫性病变、严重钙化、完全闭塞病变、B2+C病变虽较非糖尿病患者偏高,但差异均无统计学意义(P>0.05)。
两组患者随访2年MACE发生率的比较:随访2年MACE发生率的比较(表3和图1):糖尿病组和非糖尿病组中分别有558例(97.9%)、1 704(95.8%)例的患者完成了2年随访。与非糖尿病组比较,糖尿病组心原性死亡、全因死亡发生率明显升高,差异有统计学意义;糖尿病组TLF事件和MACE发生率虽偏高,但差异无统计学意义(P>0.05)。2年随访中ARC定义的可能支架内血栓糖尿病组高于非糖尿病组差异有统计学意义(P<0.05),而ARC定义的支架内血栓事件在两组间比较差异无统计学意义。两组出血事件比较差异无统计学意义(P=0.97)。
以性别、BMI、高血压、高脂血症、脑血管病史、吸烟史、既往PCI史、靶血管(受试者水平)、靶病变总数、术前SYNTAX评分为调整变量进行倾向值匹配分析后,两组在TLF和MACE上同样无显著差异。糖尿病组全因死亡,尤其是心原性死亡仍明显高于非糖尿病组,且差异有统计学意义(P<0.05)。
表1 两组患者基线资料比较[例(%),±s]
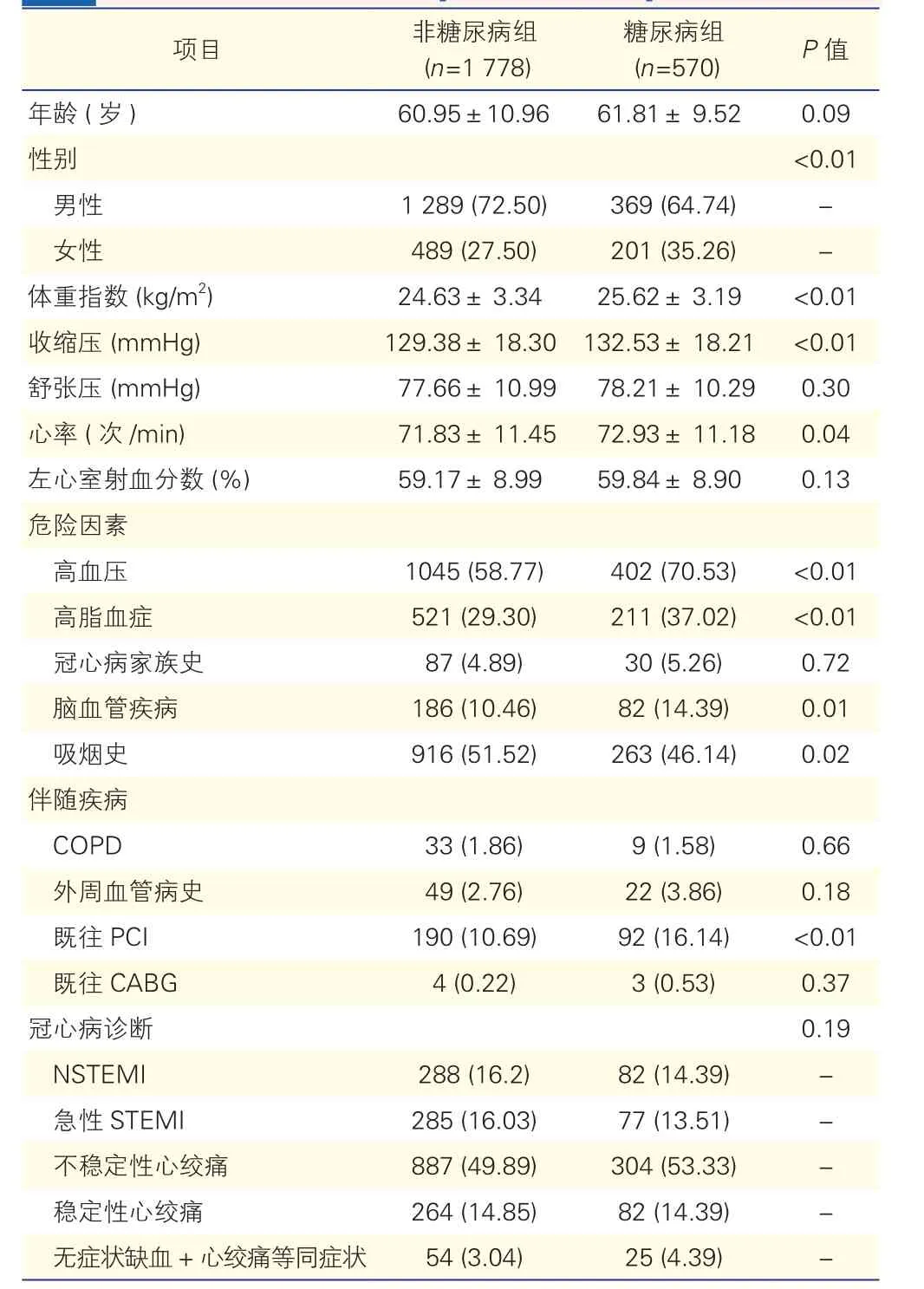
表1 两组患者基线资料比较[例(%),±s]
注:COPD:慢性阻塞性肺疾病;PCI:经皮冠状动脉介入治疗;CABG:冠状动脉旁路移植术; STEMI:ST段抬高型心肌梗死;NSTEMI:非ST段抬高型心肌梗死。-:未做。1 mmHg=0.133 kPa
项目 非糖尿病组(n=1 778)糖尿病组(n=570) P值年龄 (岁 ) 60.95±10.96 61.81± 9.52 0.09性别 <0.01男性 1 289 (72.50) 369 (64.74) -女性 489 (27.50) 201 (35.26) -体重指数 (kg/m2) 24.63± 3.34 25.62± 3.19 <0.01收缩压 (mmHg) 129.38± 18.30 132.53± 18.21 <0.01舒张压 (mmHg) 77.66± 10.99 78.21± 10.29 0.30心率 (次 /min) 71.83± 11.45 72.93± 11.18 0.04左心室射血分数 (%) 59.17± 8.99 59.84± 8.90 0.13危险因素高血压 1045 (58.77) 402 (70.53) <0.01高脂血症 521 (29.30) 211 (37.02) <0.01冠心病家族史 87 (4.89) 30 (5.26) 0.72脑血管疾病 186 (10.46) 82 (14.39) 0.01吸烟史 916 (51.52) 263 (46.14) 0.02伴随疾病COPD 33 (1.86) 9 (1.58) 0.66外周血管病史 49 (2.76) 22 (3.86) 0.18既往 PCI 190 (10.69) 92 (16.14) <0.01既往 CABG 4 (0.22) 3 (0.53) 0.37冠心病诊断 0.19 NSTEMI 288 (16.2) 82 (14.39) -急性 STEMI 285 (16.03) 77 (13.51) -不稳定性心绞痛 887 (49.89) 304 (53.33) -稳定性心绞痛 264 (14.85) 82 (14.39) -无症状缺血+心绞痛等同症状 54 (3.04) 25 (4.39) -
表2 两组患者靶血管病变和术中操作特征[例(%),±s]
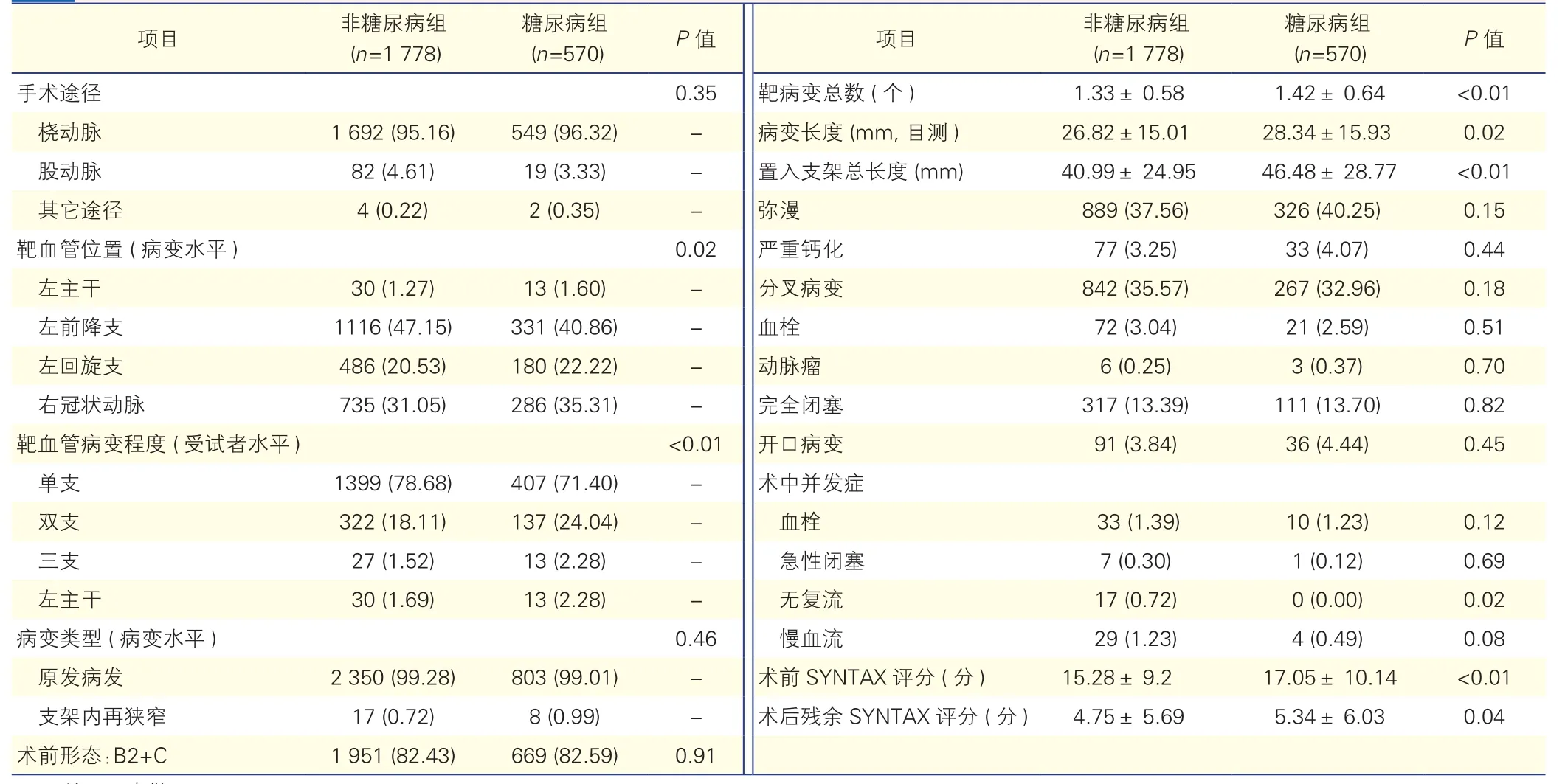
表2 两组患者靶血管病变和术中操作特征[例(%),±s]
注:-:未做
项目 非糖尿病组(n=1 778)糖尿病组(n=570) P值 项目 非糖尿病组(n=1 778)糖尿病组(n=570) P值手术途径 0.35 靶病变总数 (个) 1.33± 0.58 1.42± 0.64 <0.01桡动脉 1 692 (95.16) 549 (96.32) - 病变长度 (mm, 目测 ) 26.82±15.01 28.34±15.93 0.02股动脉 82 (4.61) 19 (3.33) - 置入支架总长度 (mm) 40.99± 24.95 46.48± 28.77 <0.01其它途径 4 (0.22) 2 (0.35) - 弥漫 889 (37.56) 326 (40.25) 0.15靶血管位置 (病变水平) 0.02 严重钙化 77 (3.25) 33 (4.07) 0.44左主干 30 (1.27) 13 (1.60) - 分叉病变 842 (35.57) 267 (32.96) 0.18左前降支 1116 (47.15) 331 (40.86) - 血栓 72 (3.04) 21 (2.59) 0.51左回旋支 486 (20.53) 180 (22.22) - 动脉瘤 6 (0.25) 3 (0.37) 0.70右冠状动脉 735 (31.05) 286 (35.31) - 完全闭塞 317 (13.39) 111 (13.70) 0.82靶血管病变程度 (受试者水平) <0.01 开口病变 91 (3.84) 36 (4.44) 0.45单支 1399 (78.68) 407 (71.40) - 术中并发症双支 322 (18.11) 137 (24.04) - 血栓 33 (1.39) 10 (1.23) 0.12三支 27 (1.52) 13 (2.28) - 急性闭塞 7 (0.30) 1 (0.12) 0.69左主干 30 (1.69) 13 (2.28) - 无复流 17 (0.72) 0 (0.00) 0.02病变类型 (病变水平 ) 0.46 慢血流 29 (1.23) 4 (0.49) 0.08原发病发 2 350 (99.28) 803 (99.01) - 术前 SYNTAX 评分 (分 ) 15.28± 9.2 17.05± 10.14 <0.01支架内再狭窄 17 (0.72) 8 (0.99) - 术后残余 SYNTAX 评分 (分 ) 4.75± 5.69 5.34± 6.03 0.04术前形态:B2+C 1 951 (82.43) 669 (82.59) 0.91
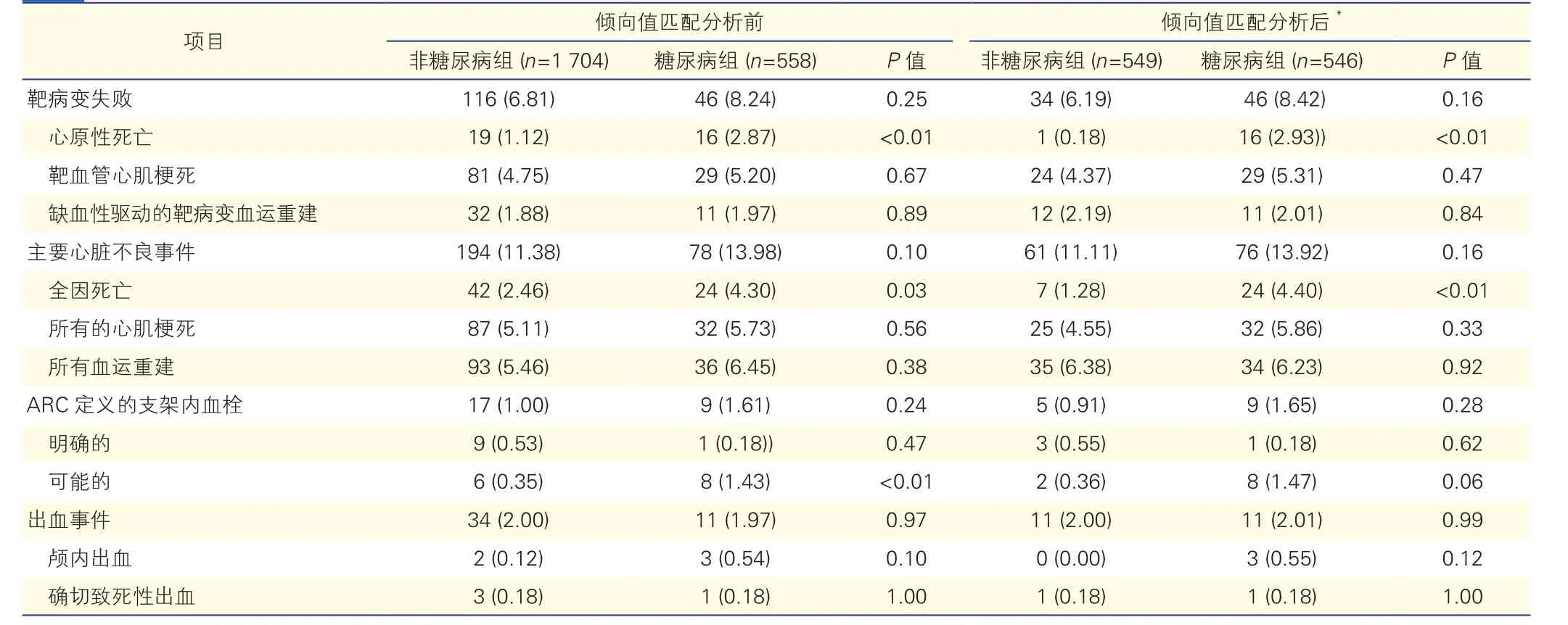
表3 随访2年两组患者靶病变失败、主要心脏不良事件、出血事件等发生率比较[例(%)]
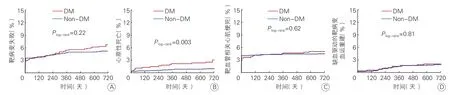
图1 靶病变失败(A)、心原性死亡(B)、靶血管相关心肌梗死(C)及缺血驱动的靶病变血运重建(D)的KM曲线
以2年心原性死亡为终点的多因素分析(表4):对两组患者心原性死亡进行多因素COX分析,将性别、糖尿病病史、既往PCI史、靶病变个数、术前SYNTAX评分纳入多因素COX分析模型中。多因素分析结果显示,糖尿病和术前SYNTAX评分是2年心原性死亡的独立危险因素。
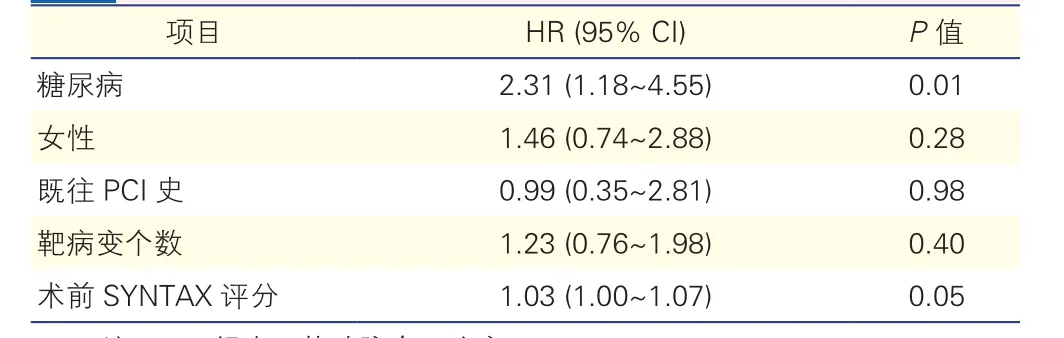
表4 以2年心原性死亡为终点的多因素COX分析
3 讨论
近年来,冠心病的发病率逐年增高,已成为威胁人类健康的头号杀手,冠心病合并糖尿病患者亦逐年增多[7]。糖尿病患者一般以女性、高龄、肥胖者居多[8]。本研究中,糖尿病组女性、BMI均明显高于非糖尿病组。在伴有糖尿病的冠心病患者中,冠状动脉粥样硬化程度具有明显弥漫、多支冠状动脉受累及、病变长度较长的特点,术前SYNTAX评分和术后残余SYNTAX评分亦较非糖尿病患者高。既往研究证实,冠心病合并糖尿病患者中其他危险因素亦增多,危险因素共同作用于心血管系统,影响疾病的发生和发展进程[8]。本研究糖尿病组高血压、高脂血症、脑血管疾病病史较非糖尿病组明显增多,与既往研究一致。高脂血症、胰岛素抵抗等因素加速动脉粥样硬化进程,造成内皮功能损害,促进新生内膜增生并且抑制血小板功能[9]。因此,糖尿病患者再次血运重建发生率更高,PCI术后支架内再狭窄及血栓形成风险更高,PCI术后死亡及心肌梗死事件增多[10]。在药物支架面世之前,冠心病合并糖尿病患者的血管重建策略一直存在争议,在BARI[11]和EAST[12]研究中,通过比较介入治疗与CABG疗效的研究显示对于冠心病合并2型糖尿病患者采用金属裸支架(BMS)的介入治疗较CABG有更高的死亡率,大多数早期比较支架和CABG重要研究的结果都支持在冠心病合并2型糖尿病患者前降支内乳动脉桥优于置入BMS。在DES应用于临床后,已经有多个大规模研究显示DES显著降低冠心病合并2型糖尿病患者的支架再狭窄率和术后MACE[13,14]。在糖尿病与非糖尿病患者置入DES相关研究中,糖尿病较非糖尿病组仍有较差的临床结局,糖尿病患者心原性死亡、心肌梗死、血运重建率较非糖尿病患者增高,不同研究结果略有差异[15, 16]。
本研究糖尿病对生物涂层可降解支架PCI术后患者预后的影响是基于真实世界大规模多中心的临床研究,研究共入组2 348例受试者,随访率达96.3%。在本研究中比较有趣的一个发现,尽管糖尿病组较非糖尿病组有更差的临床结局,包括靶血管心肌梗死、缺血性驱动的靶病变血运重建、所有心肌梗死和血运重建,但差异无统计学意义。对这一结果的出现可能有以下几方面的原因。首先,本研究所有患者采用的均是新一代药物涂层可降解支架,新一代药物支架具有更薄、更耐用的金属平台,生物涂层具有更好的组织相容性,且能完全降解。避免了支架介导的血管损伤,这种改进的支架技术,可以更好的克服由器械本身的局限性带来的血运重建,尤其对糖尿病患者[14,17]。其次,该研究为随机对照多中心临床试验,故对受试者药物治疗非常规范,所有受试者均得到了包括他汀类及双联抗血小板药物在内的标准二级预防。这些药物,尤其是高剂量他汀类药物可明显减缓糖尿病患者动脉粥样硬化的进展[18]。本研究心原性死亡、全因死亡和ARC定义的可能支架内血栓在两组间差异有统计学意义,经过多因素分析后,糖尿病是心原性死亡的独立危险因素。糖尿病组心原性死亡较非糖尿病组显著增高,与糖尿病组ARC定义的可能支架内血栓明显增加相关,支架内血栓是一种灾难性的并发症,大多数患者表现为猝死或大面积心肌梗死,即使再次血运重建成功,6个月的死亡率仍然很高[19]。早期有研究显示低射血分数、糖尿病、高龄及急性冠状动脉综合征与支架内血栓形成相关,但亦有研究显示糖尿病与支架内血栓无明显相关性[20],糖尿病与支架内血栓相关性还需进一步研究。本研究发现糖尿病患者的PCI术后的不良结局不是因为糖尿病本身引起,而是由于糖尿病患者往往合并更多的其他危险因素,更广泛的冠状动脉病变。因此,糖尿病并不是PCI术后不良结局的独立危险因素。在最新的一项研究中,共纳入6 801例PCI术后患者,糖尿病较非糖尿病患者组有更高的靶血管重建率,但心原性死亡和急性心肌梗死发生率相似[21]。在本研究中糖尿病组与非糖尿病组血运重建率无显著差异。故糖尿病是否是药物洗脱支架PCI术后血运重建的独立危险因素仍需要进一步研究。本研究有一定的局限性,该项研究只随访了两年,但动脉粥样硬化的进程是非常缓慢的,需要更长时间的随访来进一步验证结果。综上所述,冠心病合并糖尿病患者PCI术后随访2年MACE的发生率与非糖尿病患者差异无统计学意义,但糖尿病患者全因死亡,尤其是心原性死亡高于非糖尿病患者。糖尿病是心原性死亡的独立危险因素。这说明通过严格控制适应证,应用新型介入器械及技术手段,充分的围术期准备和严密的术后监测,合理的手术方案,有可能改善该类患者的介入预后。
[1]吴永健, 宋光远. 心血管疾病与糖调节异常[J]. 中国循环杂志,2011, 26(1): 6-8. DOI: 10. 3969/j. issn. 1000-3614. 2011. 01. 001.
[2]Lima EG, Hueb W, Garcia RM, et al. Impact of diabetes on10-year outcomes of patients with multivessel coronary artery disease in the Medicine, Angioplasty, or Surgery StudyⅡ(MASSⅡ) trial[J]. Am Heart J, 2013, 166(2): 250-257. DOI: 10. 1016/j. ahj. 2013. 04. 017.
[3]Haffner SM, Lehto S, Ronnemaa T. Mortality from coronary heart disease in subjects with type 2 diabetes and in nondiabetic subjects with and without prior myocardial infarction[J]. N Eng J Med, 1998,339(4): 229-234. DOI: 10. 1056/NEJM199807233390404.
[4]Hong YJ, Jeong MH, Choi YH, et al. Plaque characteristics inculprit lesions and inflammatory statusin diabetic acute coronary syndrome patients[J]. JACC Cardiovasc Imaging, 2008, 20092(3): 339-349. DOI:10. 1016/j. jcmg. 2008. 10. 017.
[5]Billinger M, Raber L, Hitz S, et al. Long-term clinical and angiographic outcomes of diabetic patients after revascularization with early generation drug-eluting stents[J]. Am Heart J, 2012, 163: 876-886. DOI: 10. 1016/j. ahj. 2012. 02. 014.
[6]Park DW, Flaherty JD, Davidson CJ, et al. Prognostic influence of diabetes mellitus on long-term clinical outcomes and stent thrombosis after drug-eluting stent implantation in Asian patients[J].Am J Cardiol, 2009, 103(5): 646-652. DOI: 10. 1016/j. amjcard. 2008.11. 012
[7]Zheng X, Curtis JP, Hu S, et al. Coronary catheterization and percutaneous coronary intervention in China: 10-year results from the China PEACE-retrospective cath PCI study[J]. JAMA Intern Med,2016, 176(4): 512-521. DOI: 10. 1001/jamainternmed. 2016. 0166.
[8]Preis SR, Pencina MJ, Hwang SJ, et al. Trends in cardiovascular disease risk factors in individuals with and without diabetes mellitusin the Framingham Heart Study[J]. Circulation, 2009, 120(3) : 212-220.DOI: 10. 1161/CIRCULATIONAHA. 108. 846519.
[9]Creager MA, Lüscher TF, Cosentino F, et al. Diabetes and vascular disease: pathophysiology, clinical consequences, and medical therapy:Part I[J]. Circulation, 2003, 108(12): 1527-1532. DOI: 10. 1161/01.CIR. 0000091257. 27563. 32.
[10]Roffi M, Angiolillo DJ, Kappetein AP. Current concepts on coronary revascularization in diabetic patients[J]. Eur Heart J, 2011, 32(22):2748-2757. DOI: 10. 1093/eurheartj/ehr305.
[11]The BARI Investigators. Seven-year outcome in the bypass angioplasty revascularization investigation(BARI) by treatment and diabetic status[J].J Am Coll Cardiol, 2000, 35(5): 1122-1129.
[12]King SB 3rd, Kosinski AS, Guyton RA, et a1. Eight-year mortality in the Emory Angioplasty versus Surgery Trial (EAST) [J].J Am Coll Cardio1, 2000 , 35(5): 1116-1121.
[13]Stefanini GG, Byrne RA, Serruys PW, et al. Biodegradable polymerdrug-eluting stents reduce the risk of stent thrombosis at 4 years in patients undergoing percutaneous coronary intervention: a pooled analysis of individual patient data from the ISAR-TEST3,ISAR-TEST 4, and LEADERS randomized trials[J]. Eur Heart J, 2012,33(10): 1214-1222. DOI: 10. 1093/eurheartj/ehs086.
[14]窦克非, 邱洪, 吴元, 等. 冠心病合并糖尿病患者置入药物洗脱支架和裸金属支架2年临床观察[J], 中国循环杂志, 2010, 25(1):7-10. DOI: 10.3969/ j.issn.1000 -3614. 2010. 01. 004.
[15]Zhang F, Yang J, Qian J, et al. Comparison of long-term clinical outcomes after the second-generation cobalt-chromium sirolimuseluting stents implantation in diabetic versus non-diabetic patients: a subgroup analysis from the prospective FOCUS registry[J]. Ann Med,2016, 48(3): 202-210. DOI: 10. 3109/07853890. 2016. 1162324.
[16]Loutfi M, Sadaka MA, Sobhy M. Outcomes of DES in diabetic and nondiabetic patients with complex coronary artery disease after risk stratification by the SYNTAX score[J]. Clin Med Insights Cardiol,2016, 10(10): 103-110. DOI: 10. 4137/CMC. S37239.
[17]Stone GW, Rizvi A, Newman W, et al. Everolimus-eluting versuspaclitaxel-eluting stents in coronary artery disease[J]. N Engl J Med, 2010, 362(18): 1663-1674. DOI: 10. 1056/NEJMoa0910496.
[18]Stegman B, Puri R, Cho L, et al. High-intensity statin therapyalters the natural history of diabetic coronary atherosclerosis: insights from SATURN[J]. Diabetes Care, 2014, 38(2): 3114-3120. DOI: 10. 2337/dc14-1121.
[19]Van Werkum FW, Heestermans AA, Zomer AC, et al. Predictors of coronary stent thrombosis: the dutch stent thrombosis registry[J]. J Am Coll Cardiol, 2009, 53(16): 1399-1409. DOI: 10. 1016/j. jacc. 2008.12. 055.
[20]Raffaele P, Gennaro G, Allan Z, et al. Effects of baseline coronary occlusion and diabetes mellitus in patients with ST-segment elevation myocardial infarction undergoing primary percutaneous coronary intervention[J]. Am J Cardiol, 2014 , 114(8): 1145-1150. DOI: 10.1016/j. amjcard. 2014. 07. 030.
[21]Koskinas KC, Siontis GC, Piccolo R, et al. Impact of diabeticstatus on outcomes after revascularization with drug-eluting stents in relation to coronary artery disease complexity: patientlevel pooled analysis of 6081 patients[J]. Circ Cardiovasc Interv, 2016, 9(2): e003255. DOI:10. 1161/CIRCINTERVENTIONS. 115. 003255.
