1-磷酸鞘氨醇在脓毒性休克患者表达及其与预后关系的研究
2018-06-29朱先华胡晓飞
朱先华,胡晓飞
0 引言
脓毒性休克是指脓毒症合并机体代谢系统、微循环系统等功能障碍,导致器官低灌注或器官功能不全[1]。目前针对脓毒性休克患者病情严重程度和预后评估方法以危重病评分为主,以急性生理和慢性健康状况评分Ⅱ(Acute physiology and chronic health evaluationⅡ,APACHEⅡ)应用最为广泛,但APACHEⅡ评分需要记录患者多项生理、生化指标的检测结果,评分过程容易滞后,导致患者错过最佳治疗方案的治疗窗[2]。因此,寻找更加准确的评估脓毒性休克病情和预后、易于临床检测的生物学标志物已成为诊治脓毒性休克领域的研究热点之一。1-磷酸鞘氨醇(Sphingosine-1-phosphate,S1P)是一种脂质酶,在脓毒性休克的发生、发展中起到重要作用。S1P可促进炎症因子表达、上调炎症因子水平和参与炎症反应[3-4]。近年研究显示,S1P作为启动炎症反应的信号因子,尤其在脓毒性休克患者血清中呈强阳性表达。目前关于S1P与脓毒性休克病情严重程度和预后的关系仍不明确,相关文献较少,缺乏统一定论。因此,本研究旨在分析S1P在脓毒性休克患者表达及其与预后的关系。
1 资料与方法
1.1 一般资料 选择我院2015年1月至2017年1月收治的136例脓毒症患者作为研究对象,分为单纯脓毒症、重度脓毒症和脓毒性休克3个亚组。单纯脓毒症组33例,男18例,女15例,年龄24~69岁,平均(57.5±4.1)岁;重度脓毒症组38例,男20例,女18例,年龄23~71岁,平均(56.9±3.8)岁;脓毒性休克组65例,男36例,女29例,年龄22~68岁,平均(56.3±4.3)岁。纳入标准:所有患者符合脓毒症诊断标准,病因包括肺部、尿路、腹腔、血行性细菌感染。排除标准:年龄<18岁,入院72 h内病死、合并肿瘤、免疫性疾病、严重心脑血管疾病、重要脏器功能障碍及具有哮喘病史的患者。本研究经医院伦理委员会批准,且患者或其家属均签署知情同意书。
1.2 研究方法 比较各组血清S1P、降钙素原(Procalcitonin,PCT)表达水平、APACHEⅡ评分、死亡率;根据脓毒性休克患者的APACHEⅡ评分,分为<15分、15~20分、>20分3个分段,比较不同分段的血清S1P、PCT表达水平、死亡率;根据脓毒性休克患者的预后情况,分为死亡组和存活组,比较两组患者的血清S1P、PCT表达水平、APACHEⅡ评分;采用Spearman相关分析脓毒性休克患者血清S1P表达水平与PCT、APACHEⅡ评分、死亡率的相关性。
1.3 血清S1P和PCT表达水平的检测 所有患者在入ICU治疗24 h内,抽取空腹静脉血3 mL,低温离心5 min (3 000 r/min),分离血清,置于-80 ℃环境中待检测;采用双抗体夹心酶联免疫吸附法(ELISA)检测血清S1P和PCT表达水平,其中人S1P-ELISA检测试剂盒由研域生物技术(上海)有限公司提供,人PCT-ELISA检测试剂盒由武汉明德生物科技股份有限公司提供,严格按照试剂盒的使用说明书,准备试剂、标准品和样品,并进行稀释,加入生物素化抗体工作液,孵育、洗涤;加入酶结合物工作液,孵育、洗涤;加入底物溶液,孵育、洗涤后,加入终止液,在10 min内使用紫外分光光度计检测,读取吸光度值,统计回归曲线方程,分别计算血清S1P和PCT表达水平。
1.4 APACHEⅡ评分方法 所有患者在入ICU治疗24 h内,进行APACHEⅡ评分(由慢性健康状况评分、年龄评分、急性生理学评分组成),参照标准进行判断和加减评分,其分值越高,提示病情严重程度越大,预后越差。各项评分参数包括:体温、呼吸频率、心率、动脉血氧分压、平均动脉压、血细胞比容、pH值、血清钠的浓度、血清钾的浓度、血白细胞总数、血肌酐以及昏迷记录评分等的最差值,与慢性健康状况评分、年龄评分相加,最后得出总分[5-6]。

2 结果
2.1 各组血清S1P、PCT表达水平、APACHEⅡ评分、死亡率比较 脓毒性休克组血清S1P、PCT表达水平、APACHEⅡ评分、死亡率均高于单纯脓毒症组、重度脓毒症组(P<0.05);而单纯脓毒症组与重度脓毒症组的血清S1P、PCT表达水平、APACHEⅡ评分、死亡率比较差异无统计学意义(P>0.05)。见表1。
2.2 各APACHEⅡ分段的血清S1P、PCT表达水平及死亡率比较 APACHE Ⅱ<15分、15~20分、>20分脓毒性休克患者的血清S1P、PCT表达水平及死亡率比较差异有统计学意义(P<0.05);脓毒性休克患者血清S1P、PCT表达水平及死亡率随着APACHE Ⅱ评分提高而提高(P<0.05)。见表2。
2.3 死亡组与存活组血清S1P、PCT表达水平及APACHEⅡ评分比较 死亡组血清S1P、PCT表达水平、APACHEⅡ评分均高于存活组(P<0.05)。见表3。
2.4 相关性分析 经Spearman相关分析,脓毒性休克患者血清S1P与PCT表达水平、APACHEⅡ评分、死亡率均呈明显正相关(r=0.381、0.358、0.463,P<0.05)。
3 讨论
脓毒性休克是由脓毒症引起的休克,伴随着不同程度的组织灌注不足,主要与细菌感染密切相关,多见于胰腺炎、胆管炎、胆囊炎等,已成为ICU患者死亡的最重要原因之一[7]。针对脓毒性休克,防治的关键在于及时准确地评估脓毒性休克患者的病情严重程度和预后,制定合理的治疗方案,进而提高救治成功率[8]。目前临床主要采用APACHEⅡ评分评价脓毒性休克的病情严重程度和预后,但APACHEⅡ评分具有严格的评分标准,需要患者的多项生理、生化指标的量化结果才能得出评分;同时,在APACHEⅡ评分过程中,需要收集患者的基本资料,难以在短时间完成APACHEⅡ评分,容易延误对患者病情严重程度和预后的评估[9]。
S1P是一种脂质酶,亦是机体的重要炎症介质,可由体内多种免疫细胞合成,如中性粒细胞、巨噬细胞、肥大细胞等[10-11]。同时,肿瘤坏死因子α、白介素1β等炎症介质及内毒素可刺激中性粒细胞、巨噬细胞、肥大细胞等合成、分泌S1P,进而上调S1P表达水平。此外,S1P亦可促进肿瘤坏死因子α、白介素1β等炎症介质的合成、分泌。PCT是一种反映脓毒症及多脏器功能衰竭严重程度和预后的血清炎症标志物之一,但在早期脓毒症患者血清中表达不明显[12]。通过本研究可知,脓毒性休克患者血清S1P与PCT表达水平呈明显正相关;原因在于S1P与其他炎症介质相互作用、促进合成,提示在脓毒性休克的发生、发展过程中,S1P与其他炎症介质协同分泌,放大机体炎症效应。
脓毒性休克是脓毒症、重度脓毒症进一步发展的病情严重阶段[13-14]。本研究中,脓毒性休克组血清S1P表达水平高于单纯脓毒症组、重度脓毒症组,且后两组间差异无统计学意义,可能是因为在单纯脓毒症、重度脓毒症的发展过程中,通过炎症因子及毒性病原成分刺激,提高S1P合成关键酶磷酸化鞘氨醇激酶的表达水平或增强活性,与Hao等[15]的研究类似。李琼等[16]研究发现,S1P参与革兰阴性杆菌及内毒素引起脓毒性休克的病理过程。体外动物实验表明,注射外源性的S1P可在短时间内导致小鼠出现持续低血压状态,类似于脓毒性休克的组织灌注不足;而预先注射S1P抑制剂,可有效解除持续低血压状态,改善血流动力学紊乱引起的症状[17-20]。S1P参与介导脓毒性休克发生、发展的原因可能为:S1P可扩张外周血管,降低血管活性物质表达水平,促进微血管渗出,减少冠脉的血流量,降低心肌收缩能力。研究表明,脓毒性休克患者存在不同程度的缺血-再灌注损伤,进而刺激S1P合成、分泌,这可能亦是脓毒性休克患者血清S1P表达水平较高的重要原因之一[21-22]。
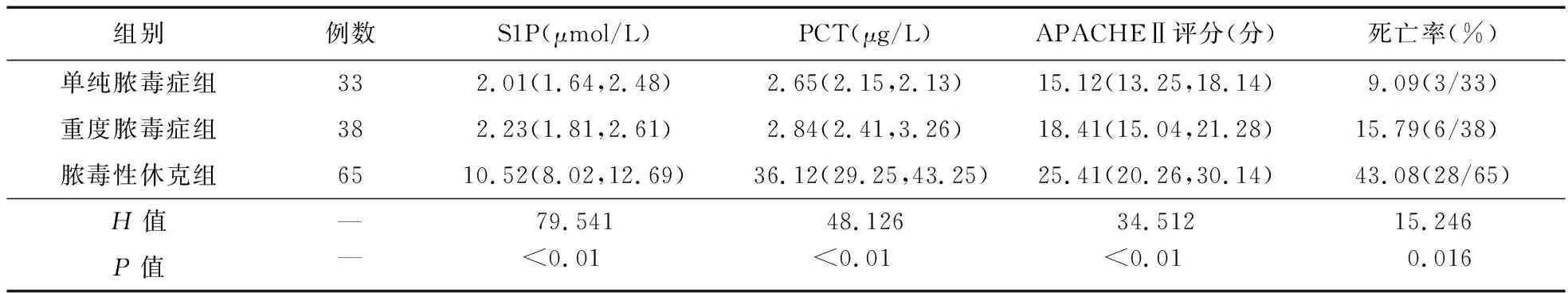
表1 各组血清S1P、PCT表达水平、APACHEⅡ评分、死亡率比较

表2 各APACHEⅡ分段的血清S1P、PCT表达水平、死亡率比较

表3 死亡组与存活组血清S1P、PCT表达水平、APACHEⅡ评分比较
APACHE Ⅱ评分参数包括心率、动脉血氧分压、平均动脉压等生理指标及慢性健康状况、年龄,主要用于评估危急重症患者的病情严重程度和预后。在本研究中,脓毒性休克患者血清S1P表达水平随着APACHE Ⅱ评分提高而提高,各APACHEⅡ分段间差异有统计学意义,且死亡组血清S1P表达水平高于存活组,提示S1P在脓毒性休克患者血清中表达水平显著提高;结合Spearman相关分析,脓毒性休克患者血清S1P与PCT表达水平、APACHEⅡ评分均呈明显正相关,可以认为脓毒性休克患者血清中S1P表达水平与患者的病情严重程度呈正相关。APACHEⅡ评分是目前评估脓毒性休克患者预后的常用指标,本研究显示,死亡组血清S1P、PCT表达水平、APACHEⅡ评分均高于存活组,且脓毒性休克患者血清S1P表达水平与死亡率呈明显正相关,此外,血清S1P表达水平的检测流程较为便捷,可在3 h内完成,因此,脓毒性休克患者血清中S1P表达水平对于评估患者预后具有积极作用。
综上所述,S1P在脓毒性休克患者血清中表达水平显著提高,且与患者预后呈负相关,通过监测血清S1P表达水平,可评估病情严重程度和预后。
参考文献:
[1] 程鹏雁,马渝,陶杨,等.脓毒症患者入ICU时血浆血小板活化因子水平与病情严重程度的相关性分析[J].重庆医科大学学报,2014,12(7):1027-1031.
[2] Berthoux F,Mohey H,Laurent B,et al.Predicting the risk for dialysis or death in IgA nephropathy[J].J Am Soc Nephrol,2011,22(4):752-761.
[3] 赵蕴伟,徐意芹,王春玲,等.支气管哮喘急性发作时血清1-磷酸鞘氨醇水平及其临床意义[J].中国中西医结合急救杂志,2017,24(2):177-179.
[4] Le W,Liang S,Hu Y,et al.Long-term renal survival and related risk factors in patients with IgA nephropathy:results from a cohort of 1155 cases in a Chinese adult population[J].Nephrol Dial Transplant,2012,27(4):1479-1485.
[5] Proia RL,Hla T.Emerging biology of sphingosine-1-phosphate:its role in pathogenesis and therapy[J].J Clin Invest,2015,125(4):1379-1387.
[6] Sui M,Zhou J,Xie R,et al.The sphingosine-1-phosphate receptor agonist FTY720 prevents the development of anti-glomerular basement membrane glomerulonephritis[J].Mol Biol Rep,2012,39(1):389-397.
[7] 田涛,赵允召,黎介寿.n-3多不饱和脂肪酸抑制SphK1信号通路改善脓毒症的炎性反应[J].肠外与肠内营养,2016,23(5):309-313.
[8] 夏誉,叶素贞.EICU脓毒血症患者预后评估及相关因素[J].实用医学杂志,2017,33(11):1822-1825.
[9] Watson L,Tullus K,Marks SD,et al.Increased serum concentration of sphingosine-1-phosphate in juvenile-onset systemic lupus erythematosus[J].J Clin Immunol,2012,32(5):1019-1025.
[10]辛慰,吉庆春,彭秋月,等.1-磷酸鞘氨醇对肺成纤维细胞纤维化发生的影响和机制[J].实用医学杂志,2017,33(10):1589-1592.
[11]刘慰华,林双峰,石吉相,等.1-磷酸鞘氨醇在高糖诱导血管内皮细胞功能损伤中的作用[J].中国病理生理杂志,2016,32(2):245-250.
[12]黄娇甜,卢秀兰,张新萍, 等.降钙素原清除率联合序贯器官衰竭评分差值对儿童脓毒性休克预后评估的应用价值[J].中国小儿急救医学,2017,24(11):831-836.
[13]陈涛,臧彬.脓毒症及脓毒性休克患者T淋巴细胞亚群变化研究[J].临床军医杂志,2017,45(1):46-48.
[14]李元塔,周广裕,莫俊德.主动脉内球囊反搏术在脓毒性休克中的临床应用[J].沈阳医学院学报,2016,18(4):265-266.
[15]Hao J,Huang YM,Zhao MH,et al.The interaction between C5a and sphingosine-1-phosphate in neutrophils for antineutrophil cytoplasmic antibody mediated activation[J].Arthritis Res Ther,2014,16(4):R142.
[16]李琼,常志芳,杨国安,等.1型1-磷酸鞘氨醇受体的siRNA对人涎腺导管上皮细胞的作用[J].北京大学学报(医学版),2016,48(6):987-993.
[17]张坚,侯金超,徐孟龙,等.S1PR3激动剂KRX-725促进细菌清除影响脓毒症小鼠预后[J].中华急诊医学杂志,2016,25(1):57-62.
[18]贺苗,赵杰,苏健,等.1-磷酸鞘氨醇后适应对大鼠心肌缺血/再灌注损伤的保护作用[J].中国药理学通报,2013,29(10):1369-1373.
[19]包馨慧,李海霞,陶静,等.1-磷酸鞘氨醇/1-磷酸鞘氨醇1受体信号通路在大鼠肥大心肌细胞缺血后适应中的作用及其机制[J].中华心血管病杂志,2016,44(5):431-435.
[20]熊响清,王良荣,陈祥建,等.抑制鞘氨醇激酶-1/1-磷酸鞘氨醇信号通路减少大鼠肢体缺血再灌注肺损伤[J].中华实验外科杂志,2016,33(11):2549-2551.
[21]Eitner F,Floege J.In search of a better understanding of IgA nephropathy-associated hematuria[J].Kidney Int,2012,82(5):513-515.
[22]Sutter I,Park R,Othman A,et al.Apolipoprotein M modulates erythrocyte efflux and tubular reabsorption of sphingosine-1-phosphate[J].J Lipid Res,2014,55(8):1730-1737.
