肝硬化背景下肝癌与增生结节的超声造影定量分析
2018-06-29胡小娟刘锦萍吕志红杨银凤
胡小娟 刘锦萍 吕志红 杨银凤
鄂东医疗集团黄石市中心医院超声影像科,湖北黄石 435000
肝细胞肝癌可能由增生结节、不典型增生结节多步骤癌变而来[1]。超声造影可实时显示肝内血管和肿瘤微血管分布,在肝脏局灶性病变的检查与血流动力学评估中得到了广泛应用[2]。对于肝占位性病变的诊断效果明显优于普通超声,此次研究对肝癌和增生结节的超声定量参数进行分析,探讨二者的影像学特点。
1 对象与方法
1.1 研究对象
自2014年5月至2017年8月接受超声检查的患者中选择资料完整、经穿刺活检明确诊断[3]者为研究对象;排除肝癌转移患者以及合并门静脉癌栓者。117例患者均有肝硬化,增生结节组(n=63)及小肝癌组(n=54),增生性结节组男51例,女12例,年龄19~71岁,平均(46.02±8.17)岁,病灶直径0.8~2.9 cm,平均(1.94±0.42)cm;小肝癌组男43例,女11例,年龄19~73岁,平均(45.81±8.63)岁,病灶直径0.7~2.9 cm,平均(1.91±0.37)cm。
1.2 检查方法
使用西门子ACUSON S3000超声诊断系统,经肘静脉团注1.0 mL SonoVue超声微泡造影剂(意大利Bracco公司),推注5 mL生理盐水冲管,注射造影剂同时启动计时器,录像4~6 min,参照欧洲医学和生物学超声协会联盟诊断造影指南[4],将肝脏造影分为动脉期(造影剂注射后8~30 s)、门脉期(造影剂注射后31~120 s)及延迟期(造影剂注射后121~360 s),根据病灶与周围肝实质回声强度变化,分为高、等、低三个级别,将动态造影数据导入Qontrast软件进行脱机分析,分析区设定为病灶内部感兴趣区(ROI),参考区设定为周围深度相近的肝实质,取样框直径3~4 cm,避开大血管。
1.3 分析方法
运用Qontrast软件,绘制时间-强度曲线并计算病灶达峰时间(TTP)、降支减半时间(自注射造影剂至峰值强度降至50%时间)、造影峰值强度(Peak%)、平均渡越时间(MTT)等参数,并根据曲线测量增强持续时间(ED)[5],ED=开始消退时间-开始增强时间。此外,对两组超声造影动脉期、门脉期、延迟期增强模式和局部血容量(RBV)、局部血流量(RBF)进行比较。
SPSS 22.0分析数据,组间比较,以P<0.05为差异有统计学意义。
2 结果
增生性结节组超声造影动脉期、门脉期、延迟期增强模式以等/低增强、等增强、等增强为主,小肝癌组超声造影动脉期、门脉期、延迟期增强模式以高增强、等/低增强、低增强为主。
增生性结节组TTP、MTT、ED、降支减半时间高于小肝癌组,其Peak%低于后者,差异有统计学意义(P<0.05)。见表1。
增生性结节组动脉期RBV、RBF低于小肝癌组,其延迟期RBV、RBF高于后者,差异有统计学意义(P<0.05),两组门脉期RBV、RBF比较,差异无统计学意义(P>0.05)。见表2。
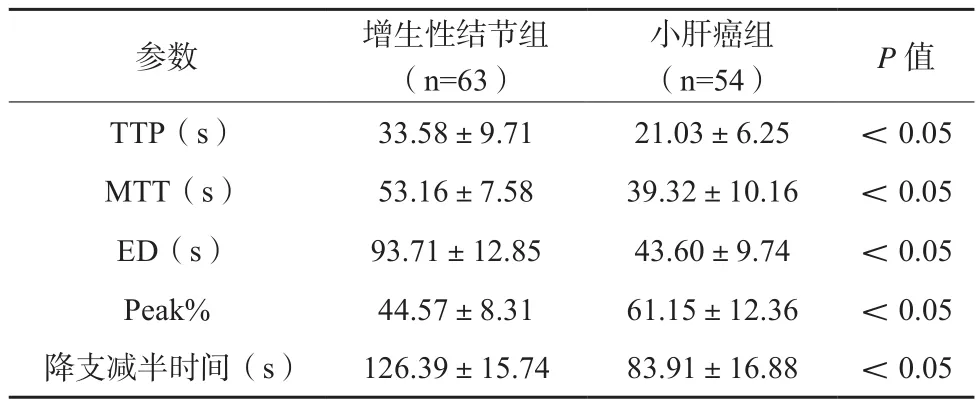
表1 两组患者超声造影时间-强度曲线定量参数比较(x±s)
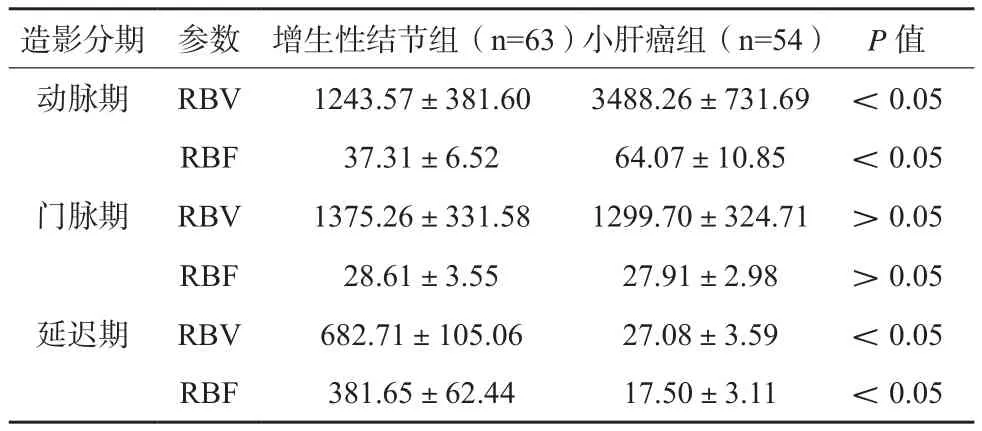
表2 两组患者不同超声造影分期局部血容量及血流量比较(x±s)
3 讨论
肝细胞肝癌的发生经历了由病毒性肝炎向肝硬化、肝癌进展的复杂过程[6],据统计,约有70%的肝细胞肝癌发生于肝硬化基础上,且每年约有2%~3%的乙肝相关性肝硬化患者进展至肝细胞肝癌[7]。研究表明,肝硬化增生结节是肝细胞肝癌的重大癌前病变[8]。二维灰阶超声对于慢性肝病、肝硬化的诊断有着较高参考价值[9];彩色多普勒超声亦可为肿瘤血管的判断提供一定参考[10]。然而,当肝硬化合并多发小结节病灶时,由于肝背景结构、回声异常及良、恶性小病灶声像图典型性有限,并且二维超声与彩色多普勒超声均不具备病变组织血流灌注特征显示能力,均无法为肝脏增生结节与小肝癌的定性诊断提供可靠依据[11-12]。
超声造影又称对比增强超声,其显像可达到组织微循环灌注水平,从而实现肝内结节的实时、动态、连续显示[13]。同时,肝脏的双重供血特点,为超声造影下动脉相、门静脉相、延迟相的区分奠定了良好基础[14]。此次研究结果显示,增生性结节组超声造影动脉期、门脉期、延迟期增强模式分别以等/低增强、等增强、等增强为主,增生性结节处于肝硬化向肝细胞肝癌的过渡阶段,此时肝内血供逐渐减少、结节内新生动脉逐渐增加,结节与小肝癌在门静脉、肝动脉及肿瘤新生动脉系统分布存在区别,因此二者超声造影模式不同[15]。同时,增生性结节的时间-强度曲线表现为“慢进慢出”特点,其TTP、MTT、ED、降支减半时间更高而Peak%偏低,其原因考虑为:增生结节血供主要来自门静脉,加之结节形成后肝脏结构改变、门脉高压形成、微循环破坏、肝内分流出现,均导致时间-强度曲线的特征与癌变组织存在明显差异[16]。本研究增生性结节组动脉期RBV、RBF低于小肝癌组,其延迟期RBV、RBF高于后者,符合上述结论。
小肝癌组超声造影动脉期、门脉期、延迟期增强模式分别以高增强、等/低增强、低增强为主,且超声造影时间-强度曲线特征以“快进快出”为主,说明造影剂通过新生异型动脉或动静脉瘘后可迅速廓清,此时患者病灶内门静脉往往已严重破坏,供血血管为肝动脉,故动脉期RBV、RBF呈上升趋势。此外,已有研究证实Peak%与微血管密度的正相关性[18],故小肝癌组更高的Peak%参数也反映出病灶内更多的新生异型动脉血管与更高的血流灌注量。
综上所述,肝硬化背景下肝癌与增生结节的超声造影三期增强模式、定量参数均存在明显差异,在观察病灶内部血流灌注模式的基础上,借助定量参数分析以区分增生结节与小肝癌,能够为肝细胞肝癌癌变环节的评估与判断提供客观参考。
[1] JO P C, JANG H J, BURNS P N, et al. Integration of contrastenhanced US into a multimodality approach to imaging of nodules in a cirrhotic liver: how i do it[J]. Radiology, 2017,282(2): 317-331.
[2] LEE D H, LEE J Y, HAN J K. Superb microvascular imaging technology for ultrasound examinations: Initial experiences for hepatic tumors[J]. Eur J Radiol, 2016, 85(11): 2090-2095.
[3] 丁建民, 周燕, 王彦冬, 等. 超声造影对肝硬化背景下早期肝癌与增生结节鉴别诊断[J]. 中国超声医学杂志, 2017, 33(8): 711-714.
[4] SUZUKI K, OKUDA Y, OTA M, et al. Diagnosis of Hepatocellular Carcinoma Nodules in Patients With Chronic Liver Disease Using Contrast‐Enhanced Sonography[J]. J Ultrasound Med, 2015, 34(3): 423-433.
[5] FORNER A, VILANA R, BIANCHI L, et al. Lack of arterial hypervascularity at contrast-enhanced ultrasound should not def i ne the priority for diagnostic work-up of nodules< 2 cm[J].J Hepatol, 2015, 62(1): 150-155.
[6] FERRAIOLI G, MELONI M F. Contrast-enhanced ultrasonography of the liver using SonoVue[J]. Ultrasonography,2018, 37(1): 25.
[7] 王萍, 刘健, 岳文胜, 等. 微血流成像联合超声造影对肝硬化增生结节和原发性高分化小肝癌的诊断价值[J]. 医学影像学杂志, 2017, 27(10): 1929-1932.
[8] SPÂRCHEZ Z, RADU P, KACSO G, et al. Prospective comparison between real time contrast enhanced and conventional ultrasound guidance in percutaneous biopsies of liver tumors[J]. Med Ultrason, 2015, 17(4): 456-463.
[9] FRÖHLICH E, MULLER R, CUI X W, et al. Dynamic Contrast‐Enhanced Ultrasound for Quantification of Tissue Perfusion[J]. J Ultrasound Med, 2015, 34(2): 179-196.
[10] BURROWES D P, MEDELLIN A, HARRIS A C, et al.Contrast-enhanced US Approach to the Diagnosis of Focal Liver Masses[J]. RadioGraphics, 2017, 37(5): 1388-1400.
[11] 刘怡彬, 高军喜, 杨磊, 等. 肝硬化背景下增生结节的超声造影模式及定量分析[J]. 中国超声医学杂志, 2016, 32(6): 528-531.
[12] NUMATA K, FUKUDA H, NIHONMATSU H, et al. Use of vessel patterns on contrast-enhanced ultrasonography using a perf l ubutane-based contrast agent for the differential diagnosis of regenerative nodules from early hepatocellular carcinoma or high-grade dysplastic nodules in patients with chronic liver disease[J]. Abdom Imaging, 2015, 40(7): 2372-2383.
[13] 冯少阳. 实时剪切波弹性成像在鉴别诊断肝脏肿瘤中的应用[J]. 解放军医药杂志, 2015,28(8):37-40.
[14] 贾涛, 李富武. 超声造影对肝脏局灶性病变的诊断价值[J]. 中华保健医学杂志, 2010, 12(3):169-171.
[15] KUMAGAWA M, MATSUMOTO N, WATANABE Y, et al.Contrast-enhanced ultrasonographic fi ndings of serum amyloid A-positive hepatocellular neoplasm: Does hepatocellular adenoma arise in cirrhotic liver?[J]. World J Hepatol, 2016,8(26): 1110.
[16] CHIOREAN L, TANA C, BRADEN B, et al. Advantages and limitations of focal liver lesion assessment with ultrasound contrast agents: comments on the European Federation of Societies for Ultrasound in Medicine and Biology (EFSUMB)Guidelines[J]. Med Princ Pract, 2016, 25(5): 399-407.
[17] SCHELLHAAS B, GÖRTZ R S, PFEIFER L, et al. Diagnostic accuracy of contrast-enhanced ultrasound for the differential diagnosis of hepatocellular carcinoma: ESCULAP versus CEUS-LI-RADS[J]. Eur J Gastroenterol Hepatol, 2017, 29(9):1036-1044.
[18] SHIN S K, KIM Y S, CHOI S J, et al. Contrast-enhanced ultrasound for the differentiation of small atypical hepatocellular carcinomas from dysplastic nodules in cirrhosis[J]. Dig Liver Dis, 2015, 47(9): 775-782.