重金属耐性芽孢杆菌的筛选及其对辣椒吸收镉铅的阻控效应
2018-06-28燕传明盛下放何琳燕
杨 丽,燕传明,贺 卓,盛下放,何琳燕
(农业部农业环境微生物重点实验室,南京农业大学生命科学学院,南京 210095)
我国人均耕地少,土壤重金属污染严重影响蔬菜安全生产,给人类健康造成威胁[1-2]。近年来,珠三角和长三角等地区均有菜地土壤重金属污染超标的报道,以Cd、Pb污染为主,叶菜类、根茎类和瓜果类蔬菜中Cd、Pb显著超标[3-4]。当前,国内外都在积极寻找有效治理土壤重金属污染的方法,稳定与提取成为重金属污染土壤治理的主要思路。针对大面积中轻度重金属污染的农田土壤,起固定重金属作用的有机、无机修复剂受到广泛关注[5-7]。这些修复剂主要包括硅钙物质、含磷材料、有机物料、黏土矿物、金属及金属氧化物等,但过多施用化学修复剂对土壤破坏大,可直接影响土壤的理化性质和微量营养元素的吸收[8-9]。
植物根际促生细菌(Plant growth-promoting rhizobacteria,PGPR)是自由生活在土壤或附生于植物根系的、一类可促进植物生长和矿质营养吸收利用的有益菌类[10]。植物根际促生细菌可以产生吲哚乙酸(Indole acetic acid,IAA)和铁载体等促生物质促进植物生长、提高植物对重金属的耐受性,而植物能够为附生的微生物提供生长所需的空间、空气和养分,有效增强根系微生物的活性[10-11]。一些植物根际促生细菌细胞壁含有-COOH、-NH2、-OH等官能团,能与重金属离子配位络合,同时细胞表面带有大量的负电荷,能够吸附土壤中的重金属阳离子,降低重金属的迁移和转化[12]。Park等[13]发现溶磷细菌Pantoea sp.CS2-B1和Enterobacter sp.SM1-B1在溶解磷矿粉的同时能固定土壤铅元素。Wang等[14]发现菌株Q2-8降低蔬菜可食用部分的As含量(22%~50%),菌株Q2-13和Q3-11能够降低蔬菜可食用部分Cd含量(21%~53%),主要原因是菌株能够减少土壤中DTPA提取态Cd含量。Chen等[15]发现Neorhizobium huautlense T1-17菌株在重金属重度污染土壤中能够显著促进辣椒生长、果实产量增加、显著降低果实中Pb、Cd含量,但果实中Cd和Pb含量仍然远高于食品安全国家标准。目前,关于植物促生细菌在阻控作物吸收重金属方面的稳定修复研究报道甚少,仍需进一步研究。
辣椒富含维生素和矿物质,广受大众喜爱,在世界各国普遍种植。农田土壤重金属污染的加剧,严重威胁了辣椒等蔬菜的质量安全[16-17]。本研究从南京某矿区周边污染农田中筛选耐受Cd和Pb的植物促生细菌,探究植物促生细菌对辣椒生长以及吸收重金属Cd和Pb的影响,从而为利用PGPR来阻控蔬菜吸收重金属的科学设想提供理论依据和试验基础。
1 材料与方法
1.1 试验材料
根际土壤样品:采集南京市某矿区周边农田(32.17°N,118.96°E)中辣椒(Capsicum annuum)和圣女果(Lycopersicon esculentum)根际土壤。
LB培养基:胰蛋白胨10 g,酵母提取物5 g,NaCl 10 g,水1000 mL,固体培养基另加2%琼脂。有氮培养基:蔗糖 10.0 g,(NH4)2SO41.0 g,K2HPO42.0 g,MgSO4·7H2O 0.5 g,NaCl 0.1 g,酵母膏 0.5 g,蒸馏水 1000 mL,pH 7.2。
供试蔬菜为辣椒(苏椒5号博士王),购买自江苏省农科院种子站。
供试土壤为南京市某矿区周边农田0~20 cm表层土壤,采集土样后去除植物残体,风干,粉碎过5目筛,备用。土壤总 Cd 3.58±0.14 mg·kg-1,总 Pb 376.83±0.76 mg·kg-1,有机质 9.30±0.31 g·kg-1,pH 6.13±0.2。育苗用的营养基质为常规品牌标优美,购买于标优美生态工程股份公司,全氮 1.37 g·L-1,磷酐 0.79 g·L-1,氧化钾 0.84 g·L-1,有机质≥30%,N+P2O3+K2O≥3%,经高温高压灭菌1 h处理后,备用。
1.2 耐Cd细菌的分离筛选
采用系列稀释涂布平板培养法在添加1 mg·L-1Cd(NO3)2的LB固体培养基上分离、纯化植物根际Cd抗性细菌。称取土样1 g,放入盛有99 mL无菌水的锥形瓶中,充分振荡。再放入85℃恒温水浴锅中水浴15 min,制成编号为10-2的土壤悬液。另取无菌水9 mL的试管5支分别编号,吸取1 mL土壤悬液加到9 mL的无菌水试管中,混匀,依次稀释后,涂布在添加 1 mg·L-1Cd(NO3)2的 LB 平板上。培养 72 h 后选取菌落数适当的平板,随机挑取长势良好的Cd抗性细菌单菌落,多次划线分离纯化,保存待用。
1.3 菌株的生物学特性试验
菌株产多糖能力测定采用苯酚-硫酸法[18],产吲哚乙酸(IAA)测定参考 Gordon[19]、Mayer[20]等的方法,铁载体能力测定参考Schwyn[21]的方法,溶解无机磷能力测定参考Liu等[22]的方法。
1.4 菌株的分子鉴定
将各菌株接种至LB液体培养液中培养至对数期,参考颜子颖等人[23]的方法提取细菌的基因组DNA。以基因组DNA为模板,采用通用引物[24-25]27F:5′-AGAGTTTGATCCTGGCTCAG-3′和 1492R:5′-TACGGCTACCTTGTTACGACTT-3′进行 PCR扩增。PCR 反应体系(50 μL):10×Buffer 5.0 μL,dNTPs 4.0 μL,27F 和 1492R 各 1.0 μL,重蒸水 38 μL,混合后加入 DNA 模板 0.5 μL,Taq 酶 0.5 μL。PCR 程序为:94℃,5 min预变性;94℃,1 min变性;52℃退火 60 s;72℃ 2 min;30个循环;72℃延伸 10 min。将 16S rRNA基因扩增产物送至南京金斯瑞生物科技有限公司测序。用BLAST软件将所获得序列与GenBank中已知的16S rRNA基因序列进行比对分析构建系统进化树。
1.5 菌株对溶液中Cd和Pb的去除作用
将保存的菌株接到3 mL液体LB培养基中,30℃、150 r·min-1振荡培养 16~20 h进行活化,无菌操作条件下将发酵液稀释至OD600值为1.0,按2%的接种量将菌液分别接种到单一浓度为7 mg·L-1的Cd2+[Cd(NO3)2]、14 mg·L-1的 Pb2+[Pb(NO3)2]和镉铅复合的LB液体培养基中,每组处理3个重复,对照(CK)为不接菌处理。30℃、150 r·min-1振荡培养24 h,10 000 r·min-1离心5 min取上清液。用ICP-OES测定上清液中的Cd和Pb浓度,重金属的去除率按照下列公式计算:
去除率=(对照组上清液中金属离子浓度-接菌组上清液中金属离子浓度)/对照组上清液中金属离子浓度×100%。
1.6 菌株对苗期辣椒的促生试验
辣椒种子消毒处理后,均匀地洒在铺有湿润无菌纱布的培养皿中,放置于30℃黑暗培养箱中催芽。挑选长势一致的露白种子播种于育苗盘,待幼苗长出3片真叶后,挑选大小、长势一致的幼苗清洗根部。将供试菌株接种于有氮培养基中,30℃、150 r·min-1振荡培养 16~20 h 至对数生长期,6000 r·min-1离心 10 min收集菌体,用无菌去离子水将菌体重悬,调节菌悬液浓度至OD600为1.0。将辣椒根部浸于上述菌液30 min后,移栽入灭菌营养基质育苗盘中,每穴定植1株,以无菌的有氮培养液浸根处理的辣椒幼苗为对照(CK),每处理组重复三株。放置温室光照培养,浇水管理,每穴浇水量一致。植物移栽2周后采样,将整株辣椒从穴盘中取出,清水洗净,吸水纸吸干,测量根长、株高和鲜重。
1.7 菌株对辣椒吸收Cd和Pb的影响
盆栽试验在南京农业大学牌楼试验基地日光温室中进行。将风干过筛的重金属污染农田土壤装入塑料盆钵中,每盆1.5 kg,在种植前3 d浇水保持田间持水量约60%[26]。选择大小均匀、饱满一致的辣椒种子,按1.6方法催芽、育苗、分别蘸根接种,每盆接种供试菌株菌悬液30 mL(2%接种量),以同量无菌培养基处理为对照(CK)。植物果实成熟后收获。整个盆栽试验过程中,每天适量浇水(每盆钵等量浇水)以保证植物生长所需要的水分。盆栽设置时间135 d,处理前2 d不浇水。
植物收获处理时,小心摘下植株上的果实,松土,将植物从盆钵中取出,用去离子水将果实和根部洗净,吸水纸吸干称量鲜质量,于80℃烘箱内烘干至恒质量,称量干质量。用粉碎机粉碎果实干样,称取干燥的样品1 g于微波消解仪中进行消解,同样称取根部干样0.2 g于微波消解仪中进行消解。用5%HNO3定容,采用ICP-OES测定消解液中Cd2+和Pb2+含量,换算出辣椒果实和根中的Cd和Pb含量,单位:mg·kg-1。
镉或铅的富集、转移系数按下列公式计算:
富集系数(Bio-concentration Factor,BCF)=辣椒果实镉或铅含量(mg·kg-1)/土壤镉或铅含量(mg·kg-1)
转移系数(Transfer Factor,TF)=辣椒果实镉或铅含量(mg·kg-1)/辣椒根部镉或铅含量(mg·kg-1)
1.8 数据处理
实验数据采用 Office 2007、SPSS 19.0和 Origin8.5软件进行分析与作图,差异显著性采用ANOVA单因素方差分析,不同小写字母代表多重比较差异性显著(P<0.05)。
2 结果与分析
2.1 菌株的生物学特性和种属地位
从南京某矿区周边农田辣椒和圣女果的根际土壤中分离纯化到150株耐热细菌,这些细菌都对1 mg·L-1Cd2+有抗性。进一步测定菌株的生物学特性复筛获得7株芽孢杆菌,编号分别为L11、L15、L22、L24、L25、L44、L121。由表 1可以看出,这 7株芽孢杆菌都能分泌IAA、铁载体和胞外多糖。这些菌株的IAA产量范围为 1.64~51.02 mg·L-1,多糖产量范围为0.43~1.90 g·L-1。菌株 L22、L24、L44 和 L121 能够溶解磷酸钙,在NBRIP培养基上有透明的溶磷圈产生。经16S rRNA基因序列分析,L11、L15、L22和 L44与 B.megaterium的同源性达到99.9%,L24和L121与B.aryabhattai和B.velezensis的同源性分别为99.9%和100.0%,而L25与Lysinibacillus fusiformis的同源性为99.6%,系统发育关系见图1,由此将7株芽孢杆菌分别归属于 B.megaterium、B.aryabhattai、B.velezensis和L.fusiformis。

表1 供试菌株的植物促生特性和种属Table1 Plant growth-promoting characteristics and species of the isolated bacteria
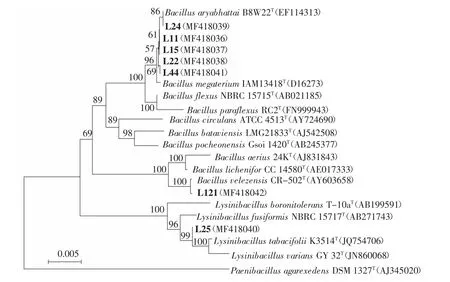
图1 基于菌株部分16S rRNA基因序列构建的系统发育树Figure1 Phylogenetic tree on the basis of partial 16S rRNA gene sequences of the isolated bacteria
2.2 芽孢杆菌对溶液中铅镉的去除作用
由图2A可知,在含7 mg·L-1Cd2+的LB培养液中,24 h时7株芽孢杆菌对Cd2+的去除率范围为30.2%~36.4%,差异不显著。在含14 mg·L-1Pb2+的LB培养液中,24 h时7株芽孢杆菌对Pb的去除率差异较大。菌株L121对Pb的去除率高达88.4%,而其他6株芽孢杆菌对溶液中Pb2+的去除率范围在10.9%~25.6%,由图2B可知,在复合Cd、Pb处理时,24 h时菌株对Cd2+的去除率范围为32.9%~39.2%,与单一Cd条件下的去除率相近。复合重金属条件下菌株对Pb2+的去除率在4.3%~17.5%之间,与单一Pb条件下的去除率相比略有下降。结合图2A、2B可知,在单一Pb2+处理和Cd、Pb复合处理时菌株L121对Pb2+的去除率从88.4%下降到9.6%,可能是菌株L121对Pb、Cd吸附的位点是相似或相近的,Cd2+的存在与Pb2+发生了竞争作用而引起的[27-28]。
2.3 菌株对苗期辣椒的促生作用
由图3可知,不同菌株对辣椒的促生作用有差异。接种菌株L44的辣椒根长、株高和鲜重数值最高,比对照组分别显著增加65.7%、20.6%和20.5%(P<0.05)。其次,接种菌株L11的辣椒根长、株高和鲜重与CK相比显著增加了42.4%、17.5%和17.4%(P<0.05);与CK相比,接种菌株L15组的辣椒根长和株高分别显著增加了19.0%和19.6%(P<0.05),但鲜重没有增加。菌株L22、L24、L121对辣椒无促生作用,L25对辣椒根长和鲜重有抑制作用。
2.4 菌株对辣椒果实中Cd和Pb含量的影响
由表2可知,与CK相比,7株供试菌株都能显著降低辣椒果实中Cd含量,降低率范围为21.8%~39.1%(P<0.05)。菌株 L22、L44、L121 处理的辣椒果实Cd含量为0.07 mg·kg-1,较接近食品安全国家标准(GB 2762—2017)规定的 Cd 限量 0.05 mg·kg-1。转移系数可以反映植物将重金属从地下部转移到地上部的能力大小。与CK相比,除L24处理之外,其余接菌处理均能使辣椒果实Cd转移系数下降,其中接种菌株L22、L25、L44处理的辣椒果实Cd转移系数分别显著下降17.7%、27.6%和22.0%(P<0.05)。与CK相比,接菌处理的辣椒果实Cd富集系数显著下降25.2%~40.6%。
与CK相比,除菌株L11之外,其余6株产芽孢细菌均能显著降低辣椒果实中Pb的含量,降低率范围为22.9%~81.3%(P<0.05)。接种菌株L44的辣椒果实中Pb含量为0.2 mg·kg-1,接近食品安全国家标准(GB 2762—2017)规定的0.1 mg·kg-1Pb限量。与CK相比,除菌株L11之外,其余接种菌株的辣椒果实Pb转移系数显著降低22.2%~81.5%(P<0.05),果实Pb富集系数降低33.3%~66.7%。
相关性分析(表3)表明辣椒果实中Cd含量与Cd转移系数、富集系数极显著正相关,Pb含量与Pb转移系数、富集系数极显著正相关,说明辣椒果实Cd、Pb的转移系数和富集系数降低是辣椒果实中Cd和Pb含量减少的原因之一,接菌处理降低Cd、Pb转移系数和富集系数,有利于阻控辣椒果实中吸收Cd和Pb。
综上所述,在所考察菌株中,接种菌株L44后辣椒果实的Cd和Pb含量分别降低至0.07 mg·kg-1和0.20 mg·kg-1,降低幅度分别为 39.1%和 81.3%,Cd、Pb转移系数和富集系数均最低,说明B.megaterium L44具有阻控辣椒吸收重金属的潜在应用价值。
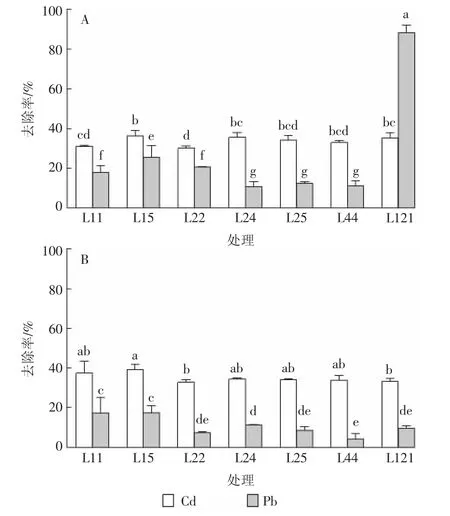
图2 单一(A)、复合(B)Cd和Pb条件下芽孢杆菌对Cd和Pb的去除率Figure2 Effects of the isolated bacteria on removal rate of Cd(Ⅱ)and Pb(Ⅱ)under single(A)or compound(B)treatments
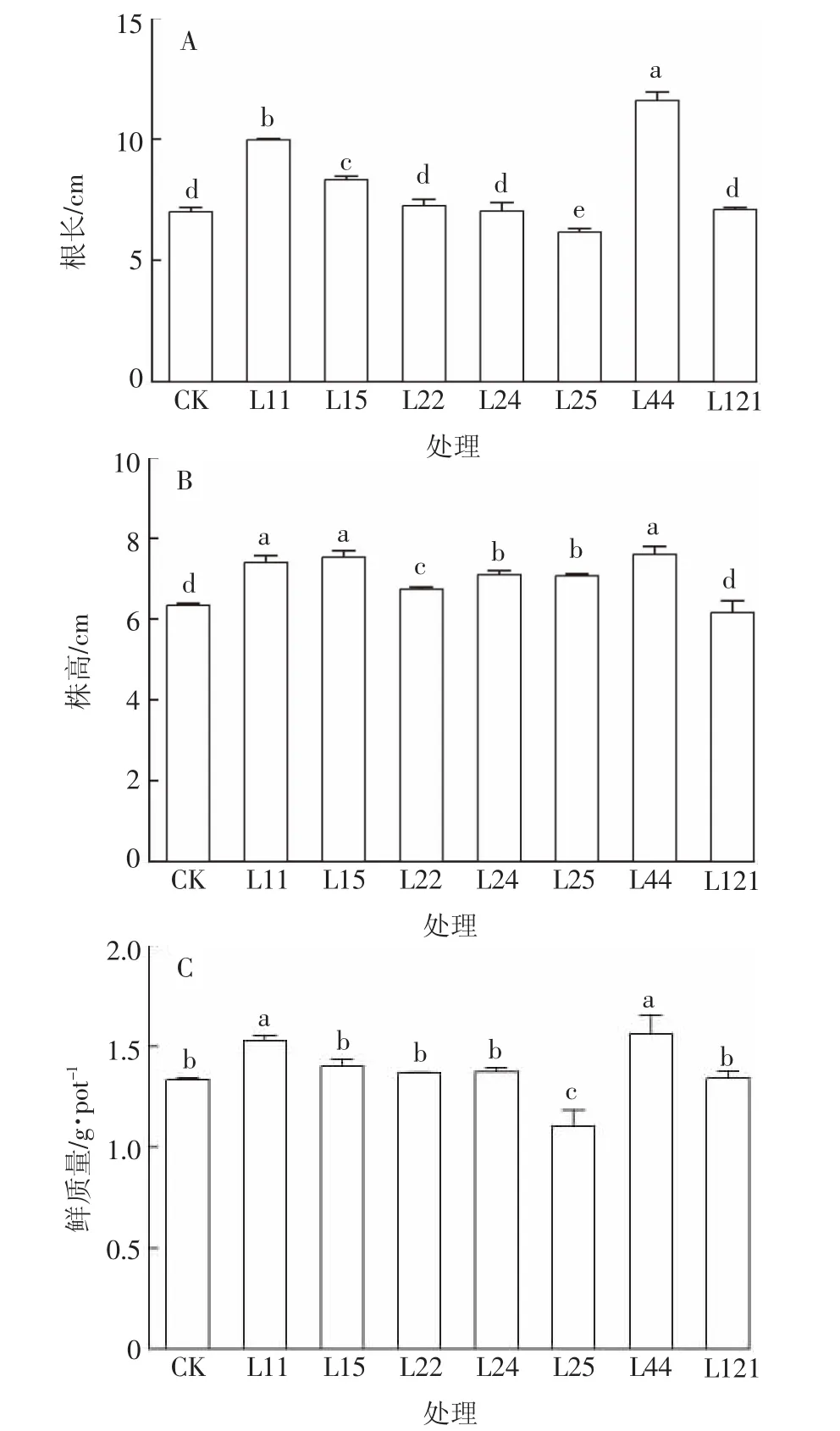
图3 芽孢杆菌对辣椒根长(A)、株高(B)和鲜质量(C)的影响Figure3 Effects of the isolated bacteria on peppers growth in the fertilization experiments
3 讨论
在长期的生物演化过程中,微生物与植物形成了一个良好的微生态系统,大量关于植物根际促生细菌促进植物生长的研究被报道[29-31]。目前已鉴定出多种PGPR菌株,主要种类包括芽孢杆菌属(Bacillus)、假单胞菌属(Pseudomonas)、固氮菌属(Azotobacter)、固氮螺菌属(Azospirillum)、肠杆菌属(Enterobacter)等[30-32]。对辣椒促生和防病的研究中,枯草芽孢杆菌、蜡样芽孢杆菌、短小芽孢杆菌、多粘芽孢杆菌、解淀粉芽孢杆菌的作用皆有报道[32]。PGPR的促生能力主要体现在能够产生一些植物促生物质,如吲哚乙酸、赤霉素和玉米素等[11,32],本研究中7株供试芽孢杆菌均产生吲哚乙酸和铁载体,但L25产生吲哚乙酸和铁载体较少,也无溶磷能力,因此对辣椒促生作用不显著。分离自辣椒根际土的B.megaterium L44菌株对辣椒有明显的促生作用,显示与辣椒有良好的匹配关系,并能显著降低辣椒果实中Cd和Pb含量,具有潜在应用价值。
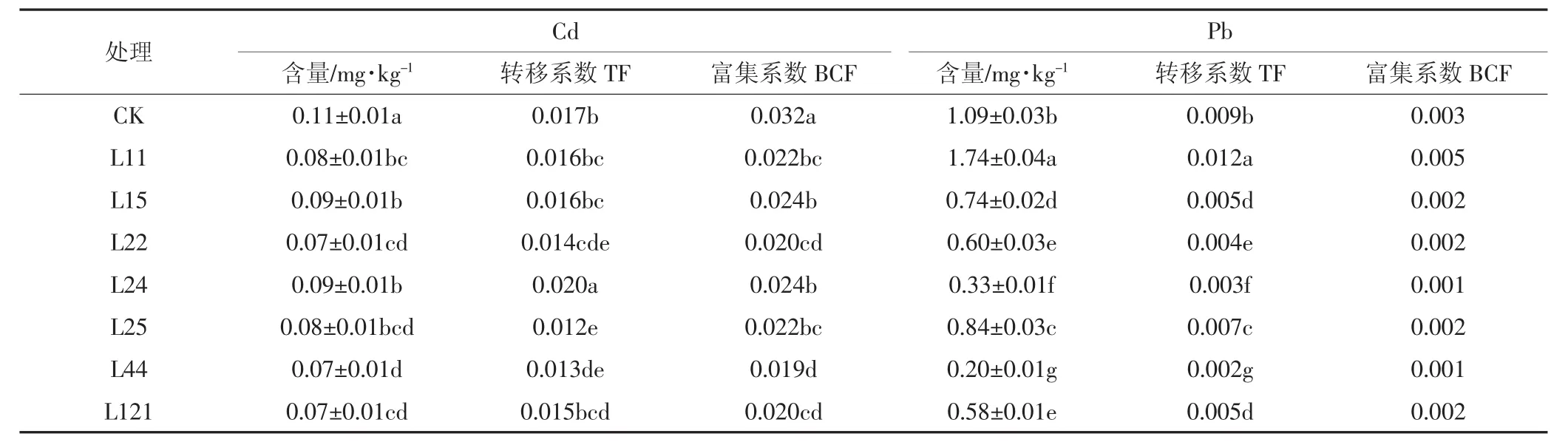
表2 芽孢杆菌对辣椒果实吸收Cd和Pb的影响Table2 Effects of the isolated bacterial inoculation on Cd and Pb accumulation in the fruit of the peppers

表3 辣椒果实中Cd、Pb含量与转移系数、富集系数的相关性Table3 Correction coefficients between fruit Cd content,Pb content,transfer factor and bio-concentration factor
微生物的胞外聚合物和细胞对重金属有很强的吸附能力。胞外聚合物(Extracellular polymeric substances,EPS)是细菌在一定条件下分泌的高分子聚合物,包括多糖、蛋白质和核酸等,富含负电官能团,具有优越的金属键合性[33-35]。另外,芽孢杆菌属于革兰氏阳性细菌,细胞壁由大量肽聚糖和磷壁酸组成,含有丰富的羧基、酰胺基等基团,使得细胞表面带有负电荷,与土壤中的重金属离子产生静电吸附作用,限制了金属离子的活动范围[36-37]。本研究中发现7株芽孢杆菌都分泌多糖,在溶液中24 h时可去除30%~39%的Cd,Pb去除率在4.3%~25.6%之间,通过盆栽试验发现6株芽孢杆菌能显著降低辣椒果实中Cd、Pb含量,推测芽孢杆菌的细胞和代谢产生的多糖能够吸附重金属离子,降低了Pb和Cd的转移系数与富集系数,减少了重金属离子向植物体的转移。Park等[38]发现溶磷细菌Enterobactersp.与磷矿粉的联合使用可以很好地实现重金属铅的固定,主要是磷氯铅矿的形成导致的。Guo等[39]研究发现解磷细菌Bradyrhizobiumsp.YL-6提高大豆矿质营养Fe吸收从而减少大豆根茎中Cd的积累。L44菌株具有解磷能力,进一步研究该菌株是否溶解磷矿粉或磷酸钙时固定铅、或能否改善植物Fe营养从而稳定土壤中重金属并阐明其机制,可以为解释菌株降低辣椒果实重金属含量的作用机理提供基础。
农田土壤受到不同程度的重金属污染,必须采取不同措施进行修复并保障农产品安全生产。对高度污染土壤而言,植物提取或休耕等策略比较可行;而对轻度或中度污染土壤,原位重金属稳定化修复备受关注,已有许多修复材料正被研发应用。梁学峰等[40]在田间示范条件下应用海泡石磷肥复配和海泡石硅肥复配处理后,发现糙米镉含量最大降幅约为72.7%,分别降低至 0.33 mg·kg-1和 0.34 mg·kg-1,但复配处理组糙米镉含量最低值仍然超过现行国家标准最大限量值。方至萍等[41]通过低积累水稻品种与钝化材料相结合,增加海泡石用量达到9.00 g·kg-1土时,嘉33精米中的Pb、Cd含量才能低于国家的限量指标(GB 2762—2017)。陈玲[42]比较了单一菌剂、化学修复剂、菌剂-化学修复剂复配减少蔬菜重金属含量的效果,发现复配制剂的效果好于单一菌剂和化学修复剂。本研究中接种B.megaterium L44使辣椒果实中的Cd和Pb含量显著降低,但还未达到现行国家标准蔬菜安全的限量值,进一步开展功能菌株与磷酸钙、海泡石、生物炭等的复配和相互作用研究,配合低积累辣椒品种应用,有望为阻控辣椒吸收重金属、安全生产提供有效技术途径和理论基础。
4 结论
(1)从生长于南京某矿区周边农田的辣椒和圣女果的根际土壤中筛选到7株能分泌胞外多糖、IAA和铁载体、耐受Cd和Pb的芽孢杆菌。
(2)B.megaterium L44菌株接种处理的辣椒果实Cd和Pb含量分别显著降低39.1%和81.3%,接近食品安全国家标准限量要求,具有阻控辣椒吸收重金属的潜在应用价值。
[1]周建军,周 桔,冯仁国.我国土壤重金属污染现状及治理战略[J].中国科学院院刊,2014,29(3):315-320.
ZHOU Jian-jun,ZHOU Ju,FENG Ren-guo.Status of China′s heavy metal contamination in soil and its remediation strategy[J].Chinese A-cademy of Sciences,2014,29(3):315-320.
[2]李精超,胡小凤,李文一,等.设施蔬菜基地土壤重金属污染分析及防治研究[J].中国农学通报,2010,26(18):393-396.
LI Jing-chao,HU Xiao-feng,LI Wen-yi,et al.Study of heavy metals pollution analysis and control in protected vegetable base soil[J].Chinese Agricultural Science Bulletin,2010,26(18):393-396.
[3]崔晓峰,李淑仪,丁效东,等.珠江三角洲地区典型菜地土壤与蔬菜重金属分布特征研究[J].生态环境学报,2012,21(1):130-135.
CUI Xiao-feng,LI Shu-yi,DING Xiao-dong,et al.Contents of heavy metals in soil and vegetables at typical vegetable plot in the Pearl River Delta[J].Ecology and Environmental Sciences,2012,21(1):130-135.
[4]李书幻,温祝桂,陈亚茹,等.我国蔬菜重金属污染现状与对策[J].江苏农业科学,2016,44(8):231-235.
LI Shu-huan,WEN Zhu-gui,CHEN Ya-ru,et al.The status and countermeasures of heavy metal pollution in vegetables in China[J].Journal of Jiangsu Agricultural Sciences,2016,44(8):231-235.
[5]黄益宗,郝晓伟,雷 鸣,等.重金属污染土壤修复技术及其修复实践[J].农业环境科学学报,2013,32(3):409-417.
HUANG Yi-zong,HAO Xiao-wei,LEI Ming,et al.The remediation technology and remediation practice of heavy metals-contaminated soil[J].Journal of Agro-Environment Science,2013,32(3):409-417.
[6]李剑睿,徐应明,林大松,等.农田重金属污染原位钝化修复研究进展[J].生态环境学报,2014,23(4):721-728.
LI Jian-rui,XU Ying-ming,LIN Da-song,et al.In situ immobilization remediation of heavy metals in contaminated soils:A review[J].Ecology and Environmental Sciences,2014,23(4):721-728.
[7]王陈丝丝,马友华,陈倩倩,等.钝化剂对农田土壤重金属形态与其稳定性影响研究[J].中国农学通报,2016,32(1):172-177.
WANG Chen-si-si,MA You-hua,CHEN Qian-qian,et al.Effect of passivation agent on morphology and stability of heavy metals in cropland soil[J].Chinese Agricultural Science Bulletin,2016,32(1):172-177.
[8]Lombi E,Zhao F J,Zhang G Y,et al.In situ fixation of metals in soils using bauxite residue:Chemical assessment[J].Environmental Pollution,2002,118(3):435-443.
[9]Lee S H,Lee J S,Choi Y J,et al.In situ stabilization of cadmium-,lead-,and zinc-contaminated soil using various amendments[J].Chemosphere,2009,77(8):1069-1075.
[10]Yang J,Kloepper J W,Ryu C M.Rhizosphere bacteria help plants tolerate abiotic stress[J].Trends in Plant Science,2009,14(1):1-4.
[11]Chen Y M,Chao Y Q,Li Y Y,et al.Survival strategies of the plant-associated bacterium Enterobactersp.strain EG16 under cadmium stress[J].Applied and Environmental Microbiology,2016,82(6):1734-1744.
[12]陈亚刚,陈雪梅,张玉刚,等.微生物抗重金属的生理机制[J].生物技术通报,2009,25(10):60-65.
CHEN Ya-gang,CHEN Xue-mei,ZHANG Yu-gang,et al.The physiological mechanism of microbial heavy metals tolerance[J].Biotechnology Bulletin,2009,25(10):60-65.
[13]Park J H,Bolan N,Megharaj N,et al.Isolation of phosphate solubilizing bacteria and their potential for lead immobilization in soil[J].Journal of Hazardous Materials,2011,185:829-836.
[14]Wang X H,Nie Z W,He L Y,et al.Isolation of As-tolerant bacteria and their potentials of reducing As and Cd accumulation of edible tissues of vegetables in metal(loid)-contaminated soils[J].Science of the Total Environment,2016,579:179-189.
[15]Chen L,He L Y,Wang Q,et al.Synergistic effects of plant growthpromoting Neorhizobium huautlense T1-17 and immobilizers on the growth and heavy metal accumulation of edible tissues of hot pepper[J].Journal of Hazardous Materials,2016,312:123-131.
[16]姚荣江,杨劲松,谢文萍,等.江苏沿海某设施农区土壤重金属累积特点及生态风险评价[J].农业环境科学学报,2016,35(8):1498-1506.
YAO Rong-jiang,YANG Jin-song,XIE Wen-ping,et al.Accumulation and potential ecological risk assessment of heavy metals in greenhouse soils from coastal area of Jiangsu Province[J].Journal of Agro-Environment Science,2016,35(8):1498-1506.
[17]刘 峰,弭宝彬,魏瑞敏,等.基于聚类分析法筛选低镉累积辣椒品种[J].园艺学报,2017,44(5):979-986.
LIU Feng,MI Bao-bin,WEI Rui-min,et al.Screening out of Cd-pollution-safe pepper cultivars by clustering analysis[J].Acta Horticulturae Sinica,2017,44(5):979-986.
[18]Dubois M,Gilles K A,Hamilton J K,et al.Colorimetric method for determination of sugars and related substances[J].Analytical Chemistry,1955,28(3):350-356.
[19]Gordon S A,Weber R P.Colorimetric estimation of indoleacetic acid[J].Plant Physiology,1951,26(1):192.
[20]Mayer A M.Determination of indole acetic acid by the Salkowsky reaction[J].Nature,1958,182(4650):1670-1671.
[21]Schwyn B,Neilands J B.Universal chemical assay for the detection and determination of siderophores[J].Analytic Biochemistry,1987,160:47-56.
[22]Liu Z G,Li Y C,Zhang S A,et al.Characterization of phosphate-solubilizing bacteria isolated from calcareous soils[J].Applied Soil Ecology,2015,96:217-224.
[23]颜子颖,王海林.精编分子生物学实验指南[M].北京:科学出版社,1998:37-39.
YAN Zi-ying,WANG Hai-lin.Molecular biology experiment guide[M].Beijing:Science press,1998:37-39.
[24]Lane D J.16S/23S rRNA sequencing[M]//Stackebrandt E,Good fellow M.Eds.Nucleic acid techniques in bacterial systematics.Chichester:Wiley,1991:115-175.
[25]郜金荣.分子生物学实验指导[M].武汉:武汉大学出版社,2007:83-85.
GAO Jin-rong.Molecular biology experimental guidance[M].Wuhan:Wuhan University Press,2007:83-85.
[26]陈生涛,何琳燕,李 娅,等.Rhizobium sp.W33对不同植物吸收铜和根际分泌物的影响[J].环境科学学报,2014,34(8):2077-2084.CHEN Sheng-tao,HE Lin-yan,LI Ya,et al.Effects of Rhizobium sp.
W33 on absorption of copper and rhizosphere secretions from different plants[J].Acta Scientiae Circumstantiae,2014,34(8):2077-2084.
[27]Hajdu R,Slaveykova V I.Cd and Pb removal from contaminated environment by metal resistant bacterium Cupriavidus metallidurans CH34:Importance of the complexation and competition effects[J].Environmental Chemistry,2012,9(4):389-398.
[28]Wang J,Li Q,Li M M,et al.Competitive adsorption of heavy metal by extracellular polymeric substances(EPS)extracted from sulfate reducing bacteria[J].Bioresource Technology,2014,163(7):374-376.
[29]刘丹丹,李 敏,刘润进.我国植物根围促生细菌研究进展[J].生态学杂志,2016,35(3):815-824.
LIU Dan-dan,LI Min,LIU Run-jin.Recent advances in the study of plant growth-promoting rhizobacteria in China[J].Chinese Journal of Ecology,2016,35(3):815-824.
[30]张梦琦,陈云云,张 熙,等.多功能植物根际促生菌DD3的功能特性及对大蒜幼苗的促生效果[J].植物营养与肥料学报,2017,23(3):748-756.
ZHANG Meng-qi,CHEN Yun-yun,ZHANG Xi,et al.Characterizations of rhizobacteria DD3 and their growth promoting effect on garlic seedlings[J].Journal of Plant Nutrition and Fertilizer,2017,23(3):748-756.
[31]张 杨,文春燕,赵买琼,等.辣椒根际促生菌的分离筛选及生物育苗基质研制[J].南京农业大学学报,2015,60(6):950-957.
ZHANG Yang,WEN Chun-yan,ZHAO Mai-qiong,et al.Isolation of plant growth promoting rhizobacteria from pepper and development of bio-nursery substrates[J].Journal of Nanjing Agricultural University,2015,60(6):950-957.
[32]Joo G J,Kim Y M,Lee I J,et al.Growth promotion of red pepper plug seedlings and the production of gibberellins by Bacillus cereus,Bacillus macroides and Bacillus pumilus[J].Biotechnology Letters,2004,26(6):487-491.
[33]张宗迪,崔夏倩,杨延斌,等.不同微生物制剂对土壤中结合态Zn稳定性的影响[J].上海交通大学学报(农业科学版),2017,35(03):70-75,89.
ZHANG Zong-di,CUI Xia-qian,YANG Yan-bin,et al.Effect and mechanism of different microbial preparations on stability of Zn in soil[J].Journal of Shanghai Jiaotong University(Agricultural Science Edition),2017,35(3):70-75,89.
[34]洪 晨,李益飞,司艳晓,等.土壤芽孢杆菌产胞外聚合物对Pb2+吸附特性研究[J].中国环境科学,2017,37(5):1805-1813.
HONG Chen,LI Yi-fei,SI Yan-xiao,et al.Pb2+adsorption features of extracellular polymeric substance producted by a Brevibacillus agristrain[J].China Environmental Science,2017,37(5):1805-1813.
[35]Wei D,Lia M T,Wang X D,et al.Extracellular polymeric substances for Zn(Ⅱ)binding during its sorption process onto aerobic granular sludge[J].Journal of Hazardous Materials,2016,301:407-415.
[36]王泽煌,王 蒙,蔡昆争,等.细菌对重金属吸附和解毒机制的研究进展[J].生物技术通报,2016,32(12):13-19.
WANG Ze-huang,WANG Meng,CAI Kun-zheng,et al.Research advances on biosorption and detoxification mechanisms of heavy metals by bacteria[J].Biotechnology Bulletin,2016,32(12):13-19.
[37]余劲聪,何舒雅,曾润颖,等.芽孢杆菌修复土壤重金属镉污染的研究进展[J].广东农业科学,2016,43(1):73-78.
YU Jin-cong,HE Shu-ya,ZENG Run-ying,et al.Research progress in remediation of cadmium contaminated soil with Bacillus[J].Guangdong Agricultural Sciences,2016,43(1):73-78.
[38]Park J H,Bolan N,Megharaj N,et al.Concomitant rock phosphate dissolution and lead immobilization by phosphate solubilizing bacteria(Enterobacter sp.)[J].Journal of Environmental Management,2011,92:1115-1120.
[39]Guo J K,Chi J.Effect of Cd-tolerant plant growth-promoting rhizobium on plant growth and Cd uptake by Lolium multiflorum Lam.and Glycine max(L.) Merr.in Cd-contaminated soil[J].Plant Soil,2014,375:205-214.
[40]梁学峰,韩 君,徐应明,等.海泡石及其复配原位修复镉污染稻田[J].环境工程学报,2015,9(9):4571-4577.
LIANG Xue-feng,HAN Jun,XU Ying-ming,et al.In situ remediation of Cd polluted paddy soil using sepiolite and combined amendments[J].Chinese Journal of Environmental Engineering,2015,9(9):4571-4577.
[41]方至萍,廖 敏,张 楠,等.铅镉复合污染土壤施用海泡石对铅、镉在土壤-水稻系统中迁移与再分配的影响[J].环境科学,2017,38(7):3028-3035.
FANG Zhi-ping,LIAO Min,ZHANG Nan,et al.Effect of sepiolite application on the migration and redistribution of Pb and Cd in soil rice system in soil with Pb and Cd combined contamination[J].Environmental Science,2017,38(7):3028-3035.
[42]陈 玲.植物促生细菌Rhizobiumsp.T1-17对蔬菜重金属消减作用的效果及其机制研究[D].南京:南京农业大学,2015.
CHEN Ling.Effects of Rhizobiumsp.T1-17 on heavy metal absorption in vegetables and its mechanism[D].Nanjing:Nanjing Agricultural U-niversity,2015.
