镉胁迫下硅对水稻幼苗生长与生理响应的影响
2018-06-28李天哲陈爱婷刘鸣达
李天哲,陈爱婷,李 彩,杨 丹,何 娜,刘鸣达
(沈阳农业大学土地与环境学院,沈阳 110866)
工业“三废”的排放以及含镉农药、肥料的不合理使用,导致农田土壤镉污染加剧,进而影响农产品质量安全,对人类健康的潜在威胁日益加重。2014年发布的《全国土壤污染状况调查公报》显示,镉居耕地重金属污染首位[1]。镉为非必需营养元素,微量即具有极强致毒性,可导致人体肾脏损害[2],并对心血管、肌肉骨骼系统和女性生殖系统造成影响[3]。因此,治理农田土壤镉污染,保障农产品安全具有重大意义。
镉的活性受土壤理化性质影响极大,不同类型土壤中镉的植物毒性阈值不同[4],通常土壤镉积累到一定程度,便会对植物产生毒害作用。其毒害首先体现在分子水平上,诱导植物体内活性氧(ROS)合成积累,造成原生质膜、细胞器等损伤,致使其生理指标发生变化,表现出中毒症状,抑制其生长。关于硅可增强作物对镉胁迫的抗性和耐受性,已得到各国学者广泛认同[5-6]。其生物学机制包括四方面:一是硅抑制水稻对镉的吸收和转运,提高产量降低稻米镉积累[7];二是硅能够激活水稻的抗氧化防御体系[8],改变镉胁迫下抗氧化酶活性[9],缓解镉对细胞质膜的伤害[10],降低ROS损伤;三是硅还可减缓镉对玉米、白菜超微结构的破坏,使细胞器更加完整,并提高叶绿素含量、叶绿素a/b比值和叶片气孔导度,促进光合作用[11-12];四是植物体内的硅与镉螯合形成共沉淀或代谢成失活产物来减轻镉毒害[5]。
前人已对硅缓解水稻镉毒害作用进行了广泛的研究,但水培或土培试验所用含硅物料多为硅酸盐或炉渣等碱性物质,这些物质不但改变了介质的pH,而且引入了伴随阳离子[13],这些伴随阳离子也可降低镉的生物有效性[14];另一方面从细胞超微结构角度,探讨硅缓解镉对水稻毒害作用机理尚鲜有报道。故本文通过水培试验,在消除pH和伴随阳离子影响的基础上,从水稻幼苗生物量、叶片抗氧化酶活性和细胞超微结构三方面入手,研究镉胁迫下硅对水稻幼苗生长与生理响应的影响,以期揭示硅缓解水稻镉毒害作用机制。
1 材料与方法
1.1 供试材料
供试作物为水稻(Oryza sativa L.),品种为“辽粳9”。试验所用硅为硅酸钠(Na2SiO3·9H2O,含 SiO221%),镉为氯化镉(CdCl2·2.5H2O)。水培营养液根据国际水稻研究所常规营养液的配方配制[15],其组分为(mg·L-1):NH4NO3114.3、NaH2PO4·2H2O 50.4、K2SO489.3、CaCl2158.2、MgSO4·7H2O 405、MnCl2·4H2O 1.875、(NH4)6·Mo7O24·2H2O 0.093、H3BO31.167、ZnSO4·7H2O 0.044、CuSO4·5H2O 0.039、FeCl3·6H2O 9.625、柠檬酸水合物14.875。试验所用药品均为分析纯试剂。
1.2 水培试验
本试验于2016年8—9月在沈阳农业大学污染土壤修复与利用实验室进行。设置5个处理,除对照组CK外,各处理营养液中镉初始浓度均为1 mg·L-1,按施硅量(以 SiO2计)分别为 0、50、100、150 mg·L-1,用 Si 0、Si 50、Si 100 和 Si 150 表示。用 HNO3中和Na2SiO3的碱性,并以Si 150处理为标准,所有处理间Na+和NO-3的差异用NaNO3补齐;每组处理3次重复。
首先筛选籽粒饱满的水稻种子,于10%H2O2中消毒15 min,再用纯水洗净后在(30±2)℃黑暗环境催芽24 h,待种子萌发后播于铺满湿纱布的方盘中育苗;待两叶一心期,选择健壮、均一的秧苗移植于含镉和硅的营养液(3 L)中,每个重复10株,在Blue pard MGC-450BP光照培养箱(上海一恒)中培养,光照强度 300 μmol·m-2·s-1,昼夜时间和温度分别为 16/8 h和28/20℃。每7 d更换一次营养液,培养35 d后取出培养皿中水稻样品,用纯水洗净并用滤纸擦干植株表面水分后备用。取15株水稻幼苗测生物量,5~10株测酶活指标,5株观察细胞超微结构。
1.3 测定方法
1.3.1 水稻幼苗生物量的测定
采集新鲜水稻样品,用卷尺测量根颈部至幼苗顶端叶尖,即为株高;测量根尖到幼苗茎基部的长度,即为根长;株高、根长均10次重复。将样品清洗干净并吸干其表面水分,将茎叶和根部分开,于105℃杀青、75℃烘干至恒质量,并称量其干质量;每组称质量5株,3次重复。
1.3.2 水稻幼苗叶片生理生化指标的测定
CAT活性:过氧化氢滴定法;POD活性:愈创木酚比色法;MDA:硫代巴比妥酸比色法[16]。
1.3.3 水稻幼苗叶片超微结构的观测
采集各处理水稻幼苗并用纯水洗净后擦干,选取相同部位叶片切成1 mm×1 mm小块,将其置于预冷的2.5%戊二醛中真空固定4 h(4℃),然后用0.1 mol·L-1磷酸缓冲液(pH=7.2)清洗 20 min(重复 3次),接着再将其转移至1%锇酸中固定4 h(4℃),然后取出以乙醇、丙酮梯度脱水,再用SPI-812树脂包埋、浸透后用LeicaUC6超薄切片机切片(60~80 nm),最终用醋酸铀-柠檬酸铅在室温下(25℃)进行双染色后以纯水洗净后备用。
将样品用日立H-7650透射电镜观察并以Gatan832数字成像系统拍照[17]。
1.4 数据处理
试验数据采用SPSS 22.0和Origin 9.0软件进行统计分析和绘图。
2 结果与讨论
2.1 硅对镉胁迫下水稻幼苗生长的影响
株高、根长、干质量等指标是衡量水稻幼苗生长的重要指标。为了解镉胁迫下硅对水稻幼苗生长的影响,在水培试验结束后拍摄了不同处理的照片(图1),并测定了水稻幼苗的株高、根长、干质量(表1)。
由图1可以看出,CK处理的水稻幼苗长势最好,株高较高、茎叶粗壮、主根较长且侧根较多;加镉后Si 0处理中水稻幼苗矮小、根长较短且侧根少、叶片稀少泛黄且有衰老迹象;Si 50、Si 100、Si 150处理的水稻幼苗的生长状况有明显改善,生物量显著增加。由表1可知施硅显著地增加了水稻幼苗的株高、根长,提高了干质量。这表明施硅能缓解镉对水稻幼苗的毒害[5,9],促进其生长,且随施硅量的增加,其缓解作用愈加明显。

图2 镉胁迫下施硅对水稻叶片CAT活性的影响Figure2 Effects of Si application on catalase activity in rice leaves under Cd stress

图1 镉胁迫下施硅对水稻幼苗生长的影响Figure1 Effect of Si application on growth and development of rice seedlings under Cd stress

表1 镉胁迫下施硅对水稻生物量的影响Table1 Effect of silicon application on biomass of rice under Cd stress
2.2 硅对镉胁迫下水稻叶片过氧化氢酶活性的影响
镉胁迫下植物体内的H2O2等ROS代谢会加强并大量积累,可氧化细胞内核酸和蛋白质等生物大分子,对原生质膜以及多种细胞器造成损伤。过氧化氢酶(CAT)是植物体内一种重要的抗氧化酶,可专性分解其体内的H2O2,确保机体内环境稳定,在一定程度上缓解其因逆境胁迫带来的过氧化危害。镉胁迫下施加不同浓度硅对水稻幼苗叶片中CAT活性影响如图2所示,与CK处理相比,镉胁迫可抑制水稻叶片中CAT活性(P<0.05);施硅处理与 Si 0相比,镉胁迫下施硅可提高其CAT活性(P<0.05),且随施硅量的增加,CAT活性呈上升趋势,这与Srivastava等[9]的研究结果相一致。
CK处理中CAT活性处于较高水平,而Si 0处理中其处于较低水平,说明镉抑制了CAT活性。研究表明,镉胁迫下水稻抗氧化酶活性的升高或降低,取决于其受胁迫的应激强度和持续时间[6,18]。虽然水稻在镉胁迫下生成大量H2O2[10],而CAT活性降低,可能其与暴露机体内的高浓度镉较长时间直接作用,诱导CAT失活有关;或由于其合成酶的蛋白质组减少或受损导致[11]。施硅使CAT活性升高,可能由于CAT对H2O2的亲和力较低,只能清除高浓度的H2O2有关[19];还可能由于硅促进了水稻幼苗CAT的表达,从而使其活性显著增加,缓解了镉对水稻的毒害程度。

图3 镉胁迫下施硅对水稻叶片POD活性的影响Figure3 Effects of Si application on peroxidase activity in rice leaves under Cd stress

图4 镉胁迫下施硅对水稻叶片MDA含量的影响Figure4 Effects of Si application on the content of MDA in rice leaves under Cd stress
2.3 硅对镉胁迫下水稻叶片过氧化物酶活性的影响
过氧化物酶(POD)对底物无专一性,除了可清除H2O2外,还可氧化酚类和胺类化合物,参与植保素的合成,缓解植物因逆境胁迫带来的危害。特别地,POD还是酚类氧化代谢过程中的关键酶,参与酚类物质形成木质素最后的聚合反应,对木质素的合成具有关键作用。
镉胁迫下施加不同浓度硅对水稻幼苗叶片POD活性的影响如图3所示,可以看出,CK处理中POD活性处于相对较低水平,镉胁迫(Si 0)可使水稻叶片中POD活性显著升高(P<0.05);与Si 0处理相比,镉胁迫下施硅可显著降低水稻叶片中POD活性(P<0.05),且随施硅量的增加活性呈下降趋势。究其原因,可能由于水稻受镉胁迫,体内具有较高氧化性[10],并发生应激生理反应,产生大量POD去分解过氧化物;或是参与合成大量木质素[20],使其自身木质化增强,对镉的毒害建立生理屏障,增强其抗逆能力,故而Si 0处理POD活性处于较高水平。施硅降低水稻叶片木质素的合成,缓解其因镉毒害引起的POD大量产生,使其早衰的程度有所缓解,促进水稻生长[21],所以水稻叶片中POD活性随着施硅量增加而逐渐降低。
2.4 硅对水稻幼苗叶片丙二醛含量的影响
丙二醛(MDA)是膜脂质过氧化作用的最终产物,会造成核酸、蛋白质等生物大分子的交联聚合,线粒体呼吸链的损伤以及纤维分子之间桥键的松弛等,是间接反映细胞膜脂过氧化程度的指标。
镉胁迫下硅对水稻幼苗叶片MDA含量的影响如图4所示。与CK处理相比,镉可使水稻幼苗叶片中MDA含量处于相对较高水平(P<0.05);与Si 0处理相比,施硅可显著降低镉胁迫下水稻叶片中MDA含量(P<0.05),且随施硅量的增加其含量降低。Si 0处理中,MDA处于相对较高水平,说明镉胁迫诱导水稻的膜脂过氧化程度较高,质膜受到的伤害较严重,且水稻向木质化发展,出现早衰现象(如图1)。施硅处理使MDA含量显著降低,说明硅可以有效缓解细胞的膜脂过氧化作用[10],缓解镉毒害。如前文所述,硅通过影响抗氧化酶(CAT、POD)活性和MDA含量,缓解了膜脂过氧化作用,降低木质素的产生,从而在一定程度上减轻了水稻因高ROS带来的伤害。
2.5 硅对水稻叶片细胞超微结构的影响
镉胁迫下不同硅水平处理水稻叶片细胞的透射电镜照片如图5所示。可以看出,CK处理中,水稻幼苗叶肉细胞形状规则,无质壁分离现象,叶绿体较多且较饱满、基质片层较多,线粒体较多且紧挨叶绿体;Si 0处理中,细胞发生质壁分离,部分叶绿体的基质片层松散、空间增大,嗜锇颗粒数量较多、体积膨大[22]。Si 50~Si 150处理中,线粒体、淀粉粒数目逐渐增多,嗜锇颗粒数量逐渐减少、体积缩小,叶绿体逐渐向细胞壁靠拢,最后紧贴细胞壁边缘。说明硅有助于维持细胞的完整性、稳定性。
研究表明,嗜锇颗粒在过强的脂质过氧化作用下大量存在[22],而脂质过氧化是形成氧自由基的连锁反应,会造成细胞损伤。前文提到硅降低了水稻体内MDA含量,减弱了脂质过氧化作用,从而减轻了镉对细胞的损伤;施硅后嗜锇颗粒数目减少、体积缩小,从细胞内部微形态改善的角度印证了硅的这一作用,这与Xu等[23]的研究结果相一致。

图5 镉胁迫下施硅对水稻叶片细胞的影响Figure5 Effect of Si application on leaf cells of rice under Cd stress
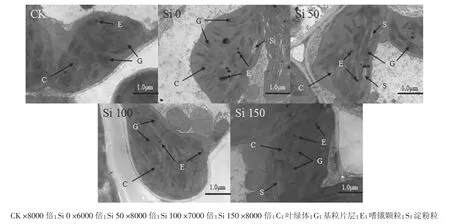
图6 镉胁迫下施硅对水稻叶片细胞叶绿体的影响Figure6 Effect of Si application on chloroplast of rice leaves under Cd stress
细胞中线粒体的数目随施硅量的增加逐渐增多,说明水稻呼吸旺盛,代谢活跃。施硅使线粒体向叶绿体紧密靠近,二者甚至处于嵌合状态,这种结构可促进叶绿体和线粒体间的气体互换,并可通过线粒体的呼吸作用减轻叶绿体的过氧化伤害。
图6为不同处理水稻叶片叶绿体的透射电镜照片,可以看出,CK处理的叶绿体中嗜锇颗粒呈规则圆形且数量较少,基质片层较多、排列走向与叶绿体长轴方向相一致;Si 0处理中嗜锇颗粒膨大且多,基质变淡,部分基质片层松散,基粒片层模糊、排列紊乱且方向不一致;随施硅量的增加,嗜锇颗粒逐渐变小、变少,片层结构逐渐清晰、排列逐渐整齐。
类囊体是叶绿体的片层膜系统,其膜上集中着光合色素和氧化还原酶类。正常情况下,ROS的产生和消除处于动态平衡,当水稻受到镉胁迫,动态平衡将会打破,导致叶绿体片层结构受到损伤,进而影响其光合作用。施硅后片层结构逐渐恢复、解体现象得到缓解,膜系统趋于正常,说明硅缓解了镉对叶绿体的破坏,使水稻叶片的光合功能逐步恢复[24]。
各处理水稻叶片细胞线粒体的透射电镜照片如图7所示,可以看出,CK处理中,线粒体双层膜结构清晰完整,嵴数目较多;Si 0处理线粒体双层膜结构部分解体、消失,嵴数量较少;随施硅量的增加,线粒体双层膜解体现象逐渐缓解,结构趋于完整,嵴膨胀现象仍存在,但嵴数量明显增加。施硅后线粒体双层膜结构逐渐恢复,嵴的数目增多,三羧酸循环酶附着的内膜表面积增加,从而使能源物质有效转化成ATP,呼吸作用逐步加强,最终增强水稻的抗镉胁迫能力。

图7 镉胁迫下施硅对水稻叶片细胞线粒体的影响Figure7 Effect of Si application on mitochondrion of rice leaves under Cd stress
3 结论
镉胁迫下,施硅提高了水稻植株CAT活性,降低了POD活性和MDA含量,缓解了膜脂过氧化和木质化作用,使叶片细胞结构趋于完整、有序,叶绿体及淀粉粒数目增多、嗜锇颗粒减少并变小、片层排列逐渐整齐,线粒体及其嵴的数目增多、双层膜结构逐渐恢复,促进了水稻幼苗生长,增强了其抗镉胁迫能力。本试验结果表明,硅施加量为150 mg·L-1时,水稻幼苗缓解镉胁迫效果最好。
[1]环境保护部,国土资源部.全国土壤污染状况调查公报[J].中国环保产业,2014(5):10-11.
Ministry of Environmental Protection of the PRC,Ministry of Land and Resources of the PRC.National bulletin on soil pollution status[J].China Environmental Protection,2014(5):10-11.
[2]Satarug S,Vesey D A,Gobe G C.Kidney cadmium toxicity,diabetes and high blood pressure:The perfect storm[J].The Tohoku Journal of Experimental Medicine,2017,241(1):65-87.
[3]Peraltavidea J R,Lopez M L,Narayan M,et al.The biochemistry of environmental heavy metal uptake by plants:Implications for the food chain[J].International Journal of Biochemistry&Cell Biology,2009,41(9):1665-1677.
[4]Lu J H,Yang X P,Meng X C,et al.Predicting cadmium safety thresholds in soils based on cadmium uptake by Chinese cabbage[J].Pedosphere,2017,27(3):475-481.
[5]Adrees M,Ali S,Rizwan M,et al.Mechanisms of silicon-mediated alleviation of heavy metal toxicity in plants:A review[J].Ecotoxicology&Environmental Safety,2015,119:186.
[6]刘彩凤,史刚荣,余如刚,等.硅缓解植物镉毒害的生理生态机制[J].生态学报,2017,37(23):7799-7810.
LIU Cai-feng,SHI Gang-rong,YU Ru-gang,et al.Eco-physiological mechanisms of silicon-induced alleviation of cadmium toxicity in plants:A review[J].Acta Ecologica Sinica,2017,37(23):7799-7810.
[7]彭 华,田发祥,魏 维,等.不同生育期施用硅肥对水稻吸收积累镉硅的影响[J].农业环境科学学报,2017,36(6):1027-1033.
PENG Hua,TIAN Fa-xiang,WEI Wei,et al.Effects of silicon fertilizer applicantion on the cadmium and silicon content of rice at different growth stages[J].Journal of Agro-Environment Science,2017,36(6):1027-1033.
[8]王会方,於朝广,王 涛,等.硅缓解植物重金属毒害机理的研究进展[J].云南农业大学学报(自然科学),2016(3):528-535.
WANG Hui-fang,YU Chao-guang,WANG Tao,et al.The research progresses on mitigative mechanism of silicon on heavy metal toxicity in plant[J].Journal of Yunnan Agricultural University(Natural Science),2016(3):528-535.
[9]Srivastava R K,Pandey P,Rajpoot R,et al.Exogenous application of calcium and silica alleviates cadmium toxicity by suppressing oxidative damage in rice seedlings[J].Protoplasma,2015,252(4):959-975.
[10]Hasanuzzaman M,Nahar K,Anee T I,et al.Exogenous silicon attenuates cadmium-induced oxidative stress in Brassica napus L.by modulating AsA-GSH pathway and glyoxalase system[J].Frontiers in Plant Science,2017,8:1-9.
[11]Vaculík M,PavlovicˇA,Lux A.Silicon alleviates cadmium toxicity by enhanced photosynthetic rate and modified bundle sheath′s cell chloroplasts ultrastructure in maize[J].Ecotoxicology&Environmental Safety,2015,120(9):66.
[12]宋阿琳,李 萍,李兆君,等.硅对镉胁迫下白菜光合作用及相关生理特性的影响[J].园艺学报,2011,38(9):1675-1684.
SONG A-lin,LI Ping,LI Zhao-jun,et al.Effect of silicon on photosynthesis and its related physiological parameters of Brassica campestris L.ssp.Chinensis(L.)Makino grown under Cd stress[J].Acta Horticulturae Sinica,2011,38(9):1675-1684.
[13]刘鸣达,李 彩,赵玉婷,等.硅对不同pH水田土壤吸附-解吸镉的影响[J].农业环境科学学报,2017,36(4):672-677.
LIU Ming-da,LI Cai,ZHAO Yu-ting,et al.Effect of added silicon on adsorption-desorption characteristics of cadmium on paddy soil with different pH[J].Journal of Agro-Environment Science,2017,36(4):672-677.
[14]周 卫,汪 洪,李春花,等.添加碳酸钙对土壤中镉形态转化与玉米叶片镉组分的影响[J].土壤学报,2001,38(2):219-225.
ZHOU Wei,WANG Hong,LI Chun-hua,et al.Effect of calcium carbonate addition on transformation of cadmium species in soil and cadmium in leaves of maize[J].Acta Pedologica Sinica,2001,38(2):219-225.
[15]李昌纬.农业化学研究法:上册[M].北京:农业出版社,1980.
LI Chang-wei.Agricultural chemical research methods:Volume one[M].Beijing:Agriculture Press,1980.
[16]王学奎.植物生理生化实验原理和技术[M].北京:高等教育出版社,2006:134-281.
WANG Xue-kui.Plant physiological and biochemical principles and techniques[M].Beijing:Higher Education Press,2006:134-281.
[17]刘仁林,虞功清,邹伟民,等.植物透射电镜样品制备技术的改进[J].江西林业科技,2008(1):41-43.
LIU Ren-lin,YU Gong-qing,ZOU Wei-min,et al.Improvements in technique of madding ultrathin section for transmission electron microscope[J].Jiangxi Forestry Science and Technology,2008(1):41-43.
[18]Liu H,Zhang C,Wang J,et al.Influence and interaction of iron and cadmium on photosynthesis and antioxidative enzymes in two rice cultivars[J].Chemosphere,2017,171:240-247.
[19]简令成.逆境植物细胞生物学[M].北京:科学出版社,2009.
JIAN Ling-cheng.Adversary plant cell biology[M].Beijing:Science Press,2009.
[20]Liu Q Q,Zheng L,He F,et al.Transcriptional and physiological analyses identify a regulatory role for hydrogen peroxide in the lignin biosynthesis of copper-stressed rice roots[J].Plant and Soil,2015,387(1/2):323-336.
[21]Liu J G,Zhang H M,Zhang Y X,et al.Silicon attenuates cadmium toxicity in Solanum nigrum L.by reducing cadmium uptake and oxidative stress[J].Plant Physiology&Biochemistry,2013(68):1-7.
[22]Li S,Wang Y,Mahmood Q,et al.Cu induced changes of ultrastructure and bioaccumulation in the leaf of Moso bamboo(Phyllostachys Pubescens)[J].Journal of Plant Nutrition,2018,41(3):288-296.
[23]Xu L,Faisal I,Basharat A,et al.Silicon and water-deficit stress differentially modulatephysiology and ultrastructure in wheat(Triticum aestivum L.)[J].3 Biotech,2017,7(4):273-286.
[24]Ali S,Farooq M A,Yasmeen T,et al.The influence of silicon on barley growth,photosynthesis and ultra-structure under chromium stress[J].Ecotoxicology&Environmental Safety,2013,89(11):66-72.
