H2S和NO在大白菜抵抗高温胁迫中的作用
2018-06-28解梦洁张丽萍金竹萍刘旦梅裴雁曦
解梦洁,贺 烽,张丽萍,金竹萍,刘旦梅,裴雁曦
(山西大学生命科学学院,太原 030006)
植物对环境胁迫的承受和适应能力,是当前植物生理生态研究的热点之一。随着全球温室效应加剧,高温对植物生长的影响也日趋显著。高温胁迫可能扰乱细胞内稳态,造成植物叶片萎蔫、植物体生长发育迟缓、甚至死亡[1]。
长期以来,一氧化氮(Nitric oxide,NO)被认为是一种大气污染物,直到20世纪80年代,美国药理学家Furchgott等发现血管内皮细胞在乙酰胆碱等作用下产生了一种新型血管内皮细胞松弛因子(Endothelium-derived relaxing factor,EDRF),这种因子就是NO。至此,有关NO信号分子作用的研究得到快速发展[2]。作为重要的气体信号分子,NO参与植物的多种生理过程,如种子萌发、叶的伸展、根生长、去黄化、花的形成、果实的成熟及衰老等,同时也通过多种信号通路提高植物对生物和非生物胁迫的耐受性,研究表明,NO可以通过与H2O2和水杨酸共同作用,提高水稻幼苗抵抗盐胁迫的能力[1-3]。此外,有报道称,NO在胁迫期间还可触发全身生物反应[2]。
硫化氢(Hydrogen sulfide,H2S)在植物体生长发育及胁迫响应中的生理作用也受到广泛关注[4]。早在20世纪80年代就发现植物体可以释放H2S,但其生理功能近年来才逐渐被揭示。研究表明,H2S供体硫氢化钠(NaHS)可以缓解甘薯叶片中叶绿素浓度的下降。另外,喷洒NaHS可以增加抗氧化酶、超氧化物歧化酶、过氧化氢酶和抗坏血酸过氧化物酶的活性,同时降低小麦幼苗中过氧化氢的浓度和脂氧合酶活性,表明H2S在保护植物氧化应激方面起着重要的作用[11]。除此之外,H2S还参与植物生长发育的许多过程,如调节气孔运动、促进根的发育以及增强光合作用[5-7];H2S还参与植物应答环境胁迫,能缓解干旱、渗透和金属离子等多种非生物胁迫对植物造成的伤害[8-11]。
作为气体信号分子,NO和H2S均能增强植物对逆境的耐受能力,但是两者在植物对高温胁迫的共同响应关系方面尚不明确。大白菜是我国北方重要的经济作物,高温胁迫严重影响其生长。本文以大白菜为材料,结合药理学和植物生理生化研究方法,检测高温下大白菜幼苗的生长情况,测定胁迫条件下的内源H2S和NO含量、渗透调节物质的含量、细胞死亡率等的变化,并结合气体信号分子外源处理的方法,探讨二者在大白菜响应高温胁迫时的生理作用及其相互影响。
1 材料与方法
1.1 材料培养和处理
实验材料为津育75大白菜(Brassicarapa Pekinensis)。将经过4℃过夜浸泡的种子均匀播种在铺好纱布的培养皿中,加蒸馏水20 mL,23℃黑暗处理2 d,然后在温度23℃、湿度50%、光照强度3000 lx、光周期16 h/8 h(昼夜)条件下培养,7 d后进行相关预处理,之后放入43℃人工气候培养箱中进行高温胁迫处理[12]。
处理分为3个阶段:在热胁迫对白菜幼苗生长及内源H2S、NO含量影响实验中,处理分为6组,分别为热胁迫 0、1、3、5、7、9 h。在外源 H2S 和 NO 预处理对胁迫下幼苗生长的影响实验中,实验分为2个部分,每部分有6个处理组(表1),其中外源H2S与外源NO处理分别用50 μmol·L-1的H2S供体硫氢化钠(Sodium hydrosulfide,NaHS)和 50 μmol·L-1的 NO 供体硝普钠(Sodium Nitroprusside,SNP)溶液进行熏蒸,白菜处理的熏蒸装置为容积7 L的密封透明玻璃缸,将相应浓度的NaHS和SNP溶液分别加入1.5 mL离心管,开盖暴露在玻璃缸内进行熏蒸处理,对照(CK)处理组放入盛有蒸馏水的离心管。清除内源H2S和NO分别用1 mmol·L-1的H2S清除剂亚牛磺酸(Hy potaurine,HT)和 1 mmol·L-1的 NO 清除剂 cPTIO(Carboxy-PTIO)溶液处理,将以上两种溶液加入培养皿中,对照组加入等量蒸馏水,所有实验组进行4 h处理后,去掉玻璃缸进行热胁迫。每个处理做3次实验内重复。
整个实验做3次生物学重复。

表1 外源H2S和外源NO不同处理组Table1 Different treatment for exogenous H2S and NO
1.2 测定方法
H2S含量测定参考金竹萍等[13]的方法;NO含量测定使用碧云天(S0021)NO检测试剂盒;可溶性糖含量测定参考文献[14];可溶性蛋白含量及脯氨酸含量测定参考李合生[15]的方法;相对电导率测定使用上海雷磁(DDS-11 D)电导率仪。
1.3 统计分析
数据使用SPSS 17软件Duncan检测进行显著性分析,图表由SigmaPlot 10软件绘制。
2 结果与分析
2.1 高温胁迫对大白菜幼苗生长及内源H2S、NO含量的影响
高温胁迫对大白菜幼苗造成损伤,随着胁迫时间的延长,幼苗的受伤害程度不断加深。43℃处理1 h,植株长势相对弱小,叶片卷曲。随着处理时间的延长,叶片萎蔫,翻卷程度加深,处理9 h,部分幼苗出现整株萎蔫枯死现象(图1)。
H2S和NO都是植物体内重要的气体信号分子,研究表明内源H2S和NO均能对高温胁迫做出响应。随胁迫时间的延长,内源H2S含量逐渐上升,胁迫5 h时幼苗H2S含量最高,并在5 h之后呈现下降趋势;同时胁迫1~5 h,NO含量变化不明显,但在胁迫7 h时NO含量显著升高。根据以上实验结果,后续实验分别选取胁迫5 h和7 h的幼苗进行H2S和NO含量测定(图2)。

图1 高温胁迫对大白菜幼苗生长的影响Figure1 Effect of heat stress on the growth of Chinese cabbage seedlings

图2 高温胁迫下内源H2S、NO含量变化Figure2 Changes of endogenous H2S and NO contents under heat stress

图3 不同处理下大白菜幼苗的生长情况Figure3 Growth of Chinese cabbage seedlings under different treatments
2.2 不同处理对高温胁迫下白菜幼苗表型变化的影响
正常生长情况下(23℃)NaHS和HT处理的幼苗生长状态与CK相比区别不大。43℃胁迫条件下,未经NaHS处理的幼苗叶片明显萎蔫、翻卷;而NaHS预处理后,胁迫并未造成明显的幼苗变弱甚至萎蔫的现象;HT处理后的幼苗,胁迫造成的萎蔫更加严重,甚至有部分幼苗枯死(图3A)。说明外源H2S处理可以改善高温胁迫对白菜幼苗叶片的损伤,相反HT会加重胁迫对幼苗的损伤。
正常生长情况下(23℃)SNP和cPTIO处理对幼苗生长没有明显影响。43℃胁迫时,未经处理的幼苗出现明显的萎蔫翻卷现象,甚至个别幼苗枯死;SNP预处理后,幼苗失绿并有部分萎蔫;cPTIO处理的幼苗,萎蔫严重,也有枯死现象(图3B)。说明外源NO也能帮助大白菜幼苗抵御胁迫,而NO清除剂cPTIO起到相反作用。
2.3 H2S和NO对高温胁迫下白菜幼苗的生理影响
可溶性糖、可溶性蛋白、脯氨酸是植物中重要的渗透调节物质,在维持植物蛋白质稳定及对保持细胞与环境的渗透平衡中起到重要作用[16]。
正常生长状态下,NaHS、HT、SNP、cPTIO 处理的幼苗与CK相比,可溶性糖含量无明显变化。43℃胁迫条件下,未处理的大白菜幼苗可溶性糖含量显著升高,而与23℃CK相比,NaHS预处理后可溶性糖含量升高不显著,HT预处理后可溶性糖含量显著升高;同样,分别将43℃时SNP处理后幼苗和cPTIO处理后的幼苗与CK(23℃)的幼苗进行对比,可溶性糖含量的变化趋势与上述NaHS和HT处理后的变化趋势相类似(图4A和图4B)。
参考上述相同的方法处理大白菜幼苗并检测其可溶性蛋白含量,结果如图4中C、D所示。23℃环境中生长的大白菜幼苗,CK 与 NaHS、HT、SNP、cPTIO处理的幼苗可溶性蛋白含量无明显差异。与23℃CK相比,43℃胁迫条件下,未经预处理及HT、cPTIO预处理后的幼苗可溶性蛋白含量显著升高,而NaHS和SNP预处理后可溶性蛋白升高不显著。
如图4中E、F结果可见,23℃环境中生长的大白菜幼苗,无论是否进行预处理,脯氨酸含量均无显著变化。而43℃胁迫时脯氨酸含量与23℃CK相比显著升高,NaHS和SNP预处理后升高不明显,HT和cPTIO预处理后显著升高。上述实验结果说明高温胁迫条件下细胞渗透性物质可溶性糖、可溶性蛋白与脯氨酸含量升高,外源H2S与NO能够降低胁迫下细胞渗透性物质的含量,缓解高温对细胞渗透性的破坏。
细胞膜透性的大小可用组织的相对电导率衡量,组织相对电导率越高,说明细胞膜遭到破坏的程度越大。正常环境(23℃)中生长的幼苗,处理组与CK相比,相对电导率没有明显差异。43℃环境中生长的幼苗相对电导率显著升高,NaHS预处理使胁迫下的幼苗相对电导率恢复到与23℃CK同一水平,而SNP预处理,相对电导率较CK没有明显变化,但显著低于cPTIO处理组;同时HT和cPTIO预处理的幼苗相对电导率与CK(23℃)相比显著升高(图4G和图4H)。该实验结果也说明高温胁迫会使细胞膜完整性遭到破坏,H2S和NO清除剂会加剧高温对细胞膜的损伤作用,而外源H2S与NO部分降低细胞在胁迫条件下的损伤率。
2.4 不同处理对高温胁迫下白菜幼苗H2S和NO含量的影响
在动物的生理活动中,NO和H2S可以调节彼此的代谢,甚至共同起作用[17]。由于气体信号分子可自由通过细胞膜,其作用可不依赖于质膜受体,因此在外源施加H2S或NO供体时,气体信号分子进入植物体内,导致内源H2S和NO含量上升,外源施加清除剂时,内源气体信号分子含量下降(图5A和图5B)。23℃生长环境下,外源施加NO和H2S分别对内源H2S和NO的产生没有明显影响。而43℃胁迫时,内源H2S与NO含量显著升高,外源施加NO后,内源产生的H2S含量变化不明显,用cPTIO预处理后H2S含量变化不显著,说明在热胁迫时,外源NO对白菜幼苗产生H2S能力没有显著影响(图5C)。胁迫条件下,外源施加H2S后NO含量明显降低,相反若用H2S清除剂HT预处理,NO含量恢复到CK水平,可以看出在热胁迫时,外源H2S可能会使内源NO含量升高(图5D)。
3 讨论
逆境胁迫会导致叶片失水,进而影响叶绿素生物合成,加速叶绿素的分解,导致叶片萎蔫变黄[18]。本实验中43℃胁迫1 h后,大白菜幼苗生长受到抑制,并且随着高温胁迫的时间延长,幼苗受损加剧,该现象与其他作物在高温下的表现相同[19]。可见大白菜幼苗对高温敏感,对持续高温抵御能力差。有报道表明,在植物受到非生物胁迫时,内源H2S和NO含量都会上调[16]。本实验中,外源施加H2S和NO,可缓解高温胁迫下大白菜幼苗的受损伤程度,表明H2S和NO作为气体信号分子,参与对大白菜幼苗对高温胁迫的响应。
渗透调节物质是植物耐热和抵御高温逆境的重要生理机制之一,高温胁迫诱发的细胞脱水而使渗透调节物质积累是高温对细胞造成损害的主要原因[20]。但也有研究表明,高温导致的光合色素降低会使光合产生的可溶性糖含量降低[21]。本实验中,高温造成细胞膜损伤,导致细胞渗透性遭到破坏,渗透调节物质含量升高。外源施加H2S和NO后,高温胁迫下的大白菜幼苗中渗透调节物质含量都有所降低。说明大白菜幼苗的渗透性调节物质会对高温胁迫做出响应,并且外源H2S和NO有调控渗透调节物质的作用,可能通过降低高温胁迫对细胞膜造成的损伤来缓解渗透性调节物质的积累。
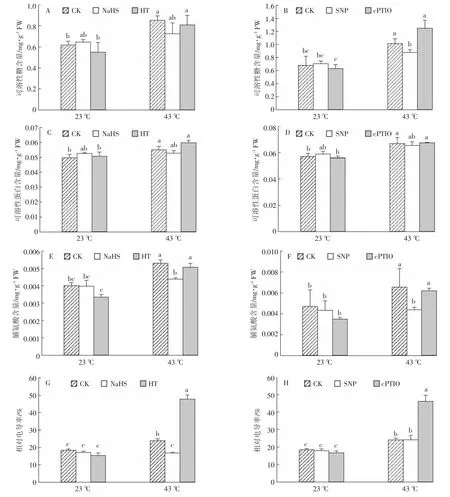
图4 不同处理对高温胁迫下白菜幼苗的生理影响Figure4 Effects of different treatments on physiology of cabbage seedlings during heat stress
植物受到高温胁迫时脱水造成细胞膜液态化,膜结构发生改变,引起蛋白的凝聚和变性,导致外渗液急剧增加,相对电导率升高[19]。H2S可以通过调节气孔开度响应逆境[22]。本实验中高温胁迫下的白菜幼苗细胞外渗液相对电导率显著升高,可以看出高温胁迫会使白菜幼苗细胞受损严重,细胞死亡率升高。而施加外源H2S后,相对电导率降低,施加外源NO供体,相对电导率变化不明显,但清除剂的相反作用十分显著,说明NO对热胁迫下电导率有部分的恢复作用,这可能是通过H2S和NO对气孔的调节,减少细胞水分散失来减缓细胞受损伤程度,降低细胞死亡率。
H2S和NO作为植物的气体信号分子,参与植物对非生物胁迫的响应。本实验中,当白菜幼苗受到高温胁迫时,H2S含量和NO含量都显著上调,H2S含量变化尤为明显,随着胁迫时间延长呈现倒“U”趋势,可能是因为胁迫时间过长,大多数幼苗受到严重损伤,部分丧失调节能力造成。
Shi等[23]指出,NO会诱导H2S的合成进而增强植物对镉胁迫的耐受,表明镉胁迫下NO的产生先于H2S的产生。本研究结果可见,H2S对高温胁迫的响应优先于NO。外源施加NO后,内源产生的H2S含量稍有降低,但不显著;但外源施加H2S后,植物内源产生的NO含量显著下调。由此推测,高温胁迫时H2S和NO的相互作用模式与镉胁迫不完全一致。

图5 不同处理对高温胁迫下大白菜幼苗H2S和NO含量的影响Figure5 Effects of different treatments on the H2S and NO contents of cabbage seedlings after during heat stress
4 结论
大白菜幼苗在热胁迫条件下,可溶性糖、可溶性蛋白、脯氨酸含量以及相对电导率等生理指标均出现不同程度的波动来响应胁迫,外源施加H2S和NO可缓解胁迫对幼苗造成的损伤。并且在热胁迫响应过程中,外源H2S会抑制NO的产生,而NO对H2S的含量变化没有明显影响。
[1]Mohammad G M,Masayuki F,Lam-Son P T.Nitric oxide mediates hydrogen peroxide-and salicylic acid-induced salt tolerance in rice(O-ryza sativa L.)seedlings[J].Plant Growth Regulation,2015,77(3):265-277.
[2]Shi J Y,Liu N,Gu R X,et al.Signals induced by exogenous nitric oxide and their role in controlling brown rot disease caused by Monilinia fructicola in postharvest peach fruit[J].Journal of General Plant Pathology,2015,81(1):68-76.
[3]Sanz L,Albertos P,Mateos I,et al.Nitric oxide(NO)and phytohormones crosstalk during early plant development[J].Journal of Experimental Botany,2015,66(10):2857-2868.
[4]Wang R.Physiological implications of hydrogen sulfide:A whiff exploration that blossomed[J].Physiological Reviews,2012,92(2):791-896.
[5]Jin Z P,Pei Y X.Physiological implications of hydrogen sulfide in plants:Pleasant exploration behind its unpleasant odour[J].Oxidative Medicine and Cellular Longevity,2015(3):1-6.
[6]Lin Y T,Li M Y,Cui W T,et al.Haem oxygenase-1 is involved in hydrogen sulfide-induced cucumber adventitious root formation[J].Journal of Plant Growth Regulation,2012,31(4):519-528.
[7]Wang L,Wan R J,Shi Y H,et al.Hydrogen sulfide activates S-type anion channel via OST1 and Ca2+modules[J].Molecular Plant,2016,9(3):489-491.
[8]Jin Z P,Xue S W,Luo Y N,et al.Hydrogen sulfide interacting with abscisic acid in stomatal regulation responses to drought stress in arabidopsis[J].Plant Physiology and Biochemistry,2013,62(1):41-46.
[9]Papanatsiou M,Scuffi D,Blatt M R,et al.Hydrogen sulfide regulates inward-rectifying K+channels in conjunction with stomatal closure[J].Plant Physiology,2015,168(1):29-35.
[10]裴雁曦.植物中的气体信号分子硫化氢:无香而立,其臭如兰[J].中国生物化学与分子生物学,2016,32(7):721-733.
PEI Yan-xi.Gasotransmitter hydrogen sulfide in plants:Stinking to high heaven,but refreshing to fine life[J].Chinese Journal of Biochemistry and Molecular Biology,2016,32(7):721-733.
[11]Xie Y J,Zhang C,Lai D W,et al.Hydrogen sulfide delays GA-triggered programmed cell death in wheat aleurone layers by the modulation of glutathione homeostasis and heme oxygenase-1 expression[J].Journal of Plant Physiology,2014,171(2):53-62.
[12]Li Z G,Gong M,Xie H,et al,Hydrogen sulfide donor sodium hydrosulfide-induced heat tolerance in tobacco(Nicotiana tabacum L.)suspension cultured cells and involvement of Ca2+and calmodulin[J].Plant Science,2012,185(4):185-189.
[13]金竹萍,裴雁曦.植物H2S气体信号分子的生理功能研究进展[J].中国细胞生物学学报,2013,35(6):880-888.
JIN Zhu-ping,PEI Yan-xi.Research progress on hydrogen sulfide signaling in plants[J].Chinese Journal of Cell Biology,2013,35(6):880-888.
[14]中国科学院上海生物生理研究所.现代植物生理学实验指南[M].北京:科学出版社,1999.
Shanghai Institute of Plant Physiology.Experiment guide of modern plant physiology[M].Beijing:Science Press,1999.
[15]李合生.植物生理生化实验原理和技术[M].北京:高等教育出版社,2006.
LI He-sheng.Technology of plant physiological and biochemical[M].Beijing:China Higher Education Press,2006.
[16]邵艳军,山 仑,李广敏.干旱胁迫与复水条件下高粱、玉米苗期渗透调节及抗氧化比较研究[J].中国生态农业学报,2006,14(1):68-70.
SHAO Yan-jun,SHAN Lun,LI Guang-min.Comparison of osmotic regulation and antioxidation between sorghum and maize seedling under soil drought sress and water recovering condition[J].Chinese Joural of Eco-Agriculture,2006,14(1):68-70.
[17]Kajimura M,Fukuda R,Bateman R M,et al.Interactions of multiple gas-transducing systems:Hallmarks and uncertainties of CO,NO,and H2S gas biology[J].Antioxid Redox Signal,2010,13(2):157-192.
[18]Yin Z P,Liu X M,Shang Z W,et al.Response of photosynthesis and chlorophy Ⅱ fluorescence parameters to different drought stress in Cerasus humilis bunge[J].Plant Physiology Journal,2011-05.
[19]Chen P Q,Yu S L,Zhan Y N,et al.A review on plant heat stress physiology[J].Chinese Agricultural Science Bulletin,2006,26(5):224-225.
[20]Carlos G M,Lorenzo L.Gasotransmitters are emerging as new guard cell signaling molecules and regulators of leaf gas exchange[J].Plant Science,2013,11(7):201-202.
[21]Dong Y C,Liu Y Q.Soil water influences on protective enzymes and osmolytes of Urticadioica and their correlations with leaf photosynthesis and biomass[J].Acta Ecologica Sinica,2009,29(6):2845-2851.
[22]孙丽敏,裴雁曦,刘志强.H2S信号和WRKY在ABA调节根生长和气孔运动中的关系[J].植物研究,2016,36(1):97-104.
SUN Li-min,PEI Yan-xi,LIU Zhi-qiang.Relationship between H2S signal and WRKY in ABA regulating root growth and stomatal movement[J].Bulletin of Botanical Research,2016,36(1):97-104.
[23]Shi H T,Ye T T,Chan Z L.Nitric oxide-activated hydrogen sulfide is essential for cadmium stress response in bermudagrass(Cynodon dactylon(L).Pers.)[J].Plant Physiology and Biochemistry,2014,74(136):99-107.
