人肝源性干细胞腹腔移植抗刀豆蛋白A诱导小鼠急性肝损伤的机制研究
2018-06-28毕研贞刘铜军张保贵王全义董冠军付兴芹段钟平张小蓓司传平
樊 增,张 凯,洪 丰,毕研贞,刘铜军,张保贵,张 惠,王全义,董冠军,付兴芹,段钟平,陈 煜,张小蓓,李 亮,司传平*
(1.济南大学,山东省医学科学院医学与生命科学学院,山东 济南250200;2.吉林大学第二医院,吉林 长春130041;3.济宁医学院附属医院,山东 济宁272000;4.首都医科大学附属北京佑安医院,北京 丰台100069;5.济宁医学院 免疫学与分子医学研究所,山东 济宁272000;6.青岛大学基础医学院 免疫学系,山东 青岛266071;7.济宁市第一人民医院,山东 济宁272000)
严重且持续的肝脏损伤最终会诱发肝脏功能衰竭,药物、毒物、病毒、酒精、自身免疫疾病等多种因素均可导致肝脏损伤[1,2]。免疫介导的肝损伤是急性肝衰竭的重要病因之一。因此,探寻行之有效的免疫性肝病的治疗方法意义重大。人肝源性干细胞具有多向分化的潜能,在肝细胞受损时可促其激活并进行增殖分化,从而实现对肝损伤的修复。另外,该细胞以其较强的自我更新能力和较弱的免疫原性等优势,使其在终末期肝病治疗领域拥有很高的应用价值。我们前期实验已经证明人肝源性干细胞腹腔移植可以有效保护刀豆蛋白A(ConA)诱导的小鼠急性肝损伤[3]。本实验是前期结果的延续,旨在阐明人肝源性干细胞抗ConA诱导的小鼠急性肝损伤的作用机制。
1 材料与方法
1.1 材料
1.1.1实验动物 雄性C57BL/6小鼠72只,SPF级,6-8周龄,体质量(22±3)g,由济南朋悦实验动物繁育有限公司提供,许可证号:SCXK[鲁]20140007。
1.1.2细胞与试剂 人肝源性干细胞1(human liver stem cells 1,HYX1)由本实验室洪丰教授建系存种。Q-PCR试剂盒(美国Vazyme公司);逆转录试剂盒RevertAid First Strand cDNA Synthesis Kit(美国Thermo Fisher 公司);ELISA试剂盒(美国Biolegend),TUNEL染色试剂盒(瑞士Roche),引物(上海生工)。
1.2 方法
1.2.1人肝源性干细胞的培养、造模、干预、生化指标检测、病理学检查同前期实验方法[3]。
1.2.2按照ELISA试剂盒要求测定血清中TNF-α、IL-10水平,按TUNEL染色试剂盒说明进行细胞凋亡检测。
1.2.3qRT-PCR检测肝组织TNF-α、IL-10 mRNA表达。按试剂盒说明抽提RNA,并进行逆转录。取4.0 μl的cDNA于10 μl反应体系中,进行PCR扩增。

2 结果
2.1 血清转氨酶检测
注射ConA后12 h和24 h干预组小鼠血清ALT和AST水平较模型组显著降低(P<0.05)。见图1。

图1 不同时间点小鼠血清转氨酶变化
2.2 肝组织病理学检查
ConA注射12 h后模型组小鼠可见多灶性细胞坏死并桥接坏死,界板不清,肝小叶消失,肝窦扩张、充血,胆小管结构不清;干预组小鼠肝小叶结构正常,界板清晰,仅见少许炎细胞浸润汇管区。见图2。
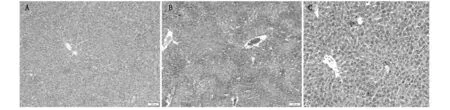
A:正常小鼠;B:模型组小鼠C:干预组小鼠
2.3 Elisa检测血清TNF-α、IL-10水平
注射ConA后3 h、6 h和12 h干预组小鼠血清TNF-α水平较模型组均显著降低(P<0.05);而IL-10在6 h时干预组明显高于模型组(P<0.05)。见图3。
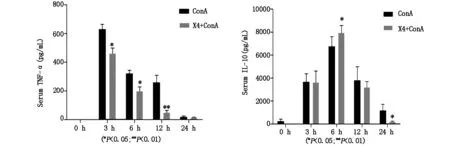
图3 不同时间点小鼠血清TNF-α、IL-10变化
2.4 qRT-PCR检测肝组织TNF-α、IL-10表达
注射ConA后3 h、6 h、12 h和24 h干预组小鼠肝组织TNF-α表达水平较模型组均显著降低(P<0.05);而IL-10表达水平在6 h时干预组明显高于模型组(P<0.05),与血清变化基本一致。见图4。
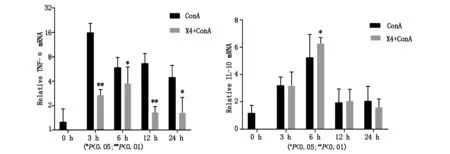
图4 不同时间点小鼠肝组织TNF-α、IL-10 mRNA表达
2.5 小鼠肝脏细胞凋亡检测
TUNEL结果提示,ConA注射后12 h模型组小鼠肝组织出现大量凋亡细胞,呈片状广泛分布;而12 h干预组仅有少量凋亡细胞,呈散在分布。见图5。

图5 ConA注射后12 h肝组织凋亡检测(TUNEL ×100)
3 讨论
急性肝衰竭目前最有效的治疗方式是肝脏移植,但该治疗方法面临诸多限制,例如肝源不足、费用昂贵以及术后免疫排斥等,因此,其很难在临床大规模开展[4]。较之肝脏移植存在的诸多不足,干细胞疗法以其自身独有的优势受到越来越多的关注[5]。对肝干细胞治疗作用的深入研究将会对以后终末期肝病有效的临床干预奠定良好的基础。
促炎因子TNF-α、IFN-γ等大量释放以及CD4+T细胞活化是ConA诱导的急性肝损伤的主要特征,该病理过程伴随肝窦内皮细胞及Kupffer细胞中的黏附分子以及肝细胞中的趋化因子活化,最终引起伴有中性粒细胞浸润的细胞坏死。 IL-10 是已知较强的抑炎症细胞因子,可抑制单核细胞依赖性Th 细胞增殖,并抑制Th1 类细胞因子的合成及其活性,具有抑制炎症、保护组织作用。
本实验结果证实,ConA注射后3 h、6 h、12 h干细胞干预组小鼠血清TNF-α水平较模型组均显著降低,而IL-10水平在ConA注射后6 h明显升高,肝组织TNF-α和IL-10的mRNA水平变化和血清学基本一致,说明人肝源性干细胞可能通过抑制促炎因子释放、促进抑炎因子表达来发挥其抗ConA诱导小鼠急性肝损伤作用。
细胞凋亡是由一系列静止的蛋白酶调控的程序性细胞死亡,又称Ⅰ型程序性细胞死亡,可在ConA诱导的肝炎模型中观察到[6,7]。本实验凋亡结果证实人肝源性干细胞可以显著抑制小鼠肝脏细胞凋亡,进而表明人肝源性干细胞抗凋亡作用可能是其保护急性肝损伤的另一机制。
参考文献:
[1]Liu T,Xia Y,Li J,et al.Shikonin Attenuates Concanavalin A- Induced Acute Liver Injury in Mice via Inhibition of the JNK Pathway[J].Mediators of Inflammation,2016,2016:2748367.doi:10.1155/2016/2748367.
[2]Zhao J,Zhang S,You S,et al.Hepatoprotective Effects of Nicotiflorin from Nymphaea candida against Concanavalin A-Induced and d-Galactosamine- Induced Liver Injury in Mice[J].Int J Mol Sci,2017,18(3).pii:E587.doi:10.3390/ijms18030587.
[3]毕研贞,樊 增,陈东风,等.人肝源性干细胞腹腔移植不同时间对ConA诱导小鼠急性肝损伤保护作用的对比研究[J].中华肝脏病杂志,2017,25(3):202.
[4]Maes M,Vinken M,Jaeschke H.Experimental models of hepatotoxicity related to acute liver failure[J].Toxicology and applied pharmacology,2016,290:86.
[5]Habeeb MA,Vishwakarma SK,Bardia A,et al.Hepatic stem cells:A viable approach for the treatment of liver cirrhosis[J].World Journal of Stem Cells,2015,7(5):859.
[6]Li S,Xia Y,Chen K,et al.Epigallocatechin-3-gallate attenuates apoptosis and autophagy in concanavalin A-induced hepatitis by inhibiting BNIP3[J].Drug design,development and therapy,2016,10:631.
[7]Mao Y,Wang J,Yu F,et al.Ghrelin reduces liver impairment in a model of concanavalin A-induced acute hepatitis in mice[J].Drug design,development and therapy,2015,9:5385.
