阿尔茨海默病患者血清ACTA、MK和APN检测及临床意义
2018-06-28李大光张灵敏袁翠玲
杨 清,李大光,陈 勃,张灵敏,袁翠玲,林 花
(1.吉林大学第一医院二部 输血科;2.吉林大学第一医院 检验科,吉林 长春130000)
AD是一种渐进性大脑退行性变性疾病,其病因不明,发病率随年龄增长而显著升高,β-淀粉样蛋白在中枢神经系统的沉积是AD的一个标志,其病理改变为神经细胞间的神经炎性斑块和神经细胞内神经元纤维缠结[1]。有研究认为,AD神经病理损伤过程,主要与前炎细胞因子有关[2],也有研究认为,糖代谢、脂代谢异常与AD发病密切相关[3]。目前关于AD实验方面的报道较少,本文旨在通过检测AD患者血清ACTA、MK和APN水平变化,探讨其在AD发生机制中的作用。
1 资料与方法
1.1研究对象选择2015年5月至2017年3月我院门诊和住院患者65例,其中男性25例,女性40例,诊断符合美国精神病协会的精神障碍诊断和统计手册第五版(DSM-V)。平均年龄(75.49±5.65)岁。40例对照者为我院体检中心的健康体检者,男性20例,女性20例,平均年龄(71.21±5.39)岁,以上研究对象均排除高血压、心脑血管病、糖尿病、高脂血症及肾功能不全。
1.2方法清晨空腹采取静脉血4 ml,离心后取上清液,标本放置-80℃保存待测。采用ELISA法测定ACTA、MK和APN含量。试剂由上海凯博生化试剂有限公司和武汉博生生物公司提供,严格按说明书操作。
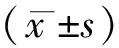
2 结果
65例AD患者血清ACTA和APN水平明显低于对照组(P<0.01),MK水平明显高于对照组(P<0.01)。表1。
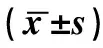
表1 65例AD患者和40例对照组血清ACTA、MK和APN水平
注:*与对照组比较P<0.01
3 讨论
AD是一组多种病因引起、发病机制复杂的进行性脑变性疾病。ACTA是由性腺分泌的一种肽类激素,是近年发现的重要细胞因子,属转化生长因子超家族,具有广泛的生物学活性,可促进星形细胞产生IL-6,继而抑制TNF-a生成,保护中枢神经系统。其病理性增高或降低,可导致组织细胞分化、增生、代谢异常,具有抗氧化作用,可抑制神经元和毛细血管内自由基聚集,可上调脑衍生物的神经营养因子[4]。MK也是新近发现的细胞因子,属于肝素结合因子家族,是一种小分子多肽,生物学功能十分广泛,具有促进神经元生长、加强纤溶酶原激活剂活性,参与创伤组织修复及介导炎症反应等作用[5]。研究证实,MK在胚胎期高表达,在成人脑组织中几乎检测不到,而在发生炎症和组织细胞修复时,血管内皮细胞能够释放MK,使MK的表达明显增强[6]。ANP是由脂肪细胞分泌的一种特异性蛋白,具有抗炎、血管保护、促进代谢和神经保护作用,是损伤后内膜增生的活性物质[7]。有研究表明,低APN水平与AD相关,水平升高的APN对AD有保护作用,APN能减少巨噬细胞向泡沫细胞转化,氧化低密度脂蛋白,降低超氧代谢反应。APN通过激活AMPK传导通路,发挥细胞保护作用,抑制细胞凋亡[8,9]。本实验结果显示,AD患者血清ACTA和APN水平明显低于对照组,MK水平明显高于对照组。ACTA是细胞外基质(ECM)成分有力的诱导物,ECM是细胞生长、增殖、分化、分泌等所必需的,可促进结缔组织形成,参与血管反应,增强纤维连接蛋白、蛋白多糖的表达及胶原形成等[10]。AD患者ACTA水平降低,可能造成ECM成分减少,可使TNF-a生成增多,诱发中枢神经疾病发生,可能影响胶质细胞与神经元之间的相互作用,影响神经元转移,轴突形成及组织修复。AD患者血清MK表达水平显著升高,提示由于AD患者MK水平的增高,可能抑制AD患者β-淀粉样蛋白(Aβ)诱导的细胞凋亡,推测AD患者脑组织和血清中MK改变是同步的,AD患者神经递质释放,刺激脑血管内皮细胞释放MK,以及MK的异常表达可能影响了神经细胞的存活、增值与分化,使得AD患者脑皮层及皮下神经元不能正常地生长和凋亡而出现退行性变。APN水平的降低,可能影响了糖、脂的代谢,可能通过干扰胰岛素细胞信号传导通路等分子机制,上调了前淀粉样蛋白的代谢途径,导致Aβ寡聚体异常沉积,进而启动Aβ的级联反应。然而AD患者血清ACTA和APN水平下降和MK水平增高机制并不清楚,尚有待于进一步研究。
综上所述,ACTA、MK和APN表达水平在AD患者发生了不同的变化,与AD的病理进程有一定的相关性,可能参与了疾病的发生、发展。联合检测三项指标,对疾病的诊断、预防及病情评估具有重要意义。
参考文献:
[1]Wilkinson K,E L Khoury J.Microglial scavenger receptors and their roles in the pathogenesis of Alzheimer s disease[J].Int J Alzhei mers Dis,2012,489456.
[2]张兴博,梁键芬,郭旭堂.阿尔茨海默病生物学诊断指标研究进展[J].现代医药卫生,2014(18):2774.
[3]Chen RH,Jiang XZ.Risk factors of mild cognitive impairment in middle aged patients with type 2 diabtes:Across-section study[J].Ann Endocrinol(paris),2015,73(3):208.
[4]Sugiyama M,Ichida T,SatoT,et al.Expression of activinA is increased in cirrhotic and fibrotic rat livers[J].Gastroenterology,1998,114(3):550.
[5]王海波.中期因子在结肠癌中的研究进展[J].肿瘤研究与临床,2014,26(4):258.
[6]Sueyoshi T,Jono H,Shinriki S.Therapautic approaches targe-ting midkine suppress tumor growth and lung metastasis in osteo-sarcoma[J].Cancer Letters,2012,1:23.
[7]Polyzos SA.Editorial:adiponectin in health and disease:current evidence and therapeutic perspectives[J].Curr Med Chem,2012,19(32):5425.
[8]孙思斯,王百忍,王 强,等.脂联素在缺血性脑损伤中作用的研究进展[J].国际麻醉学与复苏杂志,2014,35(6):546.
[9]徐玉荣,曹 梅.阿尔茨海默病的研究进展[J].中国医师杂志,2014(2):359.
[10]曾纪荣.神经细胞退行性变机制研究进展[J].中国老年学,2015(1):277.
