血清AFP- IgM复合物、HCY联合肝功能检查在肝癌诊断中的应用价值
2018-06-28刘东方
刘东方
(濮阳市安阳地区医院 普外科,河南 濮阳455000)
作为常见的恶性肿瘤,原发性肝癌(Hepatocellular carcinoma,HCC)具有如下临床特点:早期诊断难、恶性程度搞、预后较差,目前认为提高HCC的早期诊断率及早期治疗是降低HCC患者病死率的关键[1]。在临床上,甲胎蛋白(Alpha- fetoprotein,AFP)是目前诊断原发性肝癌最常用的生物标记物,但由于该生物指标存在一定的假阴性及假阳性的误差,基于此,单独应用AFP用以诊断肝癌同样存在一定的局限[2]。近年学者发现在HCC患者血液中存在两种AFP亚型结构:游离型AFP(F- AFP)和IgM复合物型AFP(AFP-IgM IC),并认为AFP-IgM复合物可作为诊断HCC的可靠生物学标记物[3]。同型半胱氨酸(homocysteine,Hcy)主要是肝内甲硫氨酸代谢的中间产物,当患者机体内发生肝功能异常时,血清Hcy的水平也随之发生动态改变[4]。此外,研究发现:血清Hcy在慢性乙肝、肝硬化及肝癌患者的水平显著升高,并与疾病的严重程度呈现正相关的趋势[5]。在临床上,病理组织学活检是目前确诊HCC的金标准,但是由于其具有创伤性、随机差异性等局限,使之难以用以HCC的早期诊断。相比之下,肝功能检查具有快捷方便性,且更易在临床上开展,是辅助早期诊断HCC的高效手段。基于此,本研究拟分析在HCC患者、乙肝后肝硬化患者、活动性肝炎患者、健康志愿者的血清AFP- IgM复合物、HCY的水平,肝功能各项指标的变化差异,用以确定血清AFP- IgM复合物、HCY联合肝功能检测在肝癌诊断中的应用价值。
1 资料与方法
1.1 一般资料
选取2015年8月- 2017年8月在我院经病理科确诊为原发性肝细胞性肝癌患者86例(肝癌组:年龄35- 79岁,平均年龄(48.2±4.72)岁,男性56例,女性30例,可见表1)、乙肝后肝硬化患者92例(肝硬化组:年龄30- 69岁,平均年龄(46.2±3.54)岁,男性50例,女性42例)、慢性肝炎患者104例(肝炎组:年龄40- 75岁,平均年龄(47.2±5.73)岁,男性44例,女性60例)、健康志愿者80例(对照组:年龄32- 65岁,平均年龄(45.2±4.91)岁,男性35例,女性45例)。所有患者入组标准参考《慢性乙型肝炎防治指南》[6]和《原发性肝癌规范化诊治的专家共识》[7]。所有入组患者均排除心、肝、肺等重要脏器损害以及原发性胆汁性肝硬化、自身免疫性肝病、硬化性胆管疾病等自身免疫性肝病。四组患者在年龄、性别等一般资料方面不具有统计学差异,具有可比性(P>0.05)。根据美国癌症联合委员会(AJCC)标准在HCC的临床分期:Ⅰ-Ⅱ期属早期HCC,Ⅲ-Ⅳ属中晚期HCC[8]。
1.2 方法与观察指标
四组患者于清晨空腹抽取全血5 ml,经离心机在4 000 rpm/min,5 min条件下,分离血清,并保存在-80℃冰箱中,以备后续实验所用。严格参考AFP- IgM试剂盒说明书(来自意大利XEPTAGEN公司)、Hcy试剂盒说明(来自英国IBL公司),应用酶联免疫吸附法分别测定血清AFP- IgM、Hcy水平;严格参考AFP试剂盒说明书(瑞士ROCHE 公司),应用电化学发光法测定血清AFP水平;肝功能检查由7060全自动生化仪器(来自日本Olympus公司)完成检测,所包含指标如下:血清酶学指标:谷丙转氨酶(ALA)、谷草转氨酶(ASA)、γ-谷氨酰转肽酶( GGT)、碱性磷酸酶(ALP);血清蛋白代谢指标:白蛋白/球蛋白比值(A/G);血清胆红素代谢指标:总胆红素(TBIL)、直接胆红素(DBIL)。
观察血清AFP- IgM复合物水平、HCY水平、肝功能各项指标单项检测在HCC患者阳性表达率以及与患者性别、病灶直径、病灶数目、临床分期;血清AFP-IgM复合物水平、HCY水平、肝功能各项指标、联合检测HCC的灵敏度、特异度、效能。灵敏度:阳性例数/(阳性例数+假阴性例数)×100%;特异度=阴性例数/(阴性例数+假阳性例数)×100%;效能=(阳性例数+阴性例数)/总例数×100%。
1.3 统计学分析
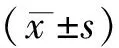
2 结果
2.1 血清AFP- IgM、AFP、Hcy水平与肝癌患者的临床参数的比较
肝癌患者临床参数(性别、病灶直径、病灶数目、临床分期),血清中的AFP-IgM、AFP、Hcy之间的差异无统计学意义(P>0.05),见表1。
2.2 各组患者血清Hcy的比较
如图1所示,与对照组相比,肝炎组、肝硬化组、肝癌组血清中的Hcy水平显著升高,并且呈现上升趋势,差异具有统计学意义(P<0.05)。
2.3 各组患者肝功能检测结果
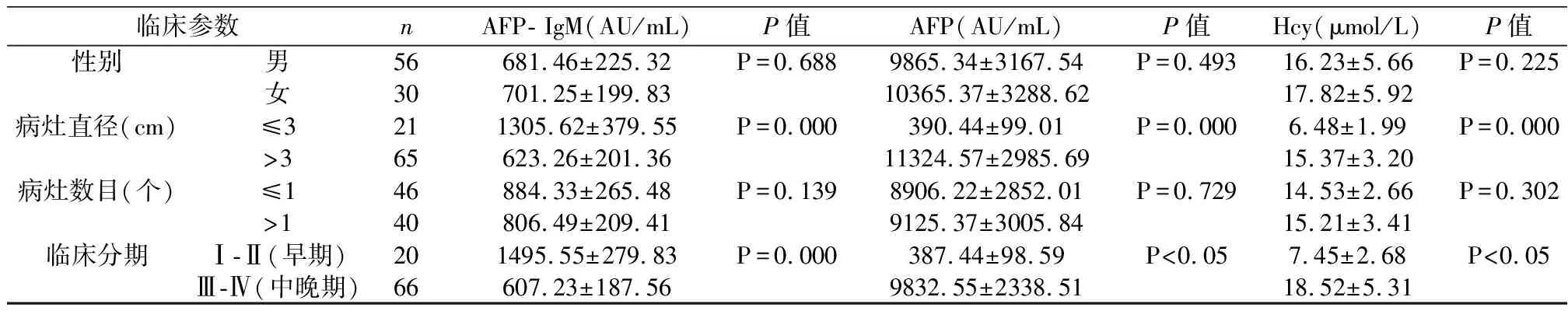
表1 原发性肝癌患者中血清AFP- IgM、AFP、Hcy水平与临床参数的关系
与对照组相比,肝炎组、肝硬化组、肝癌组中AST、ALT、GGT、ALP、TBIL、DBIL显著升高,而A/G比值显著下降(P<0.05);组间比较结果所示:与肝炎患者组相比,肝硬化组和肝癌组组中的AST、ALT、ALP差异具有统计学意义(P<0.05);与肝硬化组相比,肝癌患者组中GGT、ALP、TBIL、DBIL、A/G比值之间的差异具有统计学意义(P<0.05),见表2。
3 讨论
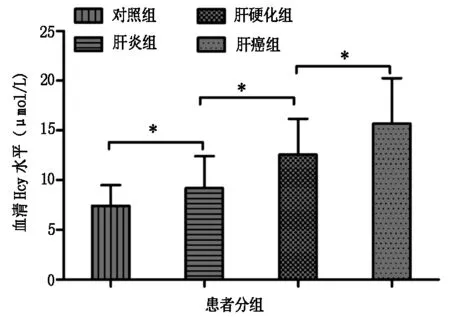
注:*表示P<0.05

组别年龄(岁)例数AST(U/L)ALT(U/L)GGT(U/L)ALP(U/L)TBIL(μmol/L)DBIL(μmol/L)A/G对照组45.2±4.918020.11±4.5819.53±5.3122.43±6.9240.51±10.4314.11±3.555.32±1.162.11±0.62肝炎组47.2±5.73104107.44±31.69a121.55±38.59a130.48±30.51a145.33±40.36a26.41±7.71a16.41±4.38a1.30±0.34a肝硬化组46.2±3.549268.37±22.13ab45.98±10.78ab131.38±22.49ab198.46±50.21ab46.53±11.48ab25.82±6.59abc1.18±0.27a肝癌组48.2±4.728664.48±18.59ab48.52±13.42ab194.55±50.41abc220.53±60.74abc27.28±9.01abc17.61±5.39abc0.92±0.21abc
注:与对照组相比,aP<0.05;与肝炎组相比,bP<0.05;与肝硬化组相比,cP<0.05
在我国,HCC通常是以乙肝后肝硬化作为疾病基础而发生发展,由于其缺乏有效的诊断手段,导致了HCC的高死亡率[7]。在HCC的免疫应答过程中,AFP作为免疫抑制的生物分子,由590多个氨基酸组成的单多肽链,其主要功能是抑制肿瘤患者对肿瘤的免疫反应,其中IgM在其中扮演着重要的调控作用[3]。目前,AFP在临床上定性诊断HCC已得到一定的认可,但也存在文献报道患者血清AFP受多方面因素的影响,假阳性率较高,尤其是在病灶直径小于3厘米情况下,HCC患者血清中AFP的浓度属正常或略高于400 μg/L[9]。抑或是在HCC早期,即病灶与正常组织并未存在较大的形态学差异,也容易形成AFP式假阴性的诊断,导致误诊或漏诊的发生[10]。基于此,寻求新型的诊断手段已然成为降低HCC死亡率的热门途径。
研究发现AFP- IgM复合物有助于提高原发性小肝癌诊断的有效性和早期HCC的诊断效能[11]。本研究显示AFP- IgM复合物在HCC患者的性别、病灶数目的亚组之间的差异无统计学意义,而在病灶直径≤3 cm的患者血清中的,AFP- IgM复合物(1305.62±379.55 AU/mL)显著高于病灶直径>3 cm的患者组(623.26±201.36 AU/mL),而AFP参数在此亚组中的趋势呈现是相反的趋势,初步认为HCC患者病灶的大小与血清AFP- IgM水平的关系较为密切,尤其是在病灶直径≤3 cm的患者血清中,AFP水平仅为390.44±99.01 AU/mL,低于临床的诊断阈值,明显低于AFP- IgM参数值,这说明对于病灶直径较小的HCC患者,AFP- IgM复合物的诊断效能可能比AFP更为准确。此外,同样有类似团队报道AFP- IgM复合物对于小细胞肝癌具有较高的诊断效能[12]。基于AFP- IgM复合物的高分子量以及IgM的半衰期短等特点,使得在早期HCC患者外周血中更容易检出此免疫复合物,而在中晚期HCC患者体内,肝细胞受到了一定程度的破坏或引起肿瘤免疫耐受等原因,造成外周血中AFP- IgM复合物的分泌量下降。本研究参考美国癌症联合委员会(AJCC)标准,发现早期HCC患者血清AFP- IgM水平显著高于中晚期HCC患者组;而AFP在早期HCC患者组中的水平(387.44±98.59 AU/mL)同样低于临床参考阈,这可能的原因是在早期HCC患者的病灶接近组织或者是病灶周围存在过多的结缔组织,因此单项检测AFP易发生HCC的漏诊或误诊,这共同说明AFP- IgM复合物更利于提高早期、病灶直径小的肝癌筛检率。
血清Hcy是临床上主要用于检测心脑血管疾病的常用辅助诊断指标,已有人群研究报道Hcy可作为独立的风险因子,并且心血管患者伴有高Hcy血症与终末不良事件具有强相关性[13]。肝脏是主要代谢Hcy的主要器官,因此,由慢性肝炎、肝硬化等肝病导致的肝内代谢紊乱可导致机体内Hcy水平的差异性波动。研究表明患有慢性乙肝、乙肝后肝硬化等慢性肝病的患者血清Hcy显著升高,并且与疾病的活动程度呈正相关趋势[15],这提示血清Hcy可作为监测肝病患者预后的生物标记物。与以往报道类似,本研究通过对比健康志愿者、肝炎、肝硬化、肝癌患者的血清Hcy水平,同样发现肝炎组、肝硬化组、肝癌组血清中的Hcy水平显著升高,同样呈现依次上升趋势,但是在肝癌亚组中发现血清Hcy的水平变化与病灶直径大小、临床肿瘤分期等关联并不大,这可能是基于不同程度的疾病对肝脏组织中蛋氨酸循环的损伤差异所致。
由于肝功能检查具有费用低、无创伤、高快捷性等特点,在临床上该辅助检查已成为各类慢性肝病患者的常规检查项目。本次研究内容主要分析了AST、ALT、GGT、ALP、TBIL、DBIL、A/G肝功能检测指标,发现与对照组相比,肝炎组、肝硬化组、肝癌组中AST、ALT、GGT、ALP、TBIL、DBIL显著升高,而A/G比值显著下降,并认为肝癌组患者的肝功能较差,这可能是由于疾病的进展导致正常组织的破坏或者是肿瘤组织酶学的复杂性所致。值得一提的是GGT主要在肝细胞和肝内胆管上皮细胞表达,研究表明肝内胆汁淤积可促进GGT的合成、分泌,从而使外周血中的GGT含量增加,提示血清GGT的变化水平与肝脏疾病程度密切相关[14]。同样,ALP也是反映肝脏受损的敏感指标,研究报道表明HCC患者血清ALP的动态变化与肝脏受损范围的面积呈正相关性,甚至AFP假阴性HCC患者血清中ALP呈阳性表达,可用于辅助筛查早期HCC[15]。与以往报道类似,本研究同样发现在肝癌组患者血GGT、ALP的水平明显要高于其他三组。
综上所述,血清AFP-IgM复合物、Hcy、肝功能指标(GGT)均可作为诊断HCC的指标,而单项参数的诊断效能均有一定程度的自限性,而联合多项参数可通过互补不足的方式,提高的检出率。本研究结果发现联合检测的灵敏度、效能均显著高于任意单项参数,提示血清AFP-IgM复合物、HCY联合各项肝功能指标有望成为鉴别慢性肝炎、肝硬化、肝癌的有力手段,同样对于早期发现HCC具有重要意义。
作者简介:刘东方(1971-),男,副主任医师,研究方向:普外肿瘤。
参考文献:
[1]Usmani A,Mishra A,Ahmad M.Nanomedicines:a theranostic approach for hepatocellular carcinoma[J].Artif Cells Nanomed Biotechnol,2017,8:1.
[2]Jiang H,Zhang X,Tao Y,et al.Prognostic and clinicopathologic significance of SIRT1 expression in hepatocellular carcinoma[J].Oncotarget,2016,22,8(32):52357.
[3]Wu J,Zou H,Jiang JT,et al.Clinical application of serum alpha- fetoprotein- IgM complexes on the diagnosis of primary hepatocellular carcinoma in Kazakh and Han populations[J].Tumori,2013,99(4):535.
[4]Pastore A,Alisi A,di Giovamberardino G,et al.Plasma levels of homocysteine and cysteine increased in pediatric NAFLD and strongly correlated with severity of liver damage[J].Int J Mol Sci,2014,15(11):21202.
[5]肖 健,熊怀民,钱建平,等.血清同型半胱氨酸在肝炎、肝硬化及肝癌中的诊断价值研究[J].中国卫生检验杂志,2015,25(14):2315.
[6]中华医学会肝病学分会.慢性乙型肝炎防治指南[J].中华肝脏病志,2005,13(12):881.
[7]中华医学会肝病学分会.原发性肝癌规范化诊治的专家共识[J].中华肝脏病志,2009,17(6):403.
[8]Abdel-Rahman O.Assessment of the discriminating value of the 8th AJCC stage grouping for hepatocellular carcinoma[J].HPB(Oxford),2017,4.pii:S1365- 182X(17)30890-0.
[9]Trevisani F,D′Intino PE,Morselli- Labate AM,et al.Serum alpha-fetoprotein for diagnosis of hepatocellular carcinoma in patients with chronic liver disease:influence of HBsAg and anti- HCV status[J].J Hepatol,2001,34(4):570.
[10]Lee HY,Jung JH,Kang YS,et al.Clinical significance of transiently elevated serum AFP level in developing hepatocellular carcinoma in HBsAg positive-liver cirrhosis[J].Korean J Gastroenterol,2004,43(4):252.
[11]罗子俨,秦锡虎,徐 斌,等.血清 AFP-Ig M 复合物联合肝功能检测对原发性肝癌的评价[J].重庆医科大学学报,2012,37(8):690.
[12]Jiang J,Wu C,Shen Y,et al.Clinical application of determining serum AFP-IgM complexes for diagnosis of small hepatocellular carcinoma[J].Anticancer Res,2011,31(2):687.
[13]Liu DS,Wang SL,Li JM,et al.Allicin improves carotid artery intima- media thickness in coronary artery disease patients with hyperhomocysteinemia[J].Exp Ther Med,2017,14(2):1722.
[14]Aygun C,Altnok A,Çakr A,et al.Acute temozolomide induced liver injury:Mixed type hepatocellular and cholestatic toxicity[J].Acta Gastroenterol Belg,2016,79(4):487.
[15]Wu SJ,Lin YX,Ye H,et al.Prognostic value of alkaline phosphatase,gamma-glutamyl transpeptidase and lactate dehydrogenase in hepatocellular carcinoma patients treated with liver resection[J].Int J Surg,2016,36(Pt A):143.
