动物双歧杆菌细菌素bif i docin A群体感应合成调控行为分析
2018-06-26刘国荣任桂美王成涛
刘国荣,任桂美,李 雪,王成涛*
(北京食品营养与人类健康高精尖创新中心,北京市食品添加剂工程技术研究中心,北京工商大学,北京 100048)
乳酸菌细菌素是乳酸菌在生长代谢过程中通过核糖体机制合成并分泌到环境中的一类具有抑菌活性的多肽或蛋白类物质,它在人体内可被降解,具有高效、无抗药性、无毒、无残留等优点,已成为益生菌生物活性代谢产物研究与开发的热点[1]。群体感应是微生物通过合成、分泌、感知与群体密度相关的信号分子,启动特定基因表达来适应环境变化的现象。群体感应现象的研究有助于了解微生物对外界环境的识别、认知机制,实现人为干扰或促进特定成分的表达以满足实际生产需要。群体感应涉及生物发光调控、毒力因子产生、生物被膜形成、细菌素合成等诸多生理过程[2]。
产细菌素乳酸菌普遍存在不同程度的群体感应现象,如栖鱼肉杆菌(Carnobacterium piscicola)LV17[3]、粪肠球菌(Enterococcus faecium)CTC492[4]、清酒乳杆菌(Lactobacillus sake)Lb706[5]、植物乳杆菌(L.plantarum)C11/NC8/J23/J51[6-9]、乳酸乳球菌(Lactococcus lactis)A164[10]、弯曲乳杆菌(L. curvatus)LTH1174[11]、嗜酸乳杆菌(L. acidophilus)La-5[12]、戊糖乳杆菌(L. pentosus)31-1[13]等都发现了与细菌素合成相关的群体感应系统。
目前普遍认可乳酸菌细菌素合成相关群体感应调控系统由自诱导肽和双组分信号转导蛋白(组氨酸蛋白激酶和感应调节蛋白)组成。自诱导肽作为信号分子,其浓度随细菌密度增大而增加,当达到临界浓度时,会激活位于细胞膜上的组氨酸蛋白激酶,使其羧基端所含的一个保守组氨酸残基位点发生自我磷酸化。磷酸基团转移至与其相邻感应调节蛋白信号输出区域的保守天冬氨酸残基位点,使其发生磷酸化。磷酸化的感应调节蛋白可以与目的基因启动子区域的DNA结合位点结合,从而激活细菌素基因转录表达[14-16]。
动物双歧杆菌(Bif i dobacterium animalis)BB04分离自中国新疆于田长寿老人肠道,是国内外首次报道的产细菌素动物双歧杆菌,可代谢合成新型双歧杆菌细菌素bif i docin A,该细菌素广谱高效且食品加工适应性好,有作为天然食品生物防腐剂的巨大应用潜力,前期课题组已对该细菌素的分子结构、特性、合成条件及抑菌机理进行了系统研究[17-21]。为进一步探讨细菌素bifidocin A的生物合成调控机制,本研究通过分析发酵过程中菌体密度和细菌素合成的变化趋势以及检测发酵液中有诱导活性的信号分子,探究动物双歧杆菌BB04代谢产细菌素是否存在群体感应调控系统,并初步明确其自诱导肽分子特性。研究结果对于全面揭示乳酸菌细菌素在发酵环境中的合成调控行为以及实现调控细菌素的高效表达具有重要科学意义。
1 材料与方法
1.1 材料与试剂
动物双歧杆菌BB04,分离自中国新疆于田长寿老人肠道[17];单核细胞性李斯特菌(Listeria monocytogenes)ATCC 35152 美国典型微生物菌种保藏中心;MRS(Man Rogosa Sharpe)、胰蛋白胨大豆肉汤(tryptic soy broth,TSB)培养基 北京陆桥技术有限责任公司;改良MRS培养基为在普通MRS培养基中加入0.035%的L-半胱氨酸盐酸和0.35%的玉米浆。
3 kDa超滤管(15 mL) 美国Millipore公司;Sephadex G25葡聚糖凝胶柱 美国GE公司。
1.2 仪器与设备
AKTA purifier100蛋白质纯化仪 美国GE公司;L C-20A分析型高效液相色谱 日本岛津公司;Concentrator plus真空离心浓缩仪 德国Eppendorf公司;4800 Plus基质辅助激光解析电离飞行质谱(matrixassisted laser desorption/ionization time of flight-mass spectrometry,MALDI-TOF-MS)仪 美国AB SCIEX公司。
1.3 方法
1.3.1 菌体生长及细菌素合成的动态变化
将动物双歧杆菌BB04按照1%接种量接种到改良MRS液体培养基中,选择发酵起始pH值为7.0,37 ℃培养45 h,期间定期取样测定其活菌数、抑菌活性及pH值。活菌计数采用亨盖特厌氧滚管法;抑菌活性检测以单核细胞性李斯特菌ATCC 35152为敏感指示菌,具体测定方法见参考文献[17]。
1.3.2 细菌素生物合成相关群体感应系统的存在判断
1.3.2.1 低产细菌素培养模型体系构建
为获得可合成较低水平细菌素的菌株培养模型体系,基于前期对菌株BB04代谢产细菌素培养条件的研究[20],在接种量(1%)和培养时间(24 h)不变情况下,选择3 种可以明显影响细菌素合成的条件(培养温度、培养基起始pH值、培养基浓度(改良MRS培养基稀释比例))为变量;设置了12 种不同培养条件组合(表1),通过对菌体生长及细菌素合成变化情况测定分析,确定低产细菌素培养模型体系的培养条件。
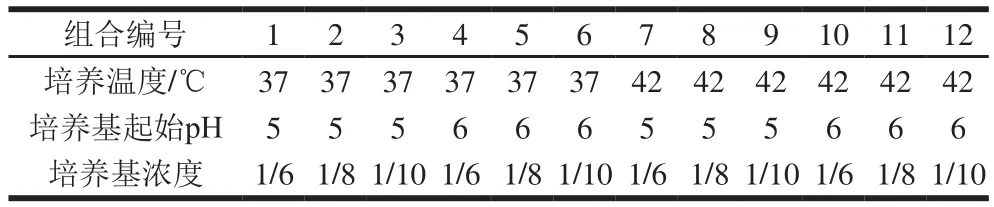
表1 实验设置的12 种不同培养条件组合Table1 Twelve different combinations of culture conditions
1.3.2.2 发酵上清液中群体感应自诱导肽的检测
基于1.3.2.1节中所确定的低产细菌素培养模型体系,添加不同浓度的中和后发酵上清浓缩液,通过检测细菌素抑菌活性的变化,分析确定发酵液上清液中是否存在可诱导细菌素合成的群体感应自诱导肽,并初步判断菌株BB04代谢产细菌素相关群体感应系统的存在与否。具体包括:1)将动物双歧杆菌BB04以1%接种量,发酵起始pH 7.0,37 ℃培养24 h后,8 000 r/min离心10 min获得发酵上清液,用1 mol/L NaOH溶液调其pH值为7.0左右,并通过真空离心浓缩仪获得中和后发酵上清液的10 倍(下同)浓缩液,4 ℃贮藏备用;2)培养初期,在低产细菌素培养模型体系分别加入体积分数为0.2%、1%及2%的中和后发酵上清浓缩液,在37 ℃共培养诱导24 h,作为实验组;3)培养末期,在低产细菌素培养模型体系分别加入0.2%、1%及2%的中和后发酵上清浓缩液,未在培养过程中进行诱导,作为对照组;4)通过检测比较处理组和对照组以及处理前后细菌素的抑菌活性变化,分析发酵上清液中是否存在有诱导活性的信号分子;5)以未添加中和后发酵上清浓缩液且未诱导的低产细菌素培养模型体系为空白组。
1.3.3 发酵液中自诱导肽的分离提取与鉴定
通过超滤管筛分及葡聚糖凝胶柱层析对发酵上清液中的自诱导肽进行提取纯化,并采用高效液相色谱检测纯化后样品纯度,进而借助MALDI-TOF-MS获得自诱导肽的分子质量信息。具体包括:1)将中和的发酵上清浓缩液用截留分子质量为3 kDa的超滤管筛分成两部分,分子质量大于3 000 Da组分和500~3 000 Da组分;并将各组分分别添加到低产细菌素培养模型体系,通过检测所合成细菌素的抑菌活性,分析各组分是否存在诱导活性;2)将上步中确定有诱导活性的组分进一步通过Sephadex G25柱层析进行纯化,通过真空离心浓缩仪回收分离组分,同样将所分离得到的各个组分分别添加到低产细菌素培养模型体系,通过检测所合成细菌素的抑菌活性,分析各组分是否有诱导活性;3)将上步中确定有诱导活性的组分进行高效液相色谱检测,确定样品纯度;4)对达到液相纯度的自诱导肽样品进行MALDITOF-MS检测分子质量。
2 结果与分析
2.1 菌体生长及细菌素合成的动态变化过程

图1 动物双歧杆菌BB04的生长曲线及其抑菌活性曲线Fig.1 Production of bacteriocin by strain BB04
动物双歧杆菌BB04的生长曲线及代谢合成细菌素活性曲线如图1所示,细菌素bifidocin A在对数生长期后中期12 h开始产生,并随着菌体密度增长而持续增加,当达到24~33 h(稳定期)时,细菌素活性达到最高640 AU/mL,之后随着菌体细胞生长进入衰亡期,菌体细胞开始减少,细菌素活性也随之减弱。从以上结果可以看出,当菌体细胞达到一定密度(活菌数对数值为7.31)时,细菌素才开始合成;随着菌体密度的增加,细菌素的合成表现一定的增长相关性;这表明基于群体感应的细胞间交流可能是细菌素bif i docin A合成的主要调控机制,群体感应作为细胞密度函数,可使细菌素合成保持一定的同步性。
2.2 细菌素生物合成相关群体感应系统的存在判断
2.2.1 低产细菌素培养体系模型的构建

图2 不同培养条件对菌体生长及细菌素合成的影响Fig.2 Effects of different culture conditions on the growth of strain BB04 and the production of bacteriocin
分析12 种不同培养条件组合下菌体生长及细菌素合成变化情况,由图2可以看出,不同培养条件下,菌体密度和细菌素活性变化差异显著(P<0.05);菌体密度和细菌素活性变化趋势基本同步;在组合8和9条件下,菌株不能代谢产生细菌素;在组合3条件下,菌株可代谢产生较低水平的细菌素,其细菌素抑菌活性仅有93 AU/mL。根据以上结果,确定低产细菌素培养模型体系的培养条件为:培养温度37 ℃、培养基起始pH 5、培养基1/10改良MRS、接种量1%、培养时间24 h。
2.2.2 发酵上清液中群体感应自诱导肽检测结果
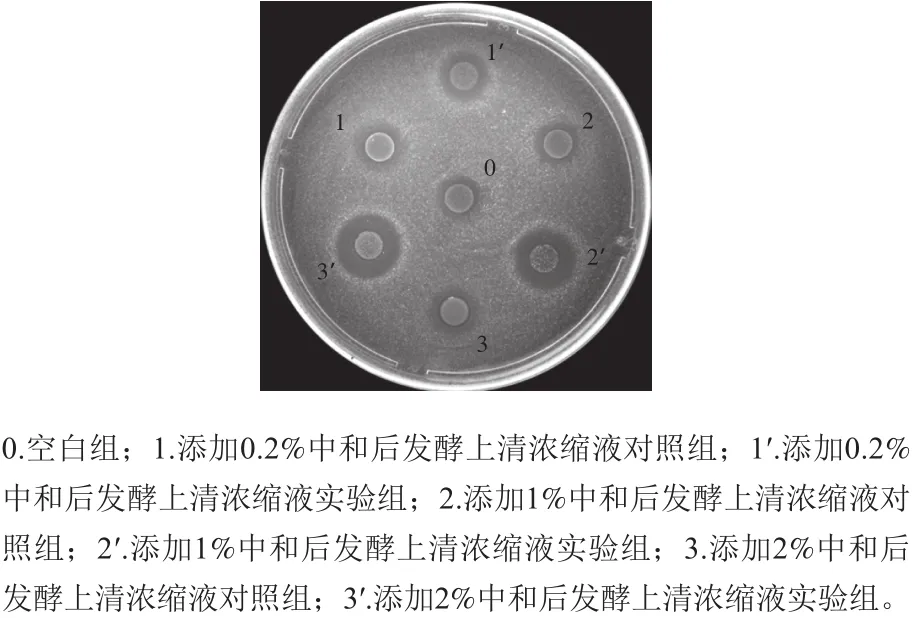
图3 发酵上清液中自诱导肽的检测结果Fig.3 Detection of auto-inducing peptide in the broth supernatant of strain BB04
如图3所示,添加0.2%、1%及2%的中和后发酵上清浓缩液但未经诱导的对照组抑菌活性与未添加中和后发酵上清浓缩液且未诱导空白组抑菌活性基本无变化,效价均在93 AU/mL左右;当添加0.2%中和后发酵上清浓缩液时,实验组抑菌活性为115 AU/mL,与未诱导对照组的细菌素活性差异不显著(P>0.05);但当添加量为1%和2%时,实验细菌素活性分别达到396 AU/mL和484 AU/mL,明显高于未诱导对照组(P<0.05),而且随着添加量的增加,诱导后细菌素活性增加更为明显。这些结果都说明,发酵上清液中存在可以诱导细菌素合成的自诱导肽,而且在一定范围内,自诱导肽含量越高,诱导合成的细菌素越多,活性越强。
2.3 发酵液中自诱导肽的分离提取与鉴定
为确定发酵液中自诱导肽的组成,首先用截留分子质量为3 kDa的超滤管对中和的发酵上清浓缩液进行初步筛分和诱导活性检测。由图4可知,分子质量大于3 000 Da组分可以检测到诱导活性,而500~3 000 Da组分未检测到诱导活性,却检测到了效价为1 280 AU/mL的抑菌活性。这说明自诱导肽存在于分子质量大于3 000 Da组分,而细菌素存在于500~3 000 Da组分,这与之前报道的细菌素bifidocin A分子质量(1 198.68 Da)一致[17]。接着将分子质量大于3 000 Da组分通过葡聚糖凝胶Sephadex G25柱分离,分离得到组分A、B及C(图5)。对其诱导活性进行检测,结果如图6所示,与未添加任何组分的低产细菌素培养模型体系下细菌素活性(93 AU/mL)相比较,添加组分B但未经诱导对照组细菌素活性为92 AU/mL,无明显变化(P>0.05),而添加组分B诱导后的细菌素活性明显增强(P<0.05),效价可达476 AU/mL。这说明组分B中存在可诱导细菌素合成的信号分子。对组分B进行高效液相色谱检测,仅检测到一个峰(图7),说明样品纯度达到分子质量检测纯度要求。

图4 3 kDa超滤管分离后各组分的诱导活性检测结果Fig.4 Activity of fractions separated by 3 kDa ultraf i ltration tubes

图5 葡聚糖凝胶色谱纯化结果图Fig.5 Purif i cation of auto-inducing peptide by Sephadex G-25 chromatography
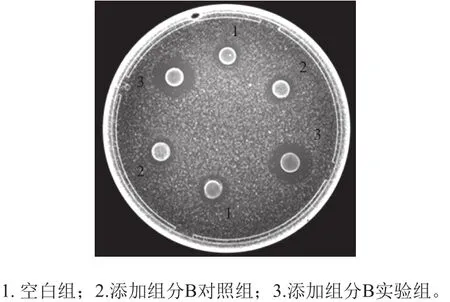
图6 葡聚糖凝胶分离组分B的诱导活性检测结果Fig.6 Activity of fraction B separated by Sephadex G-25 chromatography
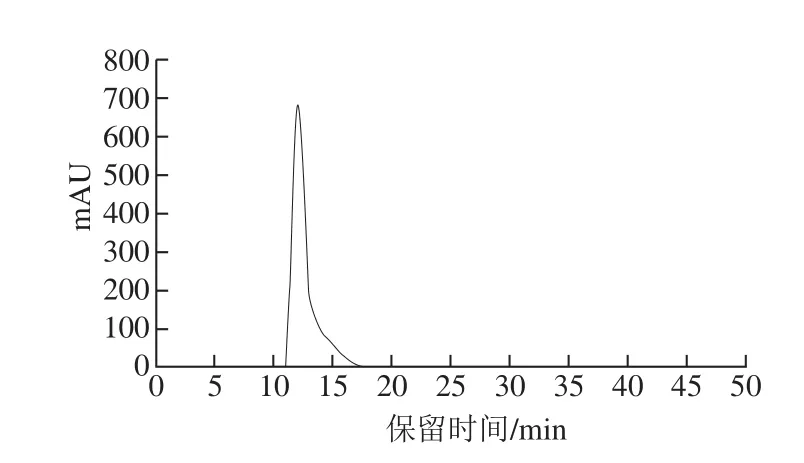
图7 葡聚糖凝胶分离组分B的高效液相色谱检测结果图Fig.7 Purif i cation of auto-inducing peptide by HPLC
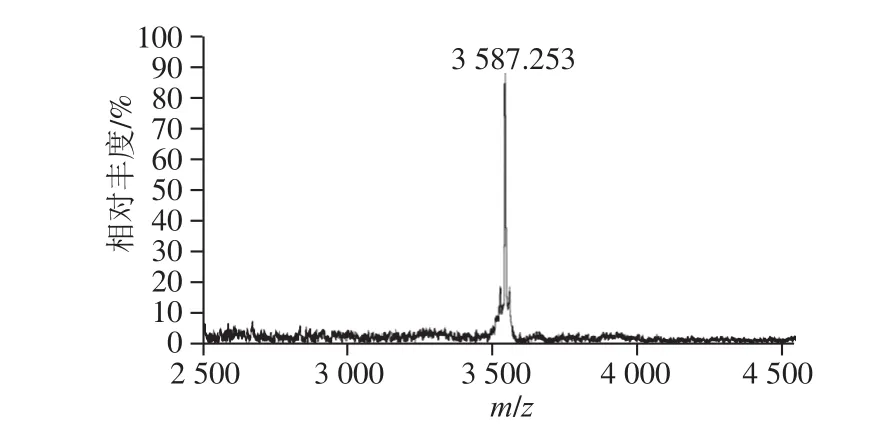
图 8 自诱导肽的MALDI-TOF-MS图Fig.8 Mass spectrum for auto-inducing peptide by MALDI-TOF-MS
如图8所示,液相色谱纯度的自诱导肽样品经MALDI-TOF-MS在m/z 500~4 500扫描范围内测定,分析得到细菌素bifidocin A生物合成相关群体感应系统自诱导肽的分子质量为3 587.253 Da。前期研究中已经确定细菌素的分子质量为1 198.68 Da[17]。这说明细菌素bif i docin A生物合成相关群体感应系统自诱导肽不是细菌素本身。已报道部分细菌素的自诱导肽同样不是细菌素本身,如张香美等[22]鉴定细菌素pentocin 31-1合成相关群体感应系统自诱导肽分子质量为2 985.16 Da,不同于细菌素(5 592.25 Da);Maldonado-Barragan等[23]则发现细菌素plantaricin NC8的自诱导肽是由pln8IF基因编码的多肽,不同于细菌素编码结构基因。然而,细菌素nisin和plantaricin A的自诱导肽却是细菌素本身[24-25]。这些结果表明,不同细菌素相关群体感应系统自诱导肽分子具有特异性,对于自诱导肽的检测很难建立通用方法。
3 讨 论
对多数菌株而言,群体感应系统是乳酸菌细菌素合成的主要调控机制。自诱导肽是启动细菌素群体感应系统的关键信号分子,也是判断细菌素群体感应系统存在的重要指标。目前,对自诱导肽组成及诱导活性的主要研究方法是在低于感应密度条件下,构建不产细菌素表型的培养物模型,或在较低感应密度条件下,构建低产细菌素表型培养物模型,并分别添加不同分子质量大小发酵液浓缩组分检测细菌素合成量及活性,分析鉴定可诱导合成细菌素的活性组分,初步判定细菌素群体感应系统的存在,进而参照多肽的提纯、分子质量、氨基酸序列及高级结构测定方法获得高纯度自诱导肽并分析其分子结构[26-27]。张香美等[22]鉴定细菌素pentocin 31-1合成相关群体感应系统自诱导肽分子质量为2 985.16 Da;Nilsen等[4]基于以上研究思路确定细菌素enteriocin A合成受群体感应系统调控,其自诱导肽EntF由25 个氨基酸组成,部分氨基酸序列为TLPGGLPASALVGPV。本研究通过构建低产细菌素培养物模型,初步确定细菌素bif i docin A存在生物合成相关群体感应系统,并鉴定其自诱导肽为3 587.253 Da多肽。该自诱导肽不是细菌素本身,也不同于目前已报道其他细菌素的自诱导肽[22-25],表明不同细菌素合成相关自诱导肽存在特异性,不同细菌素合成相关群体感应系统存在多样性。
此外,已有研究证据显示,部分环境条件可以通过调控群体感应系统影响细菌素的合成与表达。Verluyten等[11]研究了高浓度NaCl对细菌素合成的影响,发现2%NaCl在不影响细胞生长情况下就可抑制细菌素的合成,推测NaCl的添加可影响自诱导肽的结构稳定性或减少其合成或通过与双组份受体结合而干扰自诱导肽发挥诱导作用;然而张甲庆[27]则研究发现2% NaCl胁迫条件可促进植物乳杆菌KLDS1.0391合成细菌素能力,并推测NaCl的添加可增强自诱导肽诱导活性进而促进细菌素编码基因plnEF的表达水平;Ruiz-Barba等[28]发现在绿橄榄发酵过程通过共培养E. faecium 6T1a-20和P. pentosaceus FBB63可以促进L. plantarum NC8代谢产细菌素,并增强菌株对发酵环境胁迫条件的适应能力。以上表明,不同环境胁迫条件对细菌素合成影响差异较大,甚至在相同胁迫条件下,不同菌株代谢产细菌素的表现也各不相同,但这些环境因素是如何对自诱导肽结构与功能以及自诱导肽与双组分相互作用产生影响的机制等科学问题并不明确。未来加强乳酸菌细菌素的群体感应合成调控机理以及环境条件对群体感应系统的影响机制研究,不仅对提高乳酸菌细菌素的产量具有重要作用,而且对研究乳酸菌在不良生长环境中的适应竞争机制及其代谢调控也具有重要意义[29]。
[1] GALVEZ A, ABRIOUEL H, LOPEZ R L, et al. Bacteriocinbased strategies for food biopreservation[J]. International Journal of Food Microbiology, 2007, 120(1): 51-70. DOI:10.1016/j.ijfoodmicro.2007.06.001.
[2] GOBBETTI M, ANGELIS M D, CAGNO R D, et al. Cellcell communication in food related bacteria[J]. International Journal of Food Microbiology, 2007, 120∶ 34-45. DOI∶10.1016/j.ijfoodmicro.2007.06.012.
[3] SAUCIER L, POON A, STILES M E. Induction of bacteriocin in Carnobacterium piscicola LV17[J]. Journal of Applied Bacteriology,1995, 78(6)∶ 684-690. DOI∶10.1111/j.1365-2672.1995.tb03116.x.
[4] NILSEN T, NES I F, HOLO H. An exported inducer peptide regulates bacteriocin production in Enterococcus faecium CTC492[J]. Journal of Bacteriology, 1998, 180(7)∶ 1848-1854.
[5] DIEP D B, AXELSSON L, GREFSLI C, et al. The synthesis of the bacteriocin sakacin A is a temperature-sensitive process regulated by a pheromone peptide through a three component regulatory system[J].Microbiology, 2000, 146(3)∶ 2155-2160. DOI∶10.1099/00221287-146-9-2155.
[6] DIEP D B, HAVARSTEIN LS, NES I F. A bacteriocin-like peptide induces bacteriocin synthesis in Lactobacillus plantarum C11[J].Molecular Microbiology, 2004, 18(4)∶ 631-639. DOI∶10.1111/j.1365-2958.1995.mmi_18040631.x.
[7] ROJO-BEZARES B, SAENZ Y, NAVARRO L, et al. Characterization of a new organization of the plantaricin locus in the inducible bacteriocin producing Lactobacillus plantarum J23 of grape must origin[J]. Archives of Microbiology, 2008, 189(5)∶ 491-499.DOI∶10.1007/s00203-007-0342-6.
[8] MALDONADO A, RUIZ-BARBA J L, JIMENEZ-DIAZ R.Production of plantaricin NC8 by Lactobacillus plantarum NC8 is induced in the presence of different types of gram-positive bacteria[J].Archives of Microbiology, 2004, 181(1)∶ 8-16. DOI∶10.1007/s00203-003-0606-8.
[9] NAVARRO L, ROJO-BEZARES B, SAENZ Y, et al. Comparative study of the pln locus of the quorum-sensing regulated bacteriocin producing L. plantarum J51 strain[J]. Food Microbiology, 2008,128(2)∶ 390-394. DOI∶10.1016/j.ijfoodmicro.2008.08.004.
[10] KLEEREBEZEM M. Quorum sensing control of lantibiotic production;nisin and subtilin autoregulate their own biosynthesis[J]. Peptides,2004, 25(9)∶ 1405-1414. DOI∶10.1016/j.peptides.2003.10.021.
[11] VERLUYTEN J, MESSENS W, VUYST L D. Sodium chloride reduces production of curvacin A, a bacteriocin produced by Lactobacillus curvatus strain LTH 1174, originating from fermented sausage[J]. Applied and Environmental Microbiology, 2004, 70(4)∶2271-2278. DOI∶10.1128/AEM.70.4.2271-2278.2004.
[12] TABASCO R, GARCÍA-CAYUELA T, PELAEZ C, et al.Lactobacillus acidophilus La-5 increases lactacin B production when it senses live target bacteria[J]. International Journal of Food Microbiology, 2009, 132(s2/3)∶ 109-116. DOI∶10.1016/j.ijfoodmicro.2009.04.004.
[13] ZHANG X M, LIU G R, ZHAO B, et al. New insight into the regulation of classII bacteriocin production by quorum sensing in Lactobacillus pentosus 31-1[J]. African Journal of Microbiology Research, 2012, 6(15)∶ 3582-3588. DOI∶10.5897/AJMR11.1147.
[14] EIJSINK G H V, AXELSSON L, DIEP D B, et al. Production of class II bacteriocins by lactic acid bacteria; an example of biological warfare and communication[J]. Antonie Van Leeuwenhoek, 2002, 81(1)∶ 639-654.
[15] 满丽莉, 孟祥晨, 王辉, 等. 群体感应系统在乳酸菌产细菌素中的作用[J]. 食品科学, 2011, 32(13)∶ 360-364.
[16] 张香美, 李平兰. 产II类细菌素乳酸菌群体感应及其应用[J]. 微生物学报, 2011, 51(9)∶ 1152-1157. DOI∶10.13343/j.cnki.wsxb.2011.09.002.
[17] LIU G R, REN L, SONG Z Q, et al. Purif i cation and characteristics of bif i docin A, a novel bacteriocin produced by Bif i dobacterium animals BB04 from centenarians’ intestine[J]. Food Control, 2015, 50(4)∶ 889-895. DOI∶10.1016/j.foodcont.2014.10.049.
[18] LIU G R, SONG Z Q, YANG X L, et al. Antibacterial mechanism of bifidocin A, a novel broad-spectrum bacteriocin produced by Bifidobacterium animalis BB04[J]. Food Control, 2016, 62(6)∶ 309-316. DOI∶10.1016/j.foodcont.2015.10.033.
[19] LIU G R, REN G M, ZHAO L, et al. Antibacterial activity and mechanism of bifidocin A against Listeria monocytogenes[J]. Food Control, 2017, 73∶ 854-861. DOI∶10.1016/j.foodcont.2016.09.036.
[20] 任丽. 新型双歧杆菌细菌素bifidocin A的提纯、特性及分子结构研究[D]. 北京∶ 北京工商大学, 2015∶ 20-29.
[21] 刘国荣, 郜亚昆, 王欣, 等. 双歧杆菌细菌素bifidocin A对金黄色葡萄球菌的抑菌作用及其机制[J]. 食品科学, 2017, 38(17)∶ 1-7.DOI∶10.7506/spkx1002-6630-201717001.
[22] 张香美, 张宝, 李平兰. 戊糖乳杆菌群体感应信号肽AIP 的纯化及鉴定[J]. 中国食品学报, 2015, 15(3)∶ 201-206. DOI∶10.16429/j.1009-7848.2015.03.027.
[23] MALDONADO-BARRAGAN A, RUIZ-BARBA J L, JIMENEZDIAZ R. Knockout of three-component regulatory systems reveals that the apparently constitutive plantaricin-production phenotype shown by Lactobacillus plantarum on solid medium is regulated via quorum sensing[J]. International Journal of Food Microbiology, 2009, 130(1)∶35-42. DOI∶10.1016/j.ijfoodmicro.2008.12.033.
[24] CHEIGH C I, PARK H, CHOI H J, et al. Enhanced nisin production by increasing genes involved in nisin Z biosynthesis in Lactococcus lactis subsp. lactis A164[J]. Biotechnology Letters, 2005, 27∶ 155-160.DOI∶10.1007/s10529-004-7661-3.
[25] STRAUME D, KJOS M, NES I F, et al. Quorum-sensing based bacteriocin production is down-regulated by N-terminally truncated species of gene activators[J]. Molecular Genetics and Genomics, 2007,278(3)∶ 283-293. DOI∶10.1007/s00438-007-0251-z.
[26] 葛菁萍, 房保柱, 苑婷婷, 等. 副干酪乳杆菌 HD1.7 群体感应行为[J]. 微生物学报, 2011, 51(11)∶ 1561-1567. DOI∶10.13343/j.cnki.wsxb.2011.11.017.
[27] 张甲庆. 环境胁迫对植物乳杆菌KLDS1.0391葡萄糖代谢和细菌素合成的影响[D]. 哈尔滨∶ 东北农业大学, 2014∶ 26-28.
[28] RUIZ-BARBA J L, CABALLERO-GUERRERO B, MALDONADOBARRAGAN A, et al. Coculture with specific bacteria enhances survival of Lactobacillus plantarum NC8, an autoinducer-regulated bacteriocin producer, in olive fermentations[J]. Food Microbiology,2010, 27(3)∶ 413-417. DOI∶10.1016/j.fm.2009.10.002.
[29] TABASCO R, PALENCIA P F D, FONTECHA J, et al. Competition mechanisms of lactic acid bacteria and bifidobacteria∶ fermentative metabolism and colonization[J]. LWT-Food Science and Technology,2014, 55∶ 680-684. DOI∶10.1016/j.lwt.2013.10.004.
