野阳合多糖及其纯化组分对胆汁酸的结合能力
2018-06-26岳雨曦王小燕柏丁丁黄毅娜
岳雨曦,王小燕,柏丁丁,黄毅娜,钟 凯,*,高 鸿
(1.四川大学轻纺与食品学院,四川 成都 610065;2.四川大学华西公共卫生学院,四川 成都 610041)
野阳合(Habenaria ciliolaris Kranzl)为双子叶兰科植物[1],亦称毛葶玉凤花[2]、洋合[3]。主要分布于长江流域及以南各省区。野阳合作为一种富含膳食纤维、蛋白质、氨基酸、维生素及矿物元素等的野生蔬菜[4],在湖南[4]、湖北[5]、川南等地区有悠久的食用历史,可凉拌、炒食、酱藏、腌渍,也可制作果脯、果汁等,深受当地人民喜爱。研究显示野阳合原为野生,生命力极强,无需药物制剂防治病虫害,属纯天然绿色食品[3]。野阳合资源丰富,产量高,经济效益显著,每667 m2的年收益高达5 000 元以上[3]。
多糖是由十个以上的单糖通过糖苷键聚合而成的天然高分子化合物,具有促进免疫调节、抗肿瘤及降血脂等生物功能,且安全、无毒,备受国内外研究者青睐,是食品、医药、农业等领域研究的热点[6]。多糖的提取宗旨是,在不破坏多糖基本性质的基础上实现有效提取。多糖是极性大分子,不溶于有机试剂,难溶于冷水,易溶于热水,多糖的传统提取方法多为热水提取[7]。对野阳合的研究,目前主要集中在无公害栽培技术[3]和资源开发利用[4]方面,有关野阳合多糖的研究目前鲜见报道。本研究拟采用水提醇沉法初步探究野阳合多糖结构等特征。多糖对胆汁酸的结合被认定为其降低胆固醇的机理之一。多糖通过对胆汁酸的结合,防止其重吸收,并刺激血浆和肝脏中的胆固醇转化为胆汁酸,消耗更多的胆固醇[8]。野阳合富含膳食纤维,本研究拟通过模拟肠道内环境,探究野阳合多糖体外结合胆汁酸的能力。
本研究以野阳合为原料,提取野阳合粗多糖,采用DEAE-纤维素52柱和TOYOPEARL HW-65柱分离纯化得到4 种多糖组分,对其理化性质、结构特点以及对胆汁酸的结合能力进行研究,为野阳合在辅助降血脂功能食品中的开发利用提供参考。
1 材料与方法
1.1 材料与试剂
野阳合,采自四川雅安,由四川农业大学徐正君教授鉴定为野阳合(Habenaria ciliolaris Kranzl),常温阴干后保存于四川大学食品工程系备用。
DEAE-纤维素52 合肥博美生物科技有限公司;TOYOPEARL HW-65 日本TOSOH公司;单糖标准品(鼠李糖、葡萄糖、岩藻糖、甘露糖、阿拉伯糖、半乳糖、果糖) 美国Supelco公司;葡聚糖标准品(T9、T60、T130、T400、T990、T1740、T3750) 美国Sigma-Aldrich公司;胆汁酸 源叶生物科技有限公司;猪胰酶 锐阳生物科技有限公司;氯仿、正丁醇、苯酚、浓硫酸、乙腈、无水乙醇、氢氧化钠、盐酸、三氟乙酸、溴化钾 成都科龙化工试剂厂。所用试剂均为分析纯。
1.2 仪器与设备
AU480全自动生化分析仪 美国Beckman Coulter公司;SARNSPEED 1736R高速冷冻离心机 丹麦Labogene公司;BSA224S分析天平 德国Sartorius公司;SPECTRA MAX190酶标仪 美国Molecular Devices公司;高效液相色谱系统(配有蒸发光散射检测器-LT II检测器) 日本Shimadzu公司;LGJ-50F冷冻干燥机北京松源华兴科技发展有限公司;RV10CS25旋转蒸发仪德国IKA公司;Nicolet 6700红外光谱仪 美国Thermo公司;BSZ-100自动部分收集器、HL-系列数显转速恒流泵 上海市青浦泸西仪器厂。
1.3 方法
1.3.1 野阳合粗多糖的提取
参照Huang Danmin等[9]报道的水提醇沉法。称取野阳合干品100 g,经90%乙醇溶液脱脂脱色,抽滤,烘干滤渣,按料液比1∶50(g/mL)加入90 ℃的热水,搅拌浸提4 h,重复3 次,合并提取液并减压浓缩;将浓缩液与Sevag试剂(三氯甲烷-正丁醇(4∶1,V/V))按体积比1∶1混合脱蛋白,8 000 r/min离心15 min,得上层溶液即为多糖溶液;经磁力搅拌透析48 h(透析袋截留分子质量为3 500 Da)[10],4 ℃醇沉12 h,真空冷冻干燥,得野阳合粗多糖(记作YP)。
1.3.2 野阳合多糖的分离纯化
1.3.2.1 DEAE-纤维素52离子交换柱层析纯化
称取野阳合粗多糖0.1 g,溶于10 mL超纯水,上样至DEAE-纤维素52柱(3 cm×50 cm),依次用超纯水、0.1、0.3 mol/L和0.5 mol/L NaCl溶液洗脱[11],流速1.5 mL/min,每管收集洗脱液3 mL,苯酚-硫酸法检测并收集A490nm大于0.1的多糖组分,透析除盐,真空冷冻干燥得初步分离纯化的多糖组分YP1、YP2和YP3。
1.3.2.2 TOYOPEARL HW-65凝胶柱层析纯化
称取初步分离得到的各多糖组分0.05 g溶于5 mL超纯水,上样至TOYOPEARL HW-65凝胶柱层析柱(2.6 cm×70 cm)[12],用超纯水洗脱,流速为1 mL/min,每管收集洗脱液3 mL,苯酚-硫酸法检测并收集A490nm大于0.1的多糖组分,透析除盐,真空冷冻干燥得到纯化野阳合多糖组分,分别为YP1-1、YP2-1、YP2-2和YP3-1。
1.3.3 野阳合粗多糖的总糖含量测定
采用苯酚-硫酸法[13]测定野阳合多糖的总糖含量。以葡萄糖为标准品,标准曲线回归方程为:Y=4.878 2X+0.060 2(R2=0.995),其中,X为多糖质量浓度,Y为490 nm波长处样品的吸光度。取野阳合粗多糖配制成质量浓度为0.1 mg/mL的多糖溶液,加入1 mL 6%苯酚溶液,涡旋振荡,再加入5 mL浓硫酸,涡旋振荡,90 ℃水浴反应20 min后,静置冷却至室温,在490 nm波长处测定吸光度。将吸光度带入标准曲线计算出野阳合粗多糖的总糖含量。
1.3.4 野阳合多糖的紫外光谱分析
紫外光谱分析法能鉴定多糖样品中是否还含有蛋白或核酸类杂质[14]。称取YP1-1、YP2-1、YP2-2和YP3-1,配制成质量浓度为0.5 mg/mL的多糖溶液,用紫外-可见分光光度计在波长200~700 nm范围内扫描,检测是否存在蛋白质和核酸的特征吸收峰。
1.3.5 野阳合多糖的纯度鉴定和分子质量测定
采用高效液相色谱与蒸发光散射检测器联用测定野阳合多糖纯度及分子质量[15]。将标准葡聚糖(T9、T60、T130、T400、T990、T1740、T3750)及YP1-1、YP2-1、YP2-2和YP3-1,分别配制成质量浓度为3 mg/mL的多糖溶液,0.45 μm微孔滤膜过滤后进样。以标准葡聚糖样品分子质量的对数值(lgmw)为纵坐标,以标准葡聚糖样品出峰时的保留时间(t)为横坐标,绘制标准曲线。记录各野阳合多糖组分出峰时的保留时间,代入标准曲线计算出各多糖组分的分子质量,并根据高效凝胶渗透色谱洗脱峰形判断多糖纯度。
色谱条件:TSK-gel G5000PWxl色谱柱(7.8 mm×300 mm,10 μm);蒸发光散射检测器-LT II(雾化温度35 ℃、压力3.50 bar、检测灵敏度6);流动相为双蒸水;流速0.6 mL/min;柱温25 ℃;进样量20 μL。
1.3.6 野阳合多糖的红外光谱分析
采用溴化钾(KBr)晶体压片法[16]分析野阳合多糖样品的红外光谱。分别称取YP1-1、YP2-1、YP2-2和YP3-1样品各2 mg,各按质量比1∶100与干燥的KBr混合均匀,在玛瑙研钵中充分研磨10 min,用压片机制膜,再用红外光谱仪在波数4 000~400 cm-1范围内进行红外光谱扫描,采用干燥的光谱纯KBr作背景对照。
1.3.7 野阳合多糖的单糖组成分析
采用1-苯基-3-甲基-5-吡唑啉酮(3-methyl-1-phenyl-2-pyrazolin-5-one,PMP)柱前衍生高效液相色谱法测定野阳合多糖的单糖组成[17]。称取YP1-1、YP2-1、YP2-2、YP3-1和单糖标准品(甘露糖、鼠李糖、岩藻糖、果糖、阿拉伯糖、葡萄糖和半乳糖),分别加入4 mL 2 mol/L三氟乙酸溶液,封管,110 ℃水解6 h,冷却至室温,反复加入甲醇减压蒸干,除去三氟乙酸。蒸干的样品溶于500 μL蒸馏水,依次加入500 μL 0.3 mol/L的NaOH溶液和500 μL 0.5 mol/L的PMP-甲醇溶液,混匀;70 ℃水浴反应100 min,取出置于冷水浴中10 min;再加500 μL 0.3 mol/L的HCl溶液中和,用氯仿萃取3 次,0.45 μm微孔滤膜过滤,待高效液相色谱进样分析。
色谱条件:Archrom Bond-AQ C18反相色谱柱(4.6 mm×150 mm,5 μm);紫外检测器,检测波长254 nm;流动相为0.3 mol/L磷酸盐(pH 6.7)缓冲液-乙腈(83∶17,V/V);流速1.0 mL/min;柱温30 ℃;进样量10 μL。
1.3.8 野阳合多糖对胆汁酸的结合能力测定
参照Zeng Hongliang等[18]报道的方法,通过模拟肠道内环境,测定野阳合多糖体外结合胆汁酸的能力。将0.5 mL多糖溶液(5、15 mg/mL和25 mg/mL)和0.25 mL 0.01 mol/L的盐酸溶液在37 ℃条件下充分搅拌反应1 h,再加入0.1 mol/L的NaOH溶液将混合液pH值调节至6.3。向混合液中加入1 mL胆汁酸混合液(7.2 mmol/L),搅拌混匀,再加入2 mL 10 mg/mL的猪胰酶溶液,提供消化用胰淀粉酶、胰蛋白酶和胰脂肪酶。37 ℃条件下充分搅拌反应1 h后,再加入20 mL无水乙醇,4 ℃醇沉12 h,8 000 r/min冷冻离心15 min,保留上清液。通过全自动生化仪测定上清液中胆汁酸含量。辛伐他汀为阳性对照。计算野阳合多糖相比于辛伐他汀对胆汁酸的结合能力。
1.4 数据分析
数据取3 次平行实验结果的平均值,采用IBM SPSS Statistics 19.0软件对实验数据进行方差分析和相关性分析。
2 结果与分析
2.1 野阳合多糖的提取与柱层析分离纯化
野阳合经热水浸提、Sevag法脱蛋白、透析、醇沉、真空冷冻干燥处理后得野阳合粗多糖,提取率为2.41%,其总糖质量分数为96.35%。
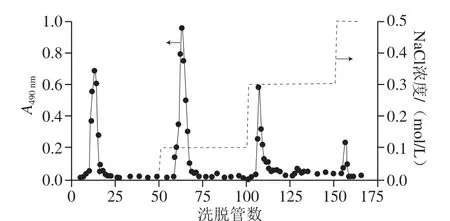
图1 野阳合粗多糖经DEAE-纤维素52柱层析分离的洗脱曲线Fig.1 Elution curve of YP on DEAE-cellulose 52 column
野阳合粗多糖经DEAE-纤维素52离子交换柱分离纯化后,以洗脱管数为横坐标,苯酚-硫酸法测得490 nm波长处的吸光度为纵坐标,绘制洗脱曲线如图1所示。各组分洗脱峰狭窄对称,表明分离效果好[19]。其中,经超纯水洗脱出的不带电荷的中性多糖组分为YP1[20],依次经0.1、0.3 mol/L和0.5 mol/L NaCl溶液洗脱出的组分为YP2、YP3和YP4。收集含量较大的YP1、YP2和YP3组分,经透析除盐、冷冻干燥后,采用TOYOPEARL HW-65凝胶层析柱进一步纯化。多糖组分YP1和YP3洗脱后均得到单一洗脱峰,分别为YP1-1和YP3-1,多糖组分YP2洗脱后得到2 个洗脱峰,分别为YP2-1和YP2-2。经冷冻干燥后,即得4 种蓬松状、呈白色的纯化野阳合多糖YP1-1、YP2-1、YP2-2和YP3-1。
2.2 野阳合多糖的紫外光谱分析

图2 野阳合粗多糖在波长200~700 nm的紫外扫描图谱Fig.2 UV absorption spectrum of YP
如图2所示,多糖样品溶液在波长260 nm和280 nm处均无明显吸收峰,表明其不含蛋白质及核酸杂质。这是由于Sevag试剂能使蛋白质变性,而且DEAE-纤维素52离子交换柱不仅能分离纯化野阳合多糖,还能有效去除色素及残余蛋白[21]。
2.3 野阳合多糖的纯度鉴定和分子质量测定
多糖的分子质量具有相对性,通常测定的分子质量是一种统计平均值,代表相似链长多糖分子质量平均值[22]。采用高效液相色谱与蒸发光散射检测器联用测定分离纯化得到的4 种多糖组分YP1-1、YP2-1、YP2-2和YP3-1的分子质量,结果如图3所示。4 种多糖均为单一峰,对称性较好,说明其纯度较高,分离纯化效果较好。采用高效液相色谱与蒸发光散射检测器联用,测定的葡聚糖标准品分子质量的标准曲线回归方程为:lgmw=-0.398 8t+10.420(R2=0.983),计算得出YP1-1、YP2-1、YP2-2和YP3-1的分子质量分别为3.52×106、3.08×106、1.93×106Da和3.35×106Da。
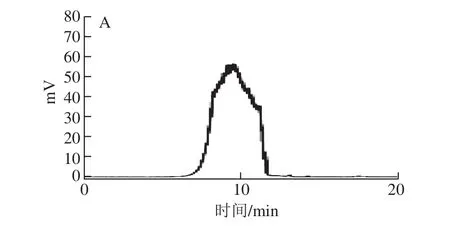

图3 4 种纯化野阳合多糖组分YP1-1、YP2-1、YP2-2、YP3-1的高效凝胶渗透色谱图Fig.3 HPGPC chromatograms of YP1-1, YP2-1, YP2-2, and YP3-1
2.4 野阳合多糖的红外光谱分析
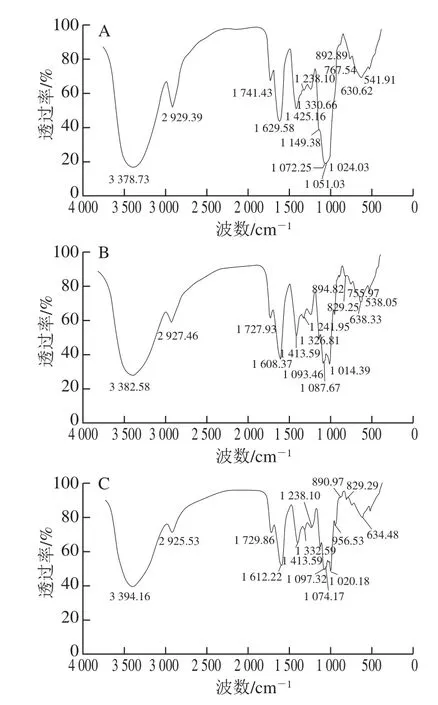
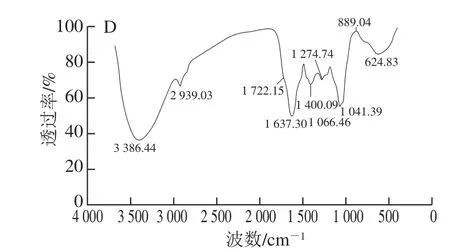
图4 4 种纯化野阳合多糖组分YP1-1、YP2-1、YP2-2、YP3-1的红外光谱图Fig.4 FT-IR spectra of YP1-1, YP2-1, YP2-2, and YP3-1
如图4所示,4 种野阳合多糖组分均在3 370~3 400 cm-1范围内出现宽而强的吸收带,它们是分子内或分子间氢键的O-H伸缩振动的结果[23];在2 920~2 940 cm-1范围内出现的吸收带是糖类C-H伸缩振动的结果;在1 720~1 750 cm-1范围内出现的强吸收带是多糖样品中乙酰基、酯基或羧基中C=O非对称伸缩振动的结果;在1 600~1 640 cm-1范围内出现吸收带,表明多糖含有一定量的结合水;在1 400~1 430 cm-1范围内出现的吸收带是糖类C-H变角振动的结果;在1 320~1 340 cm-1范围内出现的吸收带是羰基O-H弯曲振动的结果;在1 230~1 280 cm-1范围内出现的吸收带是乙酰基(C-O)伸缩振动的结果。YP1-1、YP2-1及YP2-2在1 100~1 000 cm-1范围内均出现3 个较强的吸收带,表明YP1-1、YP2-1及YP2-2含有吡喃糖,YP3-1在1 100~1 000 cm-1范围内出现2 个较强的吸收带,表明其含有呋喃糖和吡喃糖;YP1-1在892.89 cm-1处出现的吸收带,表明其糖苷键以β-构型为主;YP2-1在894.82 cm-1和829.25 cm-1处出现的吸收带,表明其糖苷键有β-构型和α-构型;YP2-2在890.97 cm-1和829.25 cm-1处出现的吸收带,表明其糖苷键有β-构型和α-构型;YP3-1在889.04 cm-1处出现的吸收带,表明其糖苷键以β-构型为主。
2.5 野阳合多糖的单糖组成分析
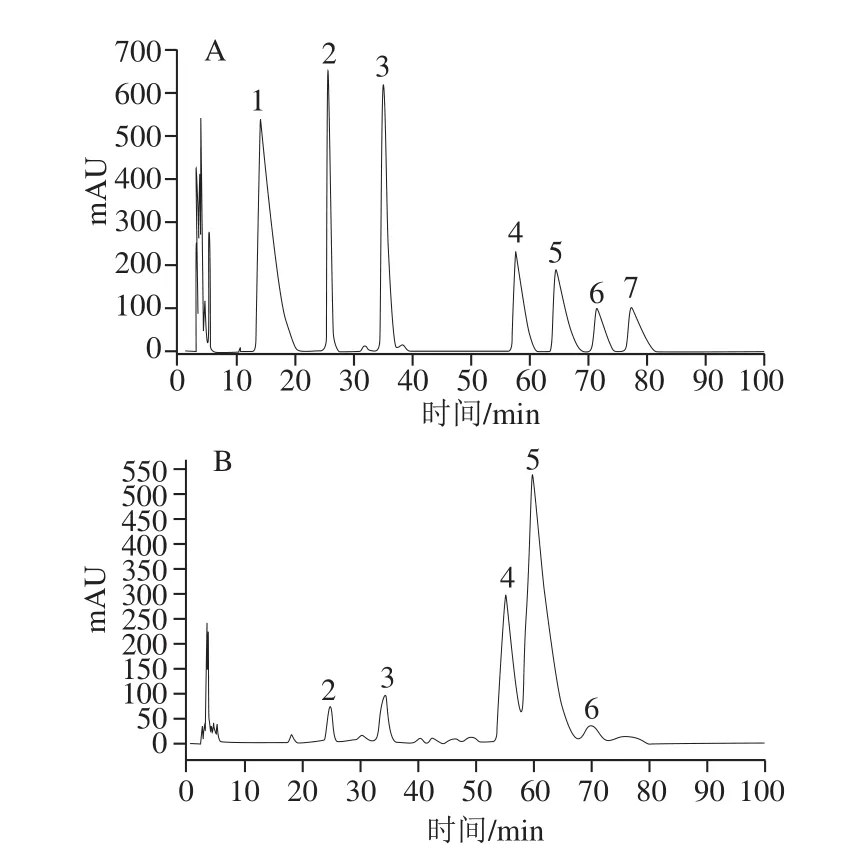
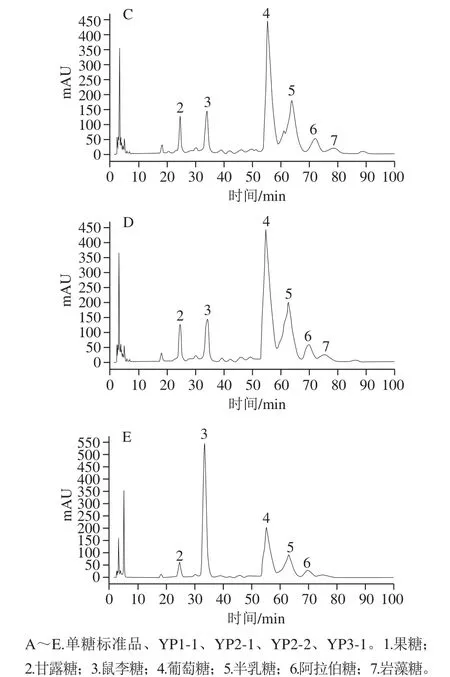
图5 单糖标准品(A)、4 种纯化野阳合多糖组分(B~E)的单糖组成高效液相色谱图Fig.5 HPLC chromatograms of mixed monosaccharide standards (A)and purif i ed polysaccharide fractions (B through E)
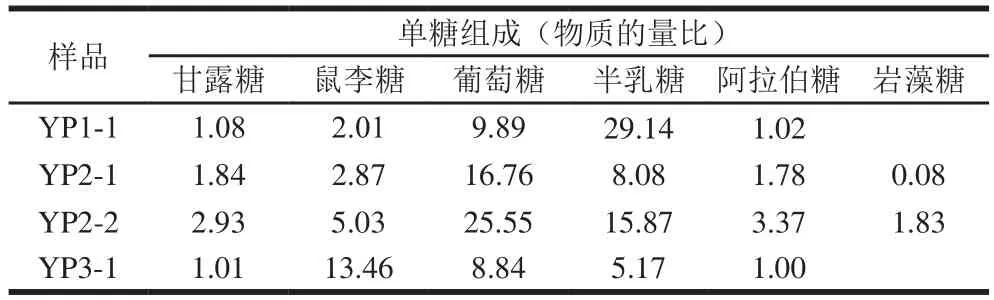
表1 4 种纯化野阳合多糖组分YP1-1、YP2-1、YP2-2、YP3-1的单糖组成Table1 Monosaccharide composition of YP1-1, YP2-1, YP2-2 and YP3-1
对4 种野阳合多糖组分YP1-1、YP2-1、YP2-2、YP3-1和单糖标准品(甘露糖、鼠李糖、岩藻糖、阿拉伯糖、果糖、葡萄糖和半乳糖)进行PMP柱前衍生化高效液相色谱分析,如图5所示,单糖组成物质的量比见表1。YP1-1、YP2-1、YP2-2和YP3-1均为杂多糖。YP1-1的单糖组成为甘露糖、鼠李糖、葡萄糖、半乳糖和阿拉伯糖,其物质的量比为1.08∶2.01∶9.89∶29.14∶1.02,说明YP1-1是主要由葡萄糖和半乳糖构成的中性多糖;YP2-1的单糖组成为甘露糖、鼠李糖、葡萄糖、半乳糖、阿拉伯糖和岩藻糖,其物质的量比为1.84∶2.87∶16.76∶8.08∶1.78∶0.08;YP2-2的单糖组成为甘露糖、鼠李糖、葡萄糖、半乳糖、阿拉伯糖和岩藻糖,其物质的量比为2.93∶5.03∶25.55∶15.87∶3.37∶1.83;YP3-1的单糖组成为甘露糖、鼠李糖、葡萄糖、半乳糖和阿拉伯糖,其物质的量比为1.01∶13.46∶8.84∶5.17∶1.00。对比发现,野阳合多糖的单糖组成和兰科植物金线莲[24]、铁皮石斛[25]、白及[26]多糖的单糖组成类似,金线莲[24]和铁皮石斛[25]多糖均由甘露糖、鼠李糖、葡萄糖、半乳糖、岩藻糖,5 种单糖组成;白及[26]多糖由岩藻糖、木糖、甘露糖、葡萄糖、半乳糖,5 种单糖组成。
2.6 野阳合多糖对胆汁酸的结合能力
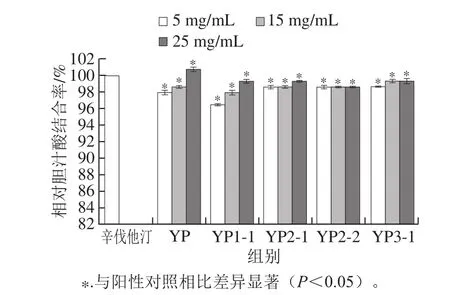
图6 野阳合多糖对胆汁酸的结合能力Fig.6 Bile acid-binding abilities of crude and purif i ed polysaccharides from Habenaria ciliolaris Kranzl
多糖能降低胆固醇,对胆汁酸的结合是多糖降低胆固醇的机理之一[27]。多糖通过结合胆汁酸,防止其重吸收,并刺激血浆、肝脏中的胆固醇转化为胆汁酸,达到消耗更多胆固醇的目的。阳性对照辛伐他汀是一种有效的降胆固醇药物,能有效增加胆汁酸分泌、降低胆固醇吸收[28]。野阳合粗多糖及4 种纯化多糖组分YP1-1、YP2-1、YP2-2和YP3-1对胆汁酸的结合能力如图6所示。辛伐他汀(5 mg/mL)能结合大量的胆汁酸,定义其结合率为100%。野阳合粗多糖(YP)及YP1-1、YP2-1、YP2-2和YP3-1(5、15 mg/mL和25 mg/mL)对胆汁酸的结合率均高于97%。其中,25 mg/mL野阳合粗多糖对胆汁酸的结合率高达100.7%,有强胆汁酸结合能力。同时,研究发现低浓度和高浓度野阳合多糖对胆汁酸的结合能力无显著性差异(P>0.05),该结果与Hu Jielun等[29]的报道一致。有报道发现多糖对胆汁酸有结合能力的一部分原因是多糖有高黏度,能通过水动力学限制作用绑定胆汁酸[30]。此外,这种结合与多糖的阴、阳离子及其物理化学结构有关[31]。野阳合多糖分子质量在1.93×106~3.52×106Da范围内,分子质量大,具有膳食纤维属性[32],能通过结合胆汁酸,增加胆汁酸的粪便排出量,抑制肠壁对胆汁酸的重吸收,刺激血浆和肝脏中胆固醇的转化[33]。
3 结 论
利用水提醇沉法提取野阳合粗多糖,提取率为2.41%,其总糖质量分数为96.35%,紫外光谱检测结果显示其不含蛋白质和核酸。经DEAE-纤维素52柱和TOYOPEARL HW-65柱分离纯化得到4 种多糖组分,分别为YP1-1、YP2-1、YP2-2和YP3-1。采用高效液相色谱与蒸发光散射检测器联用,测定4 个纯化组分的分子质量,分别为3.52×106、3.08×106、1.93×106Da和3.35×106Da。红外光谱分析结果表明各野阳合多糖主要为吡喃型糖苷环骨架,糖苷键以β-构型为主。PMP柱前衍生化高效液相色谱分析表明,各野阳合多糖纯化组分的单糖组成均以半乳糖、葡萄糖和鼠李糖为主。水提醇沉法适用于植物多糖的初步探究,但利用水提醇沉法提取野阳合多糖,提取率仅为2.41%。后续可根据野阳合多糖的结构和性质,选用酸碱提取法、生物酶解提取法、超声提取法、微波提取法等,提高野阳合多糖的提取率。
对胆汁酸结合能力的实验结果表明,各野阳合多糖对胆汁酸均有较强的结合能力,结合率均高于97%。其结合胆汁酸的具体作用机制,后续可从野阳合多糖的流变学特性及阴、阳离子组成等方面进行探究。以上实验结果为进一步深入探究野阳合多糖的结构和生物活性提供了参考,也为提升野阳合的产业价值,提供了新的思路。
[1] 刘育辰, 邱德文. 苗药双肾草研究概况[J]. 人参研究, 2008, 20(2):16-20. DOI:10.3969/j.issn.1671-1521.2008.02.004.
[2] 中国科学院植物研究所. 中国高等植物图鉴(1-5册, 补编1-2册)[M].北京: 科学出版社, 2002: 163-167.
[3] 郭书旺. 湘西五月洋合无公害栽培技术[J]. 蔬菜, 2014(6): 64-65.DOI:10.3969/j.issn.1001-8336.2014.06.036.
[4] 梁称福, 陈正法, 范适, 等. 大围山区野生蔬菜资源及其开发利用[J]. 资源开发与市场, 2005, 21(5): 460-461. DOI:10.3969/j.issn.1005-8141.2005.05.026.
[5] 王希辉. 土家族饮食文化变迁的历史考察[J]. 西南民族大学学报(人文社科版), 2013, 34(3): 31-36.
[6] 张淑杰, 康玉凡. 天然活性多糖研究进展[J]. 食品工业科技, 2017,38(2): 379-382; 389. DOI:10.13386/j.issn1002-0306.2017.02.065.
[7] 邹胜, 徐溢, 张庆. 天然植物多糖分离纯化技术研究现状和进展[J].天然产物研究与开发, 2015, 27(8): 1501-1509. DOI:10.16333/j.1001-6880.2015.08.031.
[8] 赖富饶, 温其标, 李琳, 等. 豆皮多糖与豆渣多糖的物化性质和功能特性[J]. 华南理工大学学报(自然科学版), 2010, 38(4): 50-54; 60.DOI:10.3939/j.issn.1000-565X.2010.04.010.
[9] HUANG D M, LI Y, CUI F, et al. Purification and characterization of a novel polysaccharide-peptide complex from Clinacanthus nutans Lindau leaves[J]. Carbohydrate Polymers, 2016, 137: 701-708.DOI:10.1016/j.carbpol.2015.10.102.
[10] 陈桂冰. 茶籽多糖提取及其与DNA相互作用研究[D]. 无锡: 江南大学, 2016.
[11] ZENG W C, ZHANG Z, JIA L R. Antioxidant activity and characterization of antioxidant polysaccharides from pine needle(Cedrus deodara)[J]. Carbohydrate Polymers, 2014, 108: 58-64.DOI:10.1016/j.carbpol.2014.03.022.
[12] SUI Y, ZHENG Y, LI X, et al. Characterization and preparation of oligomeric procyanidins from Litchi chinensis pericarp[J]. Fitoterapia,2016, 112: 168-174. DOI:10.1016/j.f i tote.2016.06.001.
[13] DU X, ZHANG Y, MU H, et al. Structural elucidation and antioxidant activity of a novel polysaccharide (TAPB1) from Tremella aurantialba[J]. Food Hydrocolloids, 2015, 43: 459-464. DOI:10.1016/j.foodhyd.2014.07.004.
[14] 张琪琳. 香菇多糖的结构鉴定及抗肿瘤作用机制研究[D]. 武汉: 华中科技大学, 2015.
[15] 胡坪, 乔晚芳, 王楠, 等. 麦冬多糖相对分子质量测定方法的研究[J]. 中成药, 2013, 35(12): 2684-2689. DOI:10.3969/j.issn.1001.1528.2013.12.028.
[16] 王慧力. 茶树花多糖提取条件的优化、纯化及其结构鉴定[D].南京: 南京农业大学, 2014.
[17] CHEN Z, ZHANG W, TANG X, et al. Extraction and characterization of polysaccharides from Semen Cassiae by microwave-assisted aqueous two-phase extraction coupled with spectroscopy and HPLC[J]. Carbohydrate Polymers, 2016, 144: 263-270. DOI:10.1016/j.carbpol.2016.02.063.
[18] ZENG H L, MIAO S, ZHANG Y, et al. Isolation, preliminary structural characterization and hypolipidemic effect of polysaccharide fractions from Fortunella margarita, (Lour.) Swingle[J]. Food Hydrocolloids,2016, 52: 126-136. DOI:10.1016/j.foodhyd.2015.05.028.
[19] 张耀雷, 黄立新, 张彩虹, 等. 壶瓶枣多糖的纯化及结构初步分析[J].食品科学, 2016, 37(3): 33-37. DOI:10.7506/spkx1002-6630-201603007.
[20] 高航, 高延芬, 徐虹. 莲子红衣多糖的分离纯化及结构表征[J]. 食品科学, 2016, 37(15): 94-99. DOI:10.7506/spkx1002-6630-201615016.
[21] 刘小如, 张丽美, 胡蒋宁, 等. 油茶粕多糖的分级纯化及结构研究[J].食品科学, 2013, 34(23): 96-102. DOI:10.7506/spkx1002-6630-201323021.
[22] 王芳. 香乳菇多糖(LC-1)的分离纯化结构鉴定以及生物活性的研究[D].南充: 西华师范大学, 2015.
[23] WANG C Z, ZHANG H Y, LI W J, et al. Chemical constituents and structural characterization of polysaccharides from four typical bamboo species leaves[J]. Molecules, 2015, 20(3): 4162-4179.DOI:10.3390/molecules20034162.
[24] 张锦雀. 金线莲多糖的分离纯化、结构表征及其抗肿瘤活性[D].福州: 福建医科大学, 2010.
[25] 陈栋才. 铁皮石斛多糖的提取、分离纯化、结构及生物活性研究[D].福州: 福建师范大学, 2015.
[26] 王维. 白及碱提多糖理化性质及相关药理作用的探究[D]. 西安: 陕西师范大学, 2015.
[27] 曾红亮. 金柑多糖结构表征及降血脂机理的研究[D]. 福州: 福建农林大学, 2015.
[28] 乔晓溪, 王立, 梁爽, 等. 辛伐他汀新剂型的研究进展[J]. 黑龙江科技信息, 2016, 31(1): 37. DOI:10.3969/j.issn.1673-1328.2016.31.033.
[29] HU J L, NIE S P, LI C, et al. In vitro effects of a novel polysaccharide from the seeds of Plantago asiatica L. on intestinal function[J].International Journal of Biological Macromolecules, 2013, 54(2): 264-269. DOI:10.1016/j.ijbiomac.2012.12.011.
[30] 胡婕伦. 大粒车前子多糖体内外消化与酵解特征体系构建及其促进肠道健康的作用[D]. 南昌: 南昌大学, 2014.
[31] KAHLON T S, WOODRUFF C L. In vitro binding of bile acids by soy protein, pinto beans, black beans and wheat gluten[J]. Food Chemistry,2002, 79(4): 425-429. DOI:10.1016/S0308-8146(02)00192-9.
[32] 田月月. 水溶性大豆多糖体外结合重金属和胆汁酸盐的研究[D].无锡: 江南大学, 2016.
[33] 陈挚, 雷亚亚, 黑晶, 等. 胡芦巴多糖及低聚糖调血脂活性研究[J]. 中草药, 2015, 46(8): 1184-1189. DOI:10.7501/j.issn.0253-2670.2015.08.016.
