链脲佐菌素诱导糖尿病大鼠模型肠道菌群变化
2018-06-26朱华郭亚茜杜晓鹏赵文杰李彦红秦川
朱华,郭亚茜,杜晓鹏,赵文杰,李彦红,秦川
(卫生部人类疾病比较医学重点实验室,中国医学科学院医学实验动物研究所) 北京协和医学院比较医学中心,北京 100021)
糖尿病是血糖自平衡失调导致的慢性代谢性综合征,主要表现为高血糖及一系列相关症状。据世界卫生组织报告,2014年全球糖尿病患病人数为 4.22亿[1]。据国际糖尿病联合会2017年发布的资料,我国现有糖尿病患者1.14亿人,超过印度,成为世界上糖尿病患者人数最多的国家[2]。糖尿病是环境菌群、宿主遗传与免疫应激等复杂因素相互作用的结果。肠道菌群作为一种环境因素,参与宿主体内糖脂代谢、氨基酸转运等多种生理生化进程,显著地影响着宿主的健康状态。随着高通量测序和生物信息学分析技术的不断进步,人们对肠道菌群与糖尿病间关系的认识也越来越深入。实验动物作为医学科学研究必不可少的工具,其正常及疾病模型状态下肠道微生物的结构、组成、丰度等数据是生物学背景资料的重要组成部分。本研究通过腹腔注射链脲佐菌素(STZ)方法复制糖尿病大鼠模型,采用16S rDNA高通量测序技术分析建模12周内动物肠道菌群结构和丰度的变化,为糖尿病与肠道菌群关系研究提供参考。
1 材料与方法
1.1 材料
SPF级雄性SD大鼠25只,由军事医学科学院实验动物中心提供【SCXK-(军)2012-0012】,4~6周龄,体重150~170 g。动物饲养在中国医学科学院实验动物研究所SPF隔离设施内【SYXK(京)2013-0014】。动物实验通过伦理委员会的审查,批准号:ZH16002。
1.2 方法
1.2.1模型建立
大鼠按体重随机分为对照组(C)10只、模型组(M)15只。动物禁食12 h后,腹腔注射STZ(Sigma 公司,货号S0130)30 mg/ kg,连续注射5 d。STZ溶于0.1 mol/L pH 4.2 柠檬酸缓冲液中,现配现用。对照组动物注射等体积的柠檬酸缓冲液。最后一次注射3 d后取尾静脉监测血糖,空腹血糖 ≥16.5 mmol/L 视为糖尿病模型成立。
1.2.2粪便采集
模型成立后4周和12周,分别在同一时间取各组大鼠新鲜直肠粪便(≥200 mg),迅速装入无菌冻存管中放入-80℃冰箱。
1.2.3基因组DNA提取和PCR扩增
CTAB 法提取粪便基因组 DNA,1%琼脂糖凝胶电泳检测DNA是否有降解;NanoPhotometer分光光度计检测样品纯度;Qubit2.0 Flurometer检测DNA样品浓度。以稀释后的基因组 DNA 为模板,使用带 Barcode 的特异引物,New England Biolabs 公司的 Phusion® High-Fidelity PCR Master Mix with GC Buffer和高效高保真酶进行PCR。
16S V3+4 区引物(515F 和 806R)鉴定细菌多样性。引物序列为F: 5’-CCTAYGGGRBGCASCAG-3’;R: 5’-GGACTACNNGGGTATCTAAT-3。等量混样不同浓度PCR产物,使用2%的琼脂糖凝胶电泳检测PCR产物,使用Qiagen公司胶回收试剂盒回收产物。
1.2.4文库构建、测序及生物信息学分析
使用TruSeq® DNA PCR-Free Sample Preparation Kit建库试剂盒进行文库构建,构建好的文库经过Qubit和Q-PCR定量,检测合格的文库使用HiSeq进行测序,测序策略为PE250。对测序得到的有效数据进行分类单元(operational taxonomic units,OTUs)聚类和物种分类分析。对OTUs进行丰度、α-多样性指数分析。
1.3 统计学方法
实验结果采用SPSS19.0软件进行差异显著性分析,P< 0.05为差异有统计学意义。
2 结果
2.1 动物体重和血糖的变化
注射前对照组、模型组大鼠平均体重差异无显著性。腹腔注射STZ后,对照组动物体重稳定增长,模型组体重增加不明显。4周时模型组大鼠存活12只,其体重显著低于对照组(P< 0.05)。12周时模型组动物存活10只且体重减轻,与对照组比较差异极显著(P<0.01)。注射前对照组与模型组动物的血糖值差异无显著性,造模4周、12周后模型组大鼠血糖升高,与对照组比较差异有显著性(P< 0.01)(表1)。
2.2 肠道菌群高通量测序结果
2.2.1粪便样品测序结果评估
对照组和模型组动物2个时间点20个样本共得到2 065 796条原始下机reads。比较两组原始下机reads数、过滤后得到的高质量Reads数、过滤后得到的高质量序列占Raw Reads比例、含N比例大于5%的Reads占Raw Reads比例、Clean Reads中测序质量值大于30(错误率小于0.1%)的碱基占总碱基(clean reads)比例,对照组、模型组在两个时间点差异均无显著性(表2)。

表1 注射链脲菌素后动物体重和血糖的变化Tab.1 Changes of body weight and blood glucose in the rats after STZ
注:与对照组比较,*P< 0.05,**P< 0.01。
Note. Compared with the control group,*P< 0.05,**P< 0.01.

表2 数据过滤统计分析表Tab.2 Analysis of the filtered reads of the

组别Groups含N比例大于5%Reads占Raw Reads比例Ratio of reads containingN > 5%(%)接头污染Reads数占Raw Reads比例Adapter Polluted Reads ratio(%)测序错误率小于0.1%碱基占总碱基比例Clean Q30 Bases ratio (%)造模4 周4 weeks after injection造模12周12 weeks afterinjection造模4 周4 weeks after injection造模12周12 weeks afterinjection造模4 周4 weeks after injection造模12周12 weeks afterinjection对照组Control group0.000.000.000.0093.82±0.2289.75±0.33模型组DM group0.000.000.000.0094.14±0.4089.62±0.37P值----0.54320.7689
2.2.2肠道菌群多样性分析
根据OTUs代表序列与数据库注释文件对比,在 97%(种)水平上进行OTUs 划分,模型组在两个时间点所获得的OTUs数减少,与对照组比较差异有显著性(P< 0.05)。Chao1指数数值越大表示菌群丰度越高,模型组Chao1指数在两个时间点的数值均降低,与对照组比较差异有显著性(P< 0.05)。Shannon指数越大、Simpson指数越小表示肠道菌群的多样性越强,模型组的Shannon指数数值在两个时间点均降低,Simpson指数数值在两个时间点均升高,与对照组比较差异有显著性(P< 0.05)(表3)。
2.2.3肠道菌群在门水平上的构成
测序结果显示:对照组reads在两个时间点主要分属以下8个门,由多到少依次为:厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、变形菌门(Proteobacteria)、蓝藻菌门(Cyanobacteria)、软壁菌门(Tenericutes)、疣微菌门(Verrucomicrobia)、TM7、放线菌门(Actinobacter)。迷踪菌门(Elusimicrobia)、绿弯杆菌门(Chloroflexi)仅在个别动物体内检出。
造模4周时,模型组厚壁菌门、拟杆菌门丰度与对照组比较差异无显著性。厚壁菌门与拟杆菌门比值呈下降趋势,与对照组比较差异无显著性。变形菌门、蓝藻菌门、软壁菌门、TM7、放线菌门的相对丰度降低,与对照组比较差异有显著性(P< 0.05)。疣微菌门仅在个别动物检出。造模12周时,模型组厚壁菌门、拟杆菌门的相对丰度及比值与对照组比较差异无显著性。变形菌门、蓝藻菌门、软壁菌门、TM7的相对丰度降低,与对照组比较差异有显著性(P< 0.05)。放线菌门在个别动物检出。疣微菌门、迷踪菌门、绿弯杆菌门未检出(表4)。

表3 模型组和对照组动物肠道菌群多样性比较Tab.3 Comparison of the α-diversity indexes of gut microbiota between the control and diabetes
注:与对照组比较,*P< 0.05,**P< 0.01。(下表同)
Note. Compared with the control group,*P< 0.05,**P< 0.01.(The same in the following tables)

表4 肠道菌群在门水平上的构成Tab.4 Relative abundance of the bacteria in gut microbiota at phylum level in the control and diabetes

组别Groups蓝藻菌门Cyanobacteria 软壁菌门Tenericutes 疣微菌门Verrucomicrobia TM7造模4 周4 weeks after injection造模12周12 weeks afterinjection造模4 周4 weeks after injection造模12周12 weeks afterinjection造模4 周4 weeks after injection造模12周12 weeks afterinjection造模4 周4 weeks after injection造模12周12 weeks afterinjection对照组Control group1.20±0.450.27±0.110.27±0.021.47±0.950.19±0.010.20±0.080.06±0.010.05±0.01模型组DM group0.40±0.050.07±0.010.16±0.021.06±0.17个别检出-0.02±0.000.02±0.00P值0.0324*0.0013**0.0452*0.0325*0.0317*0.0413*

组别Groups放线菌门Actinobacter 迷踪菌门Elusimicrobia 绿弯杆菌门Chloroflexi 造模4 周4 weeks after injection造模12周12 weeks afterinjection造模4 周4 weeks after injection造模12周12 weeks afterinjection造模4 周4 weeks after injection造模12周12 weeks afterinjection对照组Control group1.54±0.111.29±0.06个别检出个别检出个别检出个别检出模型组DM group1.02±1.29个别检出个别检出---P值0.0112*
2.2.4肠道菌群在门以下水平的构成
在科水平,对10个相对丰度较高的菌株进行分析,造模4周时,模型组拟杆菌科(Bacteroidaceae)相对丰度增高,与对照组比较差异有显著性(P< 0.05)。造模12周,模型组S24-7、乳酸杆菌科(Lactobacillaceae)、梭杆菌科(Clostridiaceae)、拟杆菌科(Bacteroidaceae)相对丰度增高,与对照组比较差异有显著性(P< 0.05)。(表5,图1)
在属水平,对10个相对丰度较高的菌株进行分析,造模4周时,模型组乳杆菌属(Lactobacillus)相对丰度降低、拟杆菌属的(Bacteroides)相对丰度增高,与对照组比较差异有显著性(P<0.05)。造模12周,模型组乳杆菌属(Lactobacillus)、瘤胃球菌属(Ruminococcus)、拟杆菌属(Bacteroides)相对丰度增高,双歧杆菌属(Bifidobacterium)相对丰度降低,与对照组比较差异有显著性(P<0.05)。(表6,图2)

表5 肠道菌群在科水平上的构成Tab.5 Relative abundance of the bacteria in gut microbiota at family level in the control and diabetes

组别GroupsS24-7毛螺菌科LachnospiraceaeTuricibacteraceae造模4 周4 weeks after injection造模12周12 weeks afterinjection造模4 周4 weeks after injection造模12周12 weeks afterinjection造模4 周4 weeks after injection造模12周12 weeks afterinjection对照组Control group22.03±7.4423.65±8.556.62±2.257.12±1.345.26±2.054.98±1.22模型组DM group18.96±6.0227.06±9.545.91±2.476.37±2.115.02±1.234.13±1.34P值0.16650.0242*0.57800.44530.34380.5527
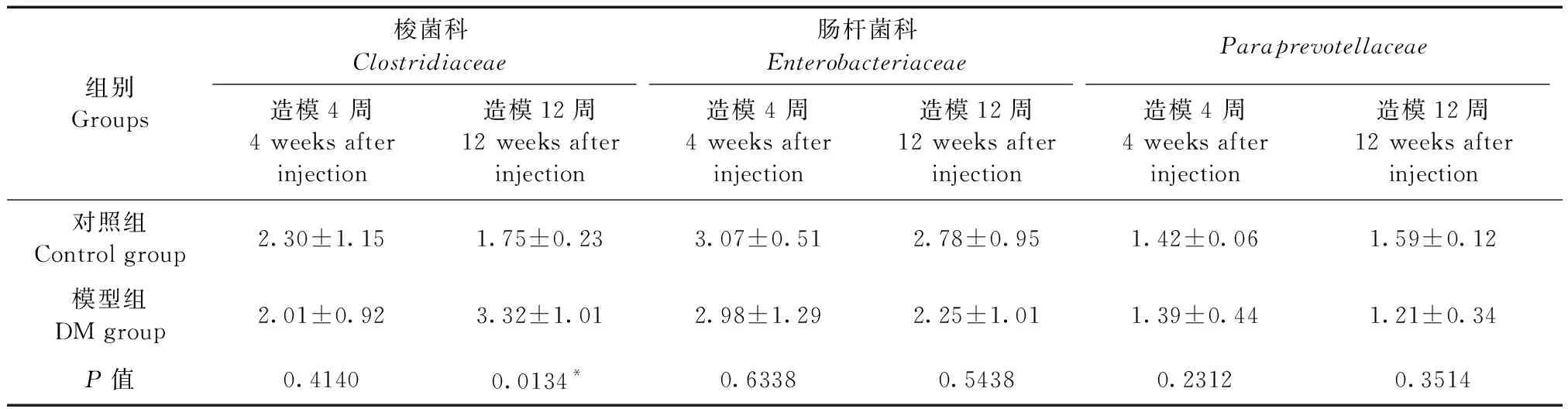
组别Groups梭菌科Clostridiaceae肠杆菌科EnterobacteriaceaeParaprevotellaceae造模4 周4 weeks after injection造模12周12 weeks afterinjection造模4 周4 weeks after injection造模12周12 weeks afterinjection造模4 周4 weeks after injection造模12周12 weeks afterinjection对照组Control group2.30±1.151.75±0.233.07±0.512.78±0.951.42±0.061.59±0.12模型组DM group2.01±0.923.32±1.012.98±1.292.25±1.011.39±0.441.21±0.34P值0.41400.0134*0.63380.54380.23120.3514

表6 肠道菌群在属水平上的构成Tab.6 Relative abundance of the bacteria in gut microbiota at genus level in the control and diabetes

组别Groups瘤胃球菌属RuminococcusBlautia颤螺菌属 Oscillospira造模4 周4 weeks after injection造模12周12 weeks afterinjection造模4 周4 weeks after injection造模12周12 weeks afterinjection造模4 周4 weeks after injection造模12周12 weeks afterinjection对照组Control group2.17±0.321.28±0.4416.62±2.2519.78±1.7315.26±1.0518.98±4.21模型组DM group1.98±0.443.09±0.9214.71±2.4715.94±1.8713.96±2.0017.01±3.98P值0.37390.0163*0.26080.35790.11580.3046

组别GroupsSMB53罗氏菌属 Roseburia克雷伯菌属Klebsiella造模4 周4 weeks after injection造模12周12 weeks afterinjection造模4 周4 weeks after injection造模12周12 weeks afterinjection造模4 周4 weeks after injection造模12周12 weeks afterinjection对照组Control group10.30±3.1511.51±3.238.07±1.5110.45±2.961.42±0.261.57±0.32模型组DM group9.41±2.2210.54±2.357.52±1.299.43±1.011.21±0.141.66±0.43P值0.28600.42030.37390.54320.50970.4498

注:A 造模后4周;B.造模后12周;图中C为对照组,M为模型组。图1 对照组和模型组动物肠道菌群在科水平的相对丰度Note. A.4 weeks after injection; B.12 weeks after injection; C. Control group, D. Diabetes group.Fig.1 Relative abundance of bacteria in the gut microbiota at phylum level in the control and diabetes groups

注:A.造模后4周;B.造模后12周;图中C为对照组,M为模型组。图2 对照组和模型组动物肠道菌群在属水平的相对丰度Note. A. 4 weeks after injection; B.12 weeks after injection; C. Control group; D. Diabetes group.Fig.2 Relative abundance of bacteria in the gut microbiota at genus level in the control and diabetes groups
3 讨论
大小鼠是目前国内外常用于肠道菌群与疾病相关性研究的实验动物。啮齿类有个体小,易于操作,生物背景资料清晰、价格便宜等优点。SPF级动物饲养在标准环境下,可排除饮食结构、饲养环境、年龄差别等因素对肠道菌群的影响。但啮齿类在解剖、生理和代谢等方面与人之间存在较大的差异,肠道菌群组成及丰度也不尽相同。充分了解实验动物及相关模型肠道菌群的基础数据,认识其与人菌群的差异和相似性,是利用动物模型进行肠道菌群与疾病相关性研究的前提。
从测序结果可以看出,STZ诱导糖尿病SD大鼠模型的肠道菌群结构及丰度均发生改变。
α-多样性分析中,对照组与模型组在Chao1、Shannon、Simpson这3个指数上差异均有显著性(P< 0.05),Chao1、Shannon指数升高,Simpson指数降低。提示STZ诱导的糖尿病SD大鼠模型肠道菌群多样性降低。相对丰度分析中,在门水平,对照组肠排在前5位的依次是厚壁菌门、拟杆菌门、变形菌门、蓝藻菌门、软壁菌门。其中厚壁菌门、拟杆菌门二者的总和占到了全部肠道菌的95%以上。模型组中厚壁菌门、拟杆菌门的比例略有下降,但与对照组比较无显著性差异。相对丰度较低的变形菌门、蓝藻菌门、软壁菌门、放线菌门在模型组均有降低,与对照组比较差异有显著性(P< 0.05)。但变形菌门、蓝藻菌门、软壁菌门在对照组随动物年龄增长也出现相对丰度的降低,其丰度改变是与年龄相关还是与疾病相关需进一步研究。在属水平,模型组和对照组的乳杆菌属、拟杆菌属、瘤胃球菌属、双歧杆菌属相对丰度差异有显著性(P< 0.05)。
据文献报道,中国人糖尿病及前期状态患者的肠道菌群中优势菌群为厚壁菌门、拟杆菌门、变形菌门、梭形杆菌门、放线菌门,在门水平的优势菌群与SD大鼠类似,但相对丰度有差异[3-4]。在属水平,正常人群与糖尿病患者的差异菌属主要是拟杆菌属、普雷沃菌属、Ⅳ型梭菌属、乳杆菌属、韦荣球菌属、Blautia球菌-直肠真杆菌属、双歧杆菌属,差异菌的种类与丰度与SD大鼠差别较大。在SD大鼠和人的肠道菌群中,厚壁菌门和拟杆菌门都是优势菌群,但在相对丰度及构成比上存在差异。有文献报道厚壁菌门与拟杆菌门的比例不平衡与糖尿病、肥胖等相关,但研究结果不统一。有研究认为肥胖人群厚壁菌门占优势,厚壁菌门/拟杆菌门比值较高[5];也有研究认为糖尿病患者拟杆菌门占优势,而厚壁菌门/拟杆菌门比值较低[6]。提示作为优势菌群的厚壁菌门与拟杆菌门,除相对丰度外,也应重视其比值的变化。我们的研究中厚壁菌门/拟杆菌门比值模型组与对照组比较有降低趋势,但无统计学意义,推测可能与样本数量较少相关。
值得关注的是放线菌门和疣微菌门,放线菌门在对照组10周龄SD大鼠(造模4周)相对丰度较高(1.54±0.11),18周龄(造模12周)时略有下降(1.29±0.06)。而在模型组,造模4周时相对丰度为(1.02±1.29),造模12周时仅个别检出,放线菌门的相对丰度显著降低。放线菌门是革兰阳性厌氧菌,在肠道内的相对丰度不占优势,但其门内的双歧杆菌属是对人体健康产生重要作用的益生菌,在人体肠道内较为常见[7]。双歧杆菌可以刺激免疫应答、产生维生素和氨基酸、使肠道内环境酸化,抑制腐败菌和致病菌生长、保护肠粘膜屏障,减少内毒素进入血液,并具有抗炎症反应,减少结肠癌发生的作用[8,9]。在属水平的相对分析中造模12周时双歧杆菌的相对丰度降低(P< 0.05),与门水平的结果相对应,提示糖尿病的发病过程可能与起益生作用的菌群减少,毒性代谢产物堆积有关。疣微菌门在对照组均检出且两个年龄段的丰度相似,而模型组动物在造模4周时仅在个别动物检出,造模12周时未检出,提示疣微菌门可能与STZ诱导的糖尿病病程相关。
本研究基于肠道细菌的16SrDNA高通量测序技术,对STZ诱导的SD糖尿病大鼠模型肠道菌群的结构和丰度进行了初步分析,并讨论了模型动物与人有关菌群的差异和相似性,为肠道疾病与微生态方面的医学研究提供了基础资料。
