Sabin IPV疫苗在版纳小耳猪体内的免疫原性及安全性研究
2018-06-26寸怡娜蔡玮宋绍辉周健欧阳圣洁胡文著李卫东廖国阳马磊
寸怡娜,蔡玮,宋绍辉,周健,欧阳圣洁,胡文著,李卫东,廖国阳,马磊
(中国医学科学院 北京协和医学院 医学生物学研究所,昆明 650118)
脊髓灰质炎(以下简称“脊灰”)是由脊髓灰质炎病毒I、II、III型引起的传播广泛且危害极大的急性传染病[1]。接种脊灰疫苗是控制与消灭脊灰最重要且有效的手段,国内外应用的脊灰疫苗有两种:口服脊灰减毒活疫苗(oral poliovirus vaccine,OPV)和脊灰灭活疫苗(inactivated poliovirus vaccine,IPV)。目前,全球合作消灭脊灰取得了重要进展,野毒株(WPV)仅在巴基斯坦、阿富汗两个国家流行。全球消灭脊灰后,由于口服OPV可引起疫苗相关病例(vaccine-associated paralytic poliomyelitis, VAPP)和疫苗衍生株病毒(vaccine-derived poliovirus, VDPV),将被停止使用,在消灭脊灰的最后阶段,只有使用IPV代替OPV才能最终根除脊髓灰质炎[2-3]。
减毒株(Sabin株)生产的IPV(sIPV),因其生物安全性高,适合在全球尤其第三世界国家推广使用[4-7]。2015年1月,中国医学科学院医学生物学研究所研制的sIPV三价疫苗获准上市,该疫苗对于保障中国及全球实现消灭脊灰的目标具有重要的战略意义。动物体内效力试验,是疫苗有效性的重要质量控制指标[8]。传统的IPV疫苗的肌肉注射途径效力评价是采用Wistar大鼠作为实验动物模型,而云南本地的版纳小耳猪属华南型猪种,体型小发育慢,6月龄体高40 cm左右,体长在60~75 cm,体重20~30 kg,体重相当同龄大型猪的1/4~1/5,平均日增重120~150 g,其皮肤厚度和结构与人类更接近[9]。本研究采用版纳小耳猪新动物模型进行sIPV疫苗免疫安全性和有效性的评价,为今后新型实验动物版纳小耳猪在脊灰疫苗评价中的应用积累科学数据。
1 材料与方法
1.1 材料
1.1.1实验动物
版纳小耳猪,等级:普通级,25只,雌13只,雄12只,3~4月龄,体重6~10 kg,由西双版纳小型猪饲养基地提供,由中国医学科学院医学生物学研究所小动物实验中心饲养【SYXK(滇)K2013-0008】。
1.1.2实验疫苗及参考品
sIPV疫苗由中国医学科学院医学生物学研究所制备,每瓶0.5 mL,抗原含量为I、II、III型30、32、45 DU。2~8℃保存,严禁冻结。wIPV疫苗由赛诺菲巴斯德制备,每瓶0.5 mL,抗原含量为I、II、III型40、8、32 DU。2~8℃保存,严禁冻结。
D抗原检测多克隆抗体(牛抗、兔抗):捕获抗体(一抗),各型经纯化获得的牛抗Sabin-Polio IgG;检测抗体(二抗),各型经纯化获得的兔抗Sabin-Polio IgG均由本所提供。
1.2 方法
1.2.1动物分组及免疫
版纳小耳猪25只,其中sIPV实验组和wIPV对照组各10只, 生理盐水阴性对照组5只。肌肉注射每只版纳小耳猪0.5 mL。间隔1个月,共进行3次免疫。每次免疫前尾静脉采血2~3 mL,分离血清,置-60℃保存。
1.2.2血清脊灰中和抗体检测
采用微量中和实验法[10]。能够保护50%细胞不受100 CCID50攻击病毒液感染的血清最高稀释度就是该血清的抗体滴度。中和抗体滴度< 1∶8记为阴性“—”。
阳转率的判定方法为:免前抗体滴度< 1∶8,免后≥1∶8判为阳转。
1.2.3安全性评价
安全性观察实验 在疫苗免疫后连续7 d观察接种部位是否引起红斑或水肿等局部反应。动物分组前、给药后1周内每天进行称重,比较与对照组的差异。
1.3 统计学方法
用Office Excel 和SPSS 21. 0统计软件进行统计学分析,组间比较采用χ2检验和方差分析,以P< 0.05 为差异有统计学意义。
2 结果
2.1 免疫原性结果
2.1.1血清学中和抗体阳转率结果
I型脊灰病毒中和抗体阳转率:第1剂免疫后,sIPV组阳转率达到80%,wIPV组的阳转率为60%,两组间差异无显著性(P=0.626)。第2剂免疫后,sIPV组达到了100%,wIPV组的阳转率为90%,组间差异无显著性(P=1.000)。第3剂免疫后,两组阳转率均达到了100%。II型脊灰病毒中和抗体阳转率:第1剂免疫后,sIPV组阳转率为80%,与wIPV组一致。第2剂免疫后,sIPV组阳转率为90%,wIPV组阳转率也为90%。第3剂免疫后,两组均达到了100%。III型脊灰病毒中和抗体阳转率:第1剂免疫后,sIPV组阳转率为40%,wIPV组为30%,组间差异无显著性(P=1.000)。第2剂免疫后,sIPV组和wIPV组阳转率均为80%。第3剂免疫后,两组均达到了100%。详细结果见表1。
2.1.2血清学中和抗体几何平均滴度(GMT)结果
I、II、III型脊灰病毒中和抗体GMT,除I型病毒第2剂免疫后30 d和第3剂免疫后30天sIPV组GMT显著高于wIPV组外,其余均差异无显著性,3剂免疫后实验组和对照组GMT均远高于1∶8,结果详见表2。
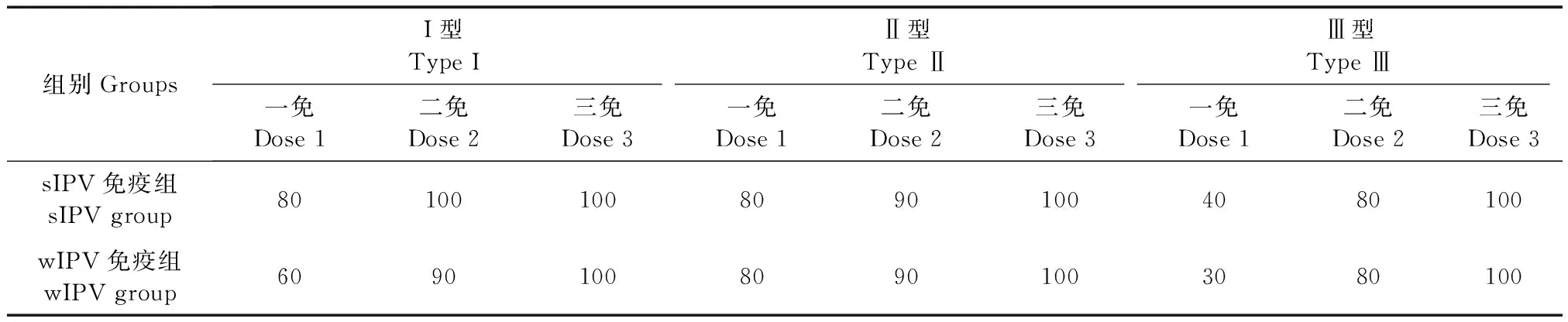
表1 免疫接种30 d后版纳小耳猪后抗脊灰病毒I、II、III型中和抗体阳转率(n=10,%)Tab.1 Seroconversion rate of the anti-polio type I, II and III antibodies after each dose immunization in the mini pigs (n=10,%)
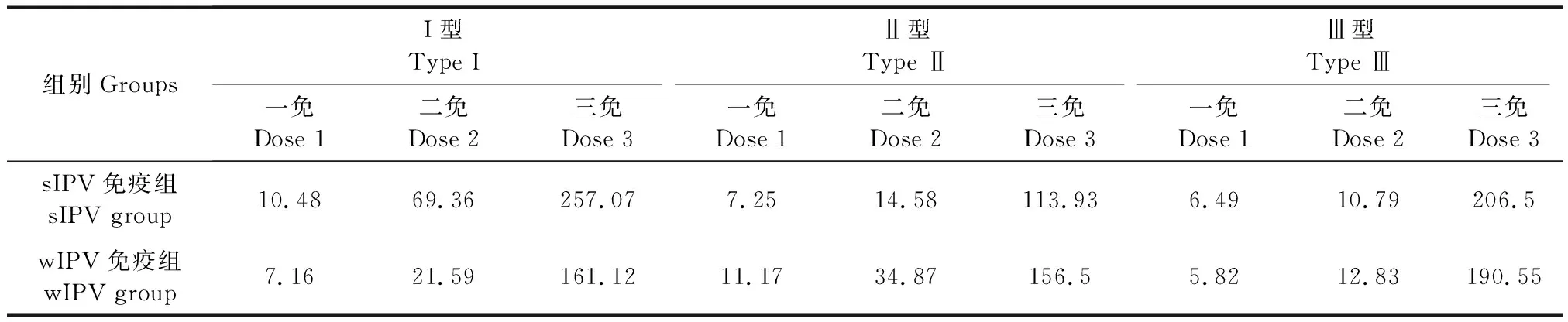
表2 免疫接种30 d后版纳小耳猪后抗脊灰病毒I、II、III型中和抗体GMT(n=10,1∶x)Tab.2 Geometric mean titers (GMT) of the anti-polio type I, II and III antibodies after each dose immunization in the mini pigs (n=10,1∶x)
2.2 免疫后安全性观察
每针免疫后对各组小耳猪进行持续观察,发现版纳小耳猪毛色光滑,食欲、精神状况和活动情况均正常,未出现体重下降、掉毛等现象。免疫后7 d 每天进行观察及称重,发现每组小耳猪体重稳定的增长,并且各实验组与对照组间体重差异无显著性(见图1)。肌肉注射观察腿部肌肉注射局部,也未见红肿、硬结等现象。
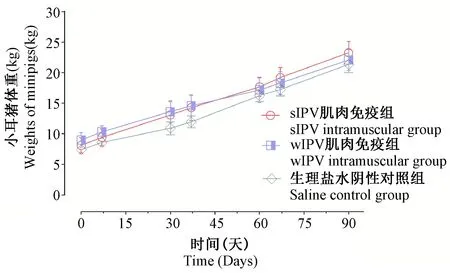
图1 版纳小耳猪免后体重变化结果Fig.1 Body weight changes of the pigs after immunization
3 讨论
早在20世纪80年代医学生物学研究所就开始研制sIPV,并确立了采用Vero 细胞微载体大规模培养技术生产sIPV的生产工艺[11],Ⅲ期临床试验结果表明,sIPV具有良好的安全性和免疫原性,肌肉注射剂型的sIPV已经于2015年6月成功获批上市[12]。传统的IPV疫苗的肌肉注射途径效力评价是用Wistar大鼠作为实验动物模型,本研究选用云南本地的版纳小耳猪作为评价IPV安全性及有效性的新的动物模型,通过对比猪与人的皮肤厚度及结构的研究认为猪的皮肤构造和人的较为相似,并且猪在解剖、代谢等遗传特征上与人相似[13-14],因此本研究的目的在于评价IPV疫苗在版纳小耳猪体内的免疫原性及安全性,为新型动物模型提供实验依据。
从版纳小耳猪的3剂基础免疫免疫原性结果来看,第1剂免疫完成后,sIPV组和wIPV组阳转率各型别组间差异无显著性,且两组均显著性的高于生理盐水对照组,GMT水平较低,仅sIPV组Ⅰ型和wIPV组Ⅱ型GMT水平高于1∶8。第2剂免疫后,sIPV组和wIPV组各型别阳转率均达到80%以上,且组间差异无显著性,GMT水平增长显著,各型别滴度均高于1∶8。第3剂免疫后,sIPV组和wIPV组阳转率各型别均达到了100%,I、II、III三个型别,sIPV组GMT水平分别为:257.07、113.93、206.50,wIPV组GMT水平分别为:161.12、156.50、190.55,GMT水平均远高于1∶8。结果表明,3剂基础免疫后,sIPV和wIPV疫苗免疫版纳小耳猪能够产生较好的免疫保护水平和较高的GMT水平。
安全性是评价新型动物模型的重要方面,在本研究中,我们从版纳小耳猪接种部位观察及体重观察评价了sIPV及wIPV疫苗的安全性,不管从版纳小耳猪的状态、体重还是注射部位情况观察,证明了sIPV及wIPV疫苗接种版纳小耳猪是安全的。
综上所述,IPV相关版纳小耳猪新型动物模型的研究国内外还未见报道。本研究通过评价sIPV及wIPV疫苗在版纳小耳猪体内的安全性及免疫原性,证明了版纳小耳猪能够作为评价IPV疫苗的新型实验动物模型。此新型动物模型对今后脊灰疫苗的研究及应用将具有非常重要的意义。
