新生儿急性胆红素脑病76例临床分析
2018-06-25肖丹夏
肖丹夏
胆红素脑病主要是由于游离胆红素透过血-脑脊液屏障对基底核及各种脑干神经核等的毒性作用导致中枢神经系统功能障碍,属于新生儿高胆红素血症的最严重并发症。2004年美国儿科学会推荐用“急性胆红素脑病”(Acute Bilirubin Encephalopathy,ABE)描述出生后1周内的新生儿由于胆红素毒性作用所致的急性脑损伤,表现为嗜睡、反应低下、肌张力减低、吸吮无力等,ABE病情进展可出现惊厥和角弓反张,甚至昏迷和中枢性呼吸衰竭,逐渐形成慢性胆红素脑病,遗留永久性临床后遗症,如手足徐动、听觉障碍、眼球运动障碍及牙釉质发育不良等[1]。近年来,慢性胆红素脑病的发生虽然大幅减少,但仍有发生,其中部分病例出生时为健康足月儿,其发生率近年有增加趋势[2-3]。2012年中华医学会儿科分会的一项多中心调查研究发现,33家医院共报告了348例新生儿胆红素脑病,约占同期收治病例4.8%[4]。本研究回顾性分析2015年1月—2016年12月广东省第二人民医院儿科收治的76例新生儿ABE病例资料,探讨其临床特点与预后的相关性,为ABE早期诊治与预后评估提供经验。
1 对象与方法
1.1 研究对象
病例纳入标准:①胎龄≥37周;②病史资料完整可靠。排除标准:遗传代谢性疾病、染色体病等造成的神经系统异常;③临床确诊为急性胆红素脑病(ABE)。共纳入76例ABE患儿,男42例,女34例,男女比例1.2 ∶1;平均胎龄(38.62±1.20)周;出生体质量(3 282±408)g。无症状组(临床无脑病症状,TSB>342 μmol/L,根据头颅MRI确诊)25例。有症状组51例,根据ABE评分表[5],分为轻、中、重度组,轻度组33例,评分1~3分,主要表现为活动减少、吃奶少、拒食,中度组14例,评分4~6分,主要表现为嗜睡、反应差、躯干扭转痉挛等,重度组4例,评分7~9分,表现为过度激惹、角弓反张、惊厥、昏迷、呼吸暂停等。无症状组、轻、中、重度ABE新生儿的胎龄、出生体质量差异无统计学意义(P>0.05)。具体见表1。
1.2 方法
收集76例患儿的出生胎龄、出生体质量、临床表现、血清总胆红素(TSB)、血清总胆红素和白蛋白比值(B/A值)、脑干听觉诱发电位(BAEP)、头颅磁共振(MRI)和不良转归等资料。
通过电话随访了解神经功能障碍情况,包括精神运动发育迟缓、癫痫、听觉障碍、脑性瘫痪等。
1.3 统计学分析
采用SPSS 22.0统计软件进行数据处理。计量资料以均数±标准差表示,组间比较采用方差分析;计数资料以百分比表示,组间比较采用卡方检验。以P<0.05为差异具有统计学意义。
2 结果
无症状组、轻、中、重度ABE组新生儿的TSB、B/A值差异有统计学意义(P<0.05)。
76例ABE患儿均行BAEP检查,其中无症状组异常率为0,轻度ABE组异常率48.5%,中度组异常率71.4%,重度组异常率100%,差异具有统计学意义(P<0.05)。
76例ABE患儿,均行头颅MRI检查,其中50例提示双侧苍白球对称性T1加权高信号,无症状组头颅MRI异常率100%。
无院内死亡病例,随访76例中,失访12例,死亡1例,发生神经功能障碍21例,其中,轻、中、重度ABE组病死及神经功能障碍发生率分别为18.2%、57.1%、75.0%,差异具有统计学意义(P<0.05)。
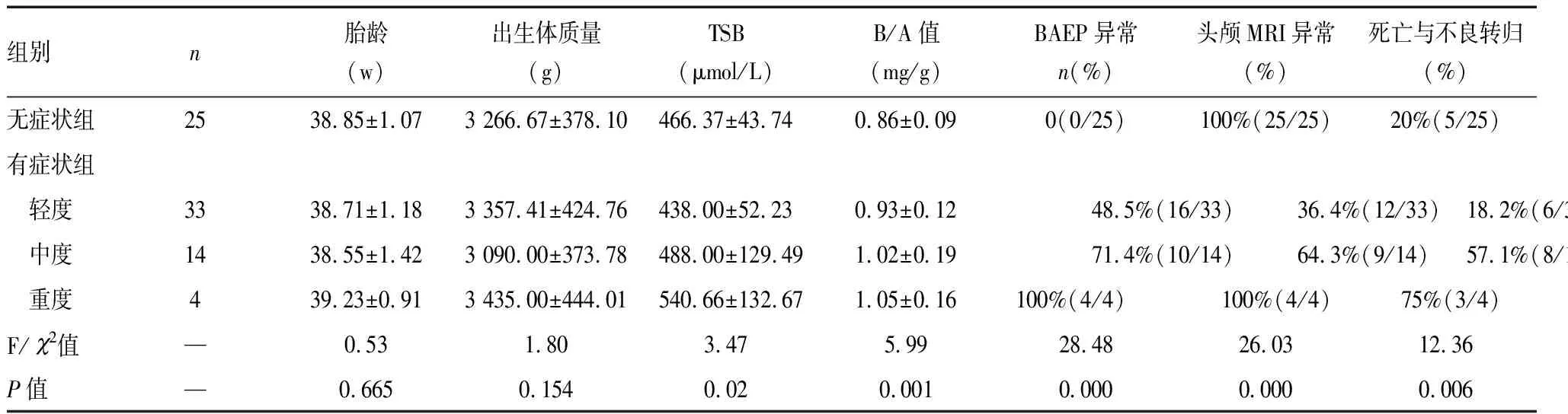
表1 ABE病儿临床资料对比
3 讨论
ABE早期症状大多非特异性,尤其无症状和轻度ABE早期诊断较困难,易漏诊。我科采用ABE评分表量化评估病理性黄疸新生儿的脑损伤情况,同时完善B/A值测定、BAEP、头颅MRI等辅助检查来综合评估ABE患儿预后,进行早期干预,尽可能降低不良转归发生率。
3.1 B/A值与ABE的关系
临床上通常以TSB浓度评估胆红素脑病的危险性,足月儿的TSB阈值多在342.2~427.5 μmol/L以上,但TSB浓度对新生儿ABE的诊断与评估,灵敏度以及特异性并不高[6]。本研究患儿入院时平均TSB为(466.53±87.24)μmol/L,但有3例患儿TSB<342 μmol/L,其中最低1例为279 μmol/L,提示TSB浓度高并不是胆红素脑病的唯一决定因素,与文献研究结果[7-8]一致。TSB与不良转归并非完全正相关,但是ABE程度越重,不良转归发生率越高。
关于胆红素神经毒性的研究显示:与TSB相比,游离胆红素水平能更好预测胆红素神经毒性,B/A值能更早期、更直接预测胆红素脑病[9]。游离胆红素与血清白蛋白结合后分子量增大,将不能透过血-脑脊液屏障,因此,白蛋白和胆红素的联结是影响胆红素毒性的重要因素。当B/A值小于1时,胆红素与白蛋白联结牢固,游离胆红素透过血脑屏障少,发生胆红素脑病的风险低,若B/A值大于1时,部分胆红素与白蛋白联结疏松,游离胆红素增加,如果B/A值大于2,甚至大于3时,两者的联结更加疏松,游离胆红素明显增加,发生胆红素脑病的风险明显升高[10]。本次研究结果显示:无症状组B/A值为0.86±0.09,轻度ABE组B/A值为0.93±0.12,中度组B/A值为1.02±0.19,重度组B/A值为1.05±0.16;这提示B/A值越高,胆红素脑病程度越重,B/A值高的病儿,不良转归发生率明显升高,因此,B/A值可作为临床胆红素脑病早期诊断与指导治疗的重要指标。
3.2 BAEP与ABE的关系
BAEP是在一定的声刺激下,发生时间均在10~15 ms内,反映听觉通路的一种电反应,属于短潜伏期诱发反应。BAEP所反映的神经通路包括了听神经到下丘的各个结构,由Ⅰ~Ⅶ波组成,新生儿一般分化发育较为清晰的是Ⅰ、Ⅲ、Ⅴ波。胆红素对神经系统的毒性作用以听力损害最为突出,早期可以通过检测BAEP来反映脑干听觉通路的损伤,特别是耳蜗核损伤,BAEP异常可提示存在胆红素神经毒性作用[11],主要表现为Ⅰ波、Ⅴ波缺失,Ⅰ波、Ⅴ波潜伏期延长,Ⅰ波和Ⅱ波的融合。可逆性BAEP变化通常在胆红素降低后逐渐恢复正常[12]。本研究结果显示:随ABE程度加重,BAEP异常率明显升高。因此,连续动态监测BAEP,可监测胆红素听神经损伤的演变。
3.3 头颅MRI与ABE的关系
由于新生儿时期,基底核神经细胞生理及生化代谢旺盛,耗氧量大,当游离胆红素异常增高或血-脑脊液屏障通透性增高时,游离胆红素沉积于基底核的神经核团,常见的受累核团为:基底节的苍白球和底丘核、黑质、耳蜗及面神经核等,神经元细胞首先凋亡,而星形胶质细胞表现为线粒体功能的改变[13-14]。头颅MRI T1加权像苍白球中后部的高强度信号是胆红素损害最具特征性的改变。本研究76例病儿均行头颅MRI检查,MRI结果提示双侧苍白球对称性T1加权高信号50例,其中5例3个月后复查头颅MRI提示T1加权高信号转变为T2加权高信号,这5例患儿均预后不良,与毛健[15]等及李豪刚等[16]研究一致,提示早期头颅MRI提示双侧苍白球对称性T1加权高信号的胆红素脑病患儿,应积极随访,动态监测预后;无症状组25例患儿无脑病临床症状,主要以严重高胆红素血症(TSB>342μmol/L)及头颅MRI发现双侧苍白球对称性T1加权高信号而诊断ABE,因此,头颅MRI异常率高(达100%)。不良预后发生率,无症状组患儿与轻度ABE组相近,但明显低于中、重度ABE组,说明以临床症状来诊断胆红素脑病并不敏感。因此,头颅MRI提示双侧苍白球对称性T1加权高信号,这对临床无ABE表现的亚临床胆红素脑损伤提供了影像学依据。
综上所述:胆红素脑病严重威胁婴幼儿健康,早期诊断缺乏统一的金标准,无法准确判断预后,临床一旦出现明显的神经系统症状和体征,患儿遗留明显后遗症的可能性极大。因此,应加强新生儿家长宣教,早期发现严重高胆红素血症或胆红素脑病症状,及时干预,密切随访,改善预后[17];而在NICU里需要呼吸支持的重症患儿往往不能早期进行BAEP及头颅MRI检查,因此近年发展起来的脑功能监测(aEEG)和特异性烯醇化酶(NSE)的监测显得尤其重要。本研究团队现正进一步加大样本量及开展多项监测指标的研究。
[1] AMERICAN ACADEMY OF PEDIATRICS. SUBCOMMITTEE ON HYPERBILIRUBINEMIA.Clinical practice guideline, management of hyperbilirubinemia in the newborn infant 35 or more weeks of gestation[J].Pediatrics,2004,114(1):297-316.
[2] MANNING D, TODD P, MAXWELL M, et al. Prospective surveilance study of severe hyperbilirubinaemia in the newborn in the UK and Ireland[J]. Arch Dis Child Fetal Neonatal Ed,2007,92(5):F342-346.
[3] MAISELS M J, NEWMAN T B. Kernicterus in otherwise healthy, breast-fed term newborns[J]. Pediatrics,1995,96(1):730-733.
[4] 中华医学会儿科学分会新生儿学组,中国新生儿胆红素脑病研究协作组.中国新生儿胆红素脑病的多中心流行病学调查研究[J].中华儿科杂志,2012,50(5):331-335.
[5] JOHNSON L, BHUTANI V K, KARP K, et al. Clinical report from the pilot USA Kernicterus Registry(1992 to 2004)[J]. J Perinatol,2009,29(Suppl 1): S25-S45.
[6] WU W, ZHANG P, WANG X, et al. Usefulness of 1H-MRS in differentiating bilirubin encephalopathy from severe hyperbilirubinemia in neonates[J]. J Magn Reson Imaging,2013,38(3):634-640.
[7] GAMALELDIN R, ISKANDER I, SEOUD I, et al. Risk factors for neurotoxicity in newborns with severe neonatal hyperbilirubinemia[J].Pediatrics,2011,128(4):e925-e931.
[8] 刘开珍,何华云,华子瑜,等.新生儿急性胆红素脑病227例临床分析[J].临床儿科杂志,2012,30(9):840-844.
[9] OLUSANYA B O, OGUNLESI T A, KUMAR P, et al. Management of latepreterm and term infants with hyperbilirubinaemia in resourceconstrained settings[J]. BMC Pediatr,2015,15(1):39.
[10] 金汉珍,黄德珉,关希吉.实用新生儿学[M]. 3版.北京:人民卫生出版社,2002:297-305.
[11] 魏幼华,王智楠,陈 平,等.严重高胆红素血症新生儿的听力学特征[J].听力学及言语疾病杂志,2011,19(3):206-209.
[12] 汪浩文,黄金保.新生儿高胆红素血症血清前白蛋白及总胆红素/白蛋白比值与脑干诱发电位的关系[J].国际儿科学杂志,2011,38(1):91-93.
[13] 吕峻峰,杨冰岩,王维琼,等.严重高胆红素血症新生儿急性胆红素脑病危险因素分析[J].中国新生儿科杂志,2014,29(4):242-244.
[14] 王艳丽,颜慧恒,张 永,等.胆红素脑病患儿内在因素及外在高危因素分析[J].中国新生儿科杂志,2015,30(2):90-91.
[15] 毛 健,富建华,陈丽英,等.重度高胆红素血症新生儿苍白球磁共振成像特征及其临床意义[J].中华儿科杂志,2007,45(1):24-29.
[16] 李豪刚,张玉忠,陈 凯,等.MRI在新生儿胆红素脑病中诊断价值[J].放射学实践,2013,28(10):1062-1065.
[17] 颜慧恒,任建兵,钟 迪,等.广东省不同胎龄新生儿胆红素脑病多中心调查结果分析[J].国际医药卫生导报,2017,23(24):3826-3828.
