崇明东滩湿地土壤生物固氮沿潮滩水淹梯度的特征
2018-06-25孙秀茹童帮会闫如玉韩美丽林贤彪华东师范大学地理科学学院地理信息科学教育部重点实验室上海200241
孙秀茹,童帮会,闫如玉,刘 敏,韩美丽,林贤彪,程 吕 (华东师范大学地理科学学院,地理信息科学教育部重点实验室,上海 200241)
河口湿地是重要的自然生态系统之一,具有独特的自然环境,较高的生产力,且在全球生物地球化学循环中扮演着重要的作用[1].尽管氮是河口湿地生态系统营养物质和初级生产力的重要元素,但氮污染及其影响起的生态环境问题也备受国内外学者的广泛关注[2-5].近年来,由于人类活动导致的大量无机氮进入到河口生态系统中,造成河口富营养化和藻华等一系列生态环境问题[1].因此,河口湿地氮的生物地球化学循环及其生态环境效应的研究已成为当今河口环境研究的热点话题之一.河口环境中氮的生物地球化学循环不仅包括了硝化、反硝化和厌氧氨氧化等可以减少氮污染的脱氮过程,还包括了氮的矿化和固氮等过程.固氮过程能够将大气中的氮气转化为环境中的可利用性氮,从而提高河口生态系统的初级生产力,但也可能加剧水体富营养化,因而受到了国内外学者的广泛关注[6-7].
河口湿地作为重要的生态系统之一,在全球氮循环中发挥着重要的作用[8-10].河口独特的水文条件对氮循环的转化具有重要的影响,此外海平面上升也会改变河口湿地生态系统的特性,进而影响氮循环过程[11].因此,开展河口湿地微生物固氮特征及其生态环境效应研究对于全球生物地球化学循环具有重要的意义[12].目前,关于微生物固氮的研究结果表明,在热带亚热带海域大量蓝藻固氮细菌(束毛藻属、胞内植生藻)的海洋微生物固氮[13],而在海洋温度相对较低(<20℃)的海域抑制大量蓝藻细菌的生长,并形成高溶解度的无机氮浓度,从而抑制固氮速率[14].然而,最近的研究表明,海洋固氮作用,可能是由单细胞的蓝藻细菌和异样细菌介导的,即使在相对较冷(<10℃)和大西洋海岸[15]和波罗的海河口[16]也发现了这些固氮微生物.Shiozaki等[17]对日本本州岛东部温暖浅海固氮及其影响因子研究,结果表明温度、nifH丰度和种类直接影响了微生物固氮速率.此外,Varley等[18]研究结果说明在固氮酶影响下的固氮速率受到环境中铁元素的影响.然而,湿地生态系统土壤微生物固氮研究表明温度是影响固氮微生物分布的最显著因子[19-20].此外,溶解性无机氮对河口固氮作用有抑制作用,但低水平的氮磷比和铁等微量元素对固氮作用有促进作用[21].在河口生态系统中,Huang等[22]在崇明北部同一潮滩海拔不同采样点土壤表层固氮速率,发现微生物固氮会受到外来入侵植物的影响,且这些外来入侵植物是通过改变表层土壤氮磷比率,从而影响了表层土壤的固氮速率.谢文霞等[23]对胶州湾河口湿地土壤氮含量的空间分布研究发现,铵态氮、硝态氮、总有机碳和总磷主要集中在土壤表层,对表层土壤的固氮影响较大[25]. Moisander等[24]研究切萨皮克湾沉积物固氮微生物组成的时空变化发现,盐度、溶解性无机氮、溶解性有机碳和溶解性有机磷等环境因子与固氮微生物群落组成有显著关系.迄今为止,已有的水生固氮微生物研究多限于海洋,固氮作用也多与水质以及氮的含量密切相关[24-27].

图1 长江口东滩地理位置与采样点Fig.1 Locations of Dongtan wetland in the Yangtze Estuary and sampling sites of sediments
崇明东滩是长江口规模最大、发育最完善的河口型潮汐湿地.在潮汐周期性淹没循环的过程中引起沉积物周期性淹没和裸露,是崇明东滩河口环境的显著特征之一,其过程改变了河口的物理化学生物性质,影响生物地球化学循环过程[8,28-30].近年来,由于工业的排放以及农业氮肥的使用,大量的营养盐进入到河口环境,引起了富营养化、赤潮等环境,进而影响着长江口湿地氮循环过程[2,31].目前,长江口潮滩湿地研究主要为土壤呼吸,温室气体排放,外来植物入侵,微生物脱氮过程等为主[32-34],对固氮以及固氮功能基因沿水文梯度分布的研究的报道较少,且固氮和生物功能基因的影响因素尚不明确.本文以长江口崇明东滩湿地作为研究区,采用同位素和分子生物技术,开展不同水文梯度下沉积物固氮速率与固氮功能基因的研究,并分析其关键影响因素,研究结果不仅深化氮循环的理论认识,而且可为河口潮滩湿地氮污染控制提供科学依据.
1 研究区概况与研究方法
1.1 研究区概况
崇明岛位于长江口,是泥沙沉积形成的沉积岛,也是我国第三大岛.崇明东滩湿地位于崇明岛最东端 (31°25′~31°38′N, 121°50′~122°05′E),属于典型的亚热带季风性湿润气候,夏季和冬季均温分别为 28.9℃和 5.6℃[35],多年平均降水量约为1144mm[73].潮汐为对长江形成顶托作用,使得长江江水所携带的流域泥沙在东滩沉积[36].潮汐作为东滩最显著的影响特征之一,对潮滩理化因子和植被类型产生较大的影响,在不同高程形成了不同的地貌环境.东滩土壤多为滨海沙土、黏土,这些沉积物中约60%来源于每年的5~9月份[38]长江的丰水期,江水携带的大量泥沙在此沉积.
最低潮滩位置,平均海拔约 2m,受潮汐影响频繁,并无植被生长,为裸滩,土壤多为粗粉砂,局部为细沙;中部潮滩平均海拔约 2~2.9m,在低潮时不会受潮水影响,植被为海三稜藨草,土壤以中粉砂为主;较高潮滩平均海拔均大于 2.9m,植被为芦苇和1995年大量入侵东滩的外来物种互花米草[74],土壤以细粉砂和黏土为主.正规半日潮在崇明东滩呈有规律的波动,潮滩位置越低受潮汐影响越大,高潮滩受半日潮的影响较弱.
1.2 研究方法
1.2.1 样品采集 对崇明东滩潮滩湿地地形、植被、土壤全面考察后,于2016年1月和6月在崇明东滩,沿水文梯度(从低到高,样点潮滩位置越低,水淹频率越高)选取一条采样带,设置 8个样点(每个样点之间相距约为300~500m),每个样点取 3个重复,分别对裸滩和植被点进行土壤采样,随机取点,样品充分混匀.用不锈钢质土钻采集表层土壤样品(0~5cm),装入灭菌的离心管中,4℃保存.在采集后的2h内将这些土壤样品运回实验室,在无氧环境下均质化,一部分鲜土保存在 4℃用于测定土壤固氮速率,一部分冷冻干燥后研磨过 100目筛,装于密封袋中用于理化性质测定,一部分保存在-80℃的环境下用于DNA提取和基因丰度测定.
1.2.2 样品理化性质测定方法 样品预处理已经将土壤样品中的营养盐提取出来保存在样品中的杂质沉淀并过滤掉,每个样品3个平行.无机氮(氨(NH4+)、硝酸盐(NO2-)、亚硝酸盐(NO3-))先用2mol/L的氯化钾(KCl)溶液从土壤中直接萃取,再用分光光度法在流式营养盐自动分析仪(SAM plus,Skalar Analytical B.V.,the Netherlands)上进行测定.SO42-用去离子水萃取,离子色谱仪测定.总磷(TP)采用浓 H2SO4-HCLO4消煮法测定[38].土壤pH值采用无CO2超纯水和样品按照2.5:1的比例混合[39],用 Mettler-Toledo pH 计测量.样品的含水量(MC)采用烘干法测定[7,39],即把采集的土壤放在 60℃环境下烘干来估算它的重量损失,同样的方法用来测定样品的含盐量.样品用 1mL HCl(1mol/L)消除碳酸钙后,利用Elementar analyzer vario MaxCNOHS(德国)测定总有机碳(TOC)[22].二价铁(Fe2+)和总 Fe分别用0.5mol/L 盐酸和0.25mol/L 盐酸-盐酸羟胺萃取之后,用 ferrozine 方法测定[40].三价铁(Fe3+)含量计算采用总铁减去Fe2+.
1.2.3 固氮速率测定方法 采用15N2同位素示踪法测定土壤样品固氮速率[41-44].取 20g土壤按照 1:7(土壤/水)的比例混合成泥浆,于培养瓶中曝氩气15min[1,43,45].将培养瓶于20℃培养箱中避光培养24h,培养结束后,将泥浆加入12.5mL顶空瓶(Labco, Exetainer).将顶空瓶分成2组,每组4支,其中一组加入1mL15N2气体进行培养24h,加入 0.2mL ZnCl2终止微生物活性,另一组加入0.2mL ZnCl2抑制微生物活性,作为起始样[46].起始和终止顶空瓶加入0.2mL 次溴酸钠氧化剂,将生成的铵氧化成29N2和30N2,并用膜入口质谱分析仪MIMS(Membrane Inlet Mass Spectrometry,HPR-40, Germany)[47]测定29N2和30N2.
样品中固氮速率计算公式见式:
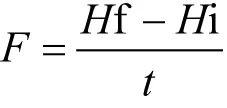
式中:F(µmol N/(kg·h))为潜在固氮速率;Hi 和Hf(µmol N/kg)分别是培养前的起始样品和培养后的终止样品中15NH4+的浓度,t(h)则是培养的时间.

表1 采样点理化性质Table 1 Distribution of physical chemical properties sampling sites
1.2.4 DNA提取方法 采用MOBIO公司生产的PowersoilTMDNA Isolation Kits提取沉积物样品 DNA,具体实验步骤参照该产品实验说明书.实验时,称取0.25g沉积物样品进行总DNA提取,并将提取出的总DNA经过1%的琼脂糖凝胶电泳进行检测.为尽可能的减小实验误差,实验过程中的每个样品均做3个平行,将样品总DNA保存于-80℃.
1.2.5 固氮基因定量分析(qPCR) 固氮微生物的丰度通过SYBR Green I-based qPCR方法测定.每个反应试管内含有 0.5µL模板 DNA,10µL SYBR® Premix Ex TaqTM(Takara),每种引物0.5µL(10µmol/L),0.5µL BSA(1µg/μL),0.4µL ROX染料(50X)和 7.8µL无菌蒸馏水.DNA 质粒所携带的nifH基因的拷贝数作为模板绘制出标准曲线图PCR的定量分析通过ABI7900 (ABI, USA)仪器测定.热循环按照以下步骤进行:95℃环境下预变性 3min,随后以在 95℃下反应 15s, 55℃下反应25s,72℃下反应45s进行40个循环.样品固氮基因拷贝数采用标准曲线进行计算所得.
1.2.6 数据处理 统计分析在 SPSS 17.0版本进行.采用 ANOVA分析理化性质、微生物丰度和土壤固氮速率在不同样点之间的显著性.Person分析土壤理化性质、微生物丰度与土壤固氮速率之间的相关关系.
2 结果与分析
2.1 土壤理化特征
由表1可见,研究区样点土壤pH变化范围为7.17~7.93,处于较低潮滩的土壤 pH 值偏高,但在整个潮滩的变化较小.土壤盐度也是同样分布规律,水文梯度较低的土壤盐度略微偏高,且平均盐度为 0.1%~0.3%.NH4+的含量冬季(4.32µg/g~9.75µg/g)高于夏季(2.98µg/g~7.41µg/g),但只在冬季植被潮滩土壤中,NH4+的含量表现出明显的随潮滩水文梯度的增高而降低,其在其他潮滩无明显的水文梯度变化.Fe2+、SO4-以及 TOC含量的变化均与NH4+类似,同样只在冬季植被潮滩土壤中表现出明显的随潮滩水文梯度的增高而增高.NO3-的含量则在大部分情况下都随潮滩梯度的增高而降低.Fe3+在潮滩表层沉积物中的含量随潮滩梯度变化较大,其变化规律随潮滩的变化表现出先增后减,尤其在夏季裸滩土壤中表现最为明显.
2.2 土壤固氮速率分析
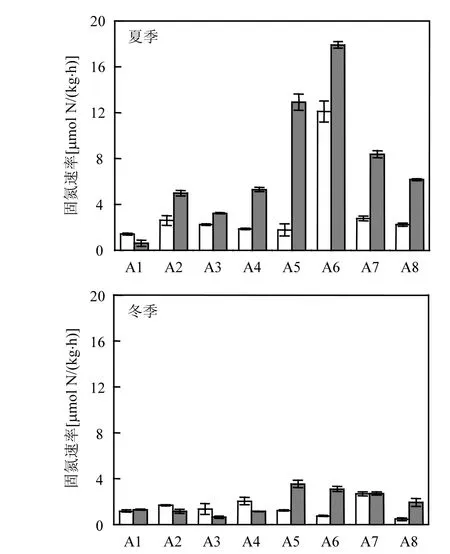
图2 不同水文梯度土壤固氮速率分布特征Fig.2 Characteristics of soil nitrogen fixation rate with different hydrological gradient
从图 2可看出,BNF变化范围为 0.47~17.91µmol N/(kg·h),夏季BNF数值及沿潮滩变化幅度均明显大于冬季,且大部分植被表层BNF高于裸滩.BNF从低潮滩向高潮滩呈增加的趋势.
夏季植被的表层潮滩BNF在最低海拔潮滩样点 A1 处最低(0.62µmol N/(kg·h)),从低潮滩向高潮滩大致呈增加的趋势,在样点 A6达到峰值(17.91µmol N/(kg·h)),之后向高潮滩速率降低.裸滩潮滩表层土壤在夏季BNF的整体变化趋势与植被大致一致,其速率最低值也在样点 A1处(1.41µmol N/(kg·h)),最高值在 A6 处(12.11µmol N/(kg·h)),且大部分,样点植被潮滩BNF高于裸滩.冬季,两者的固氮速率均较低(0.48µmol N/(kg·h)~3.55µmol N/(kg·h)),随潮滩海拔有一定变化幅度且与夏季类似但趋势不明显.
2.3 土壤微生物丰度沿潮滩水文梯度的变化
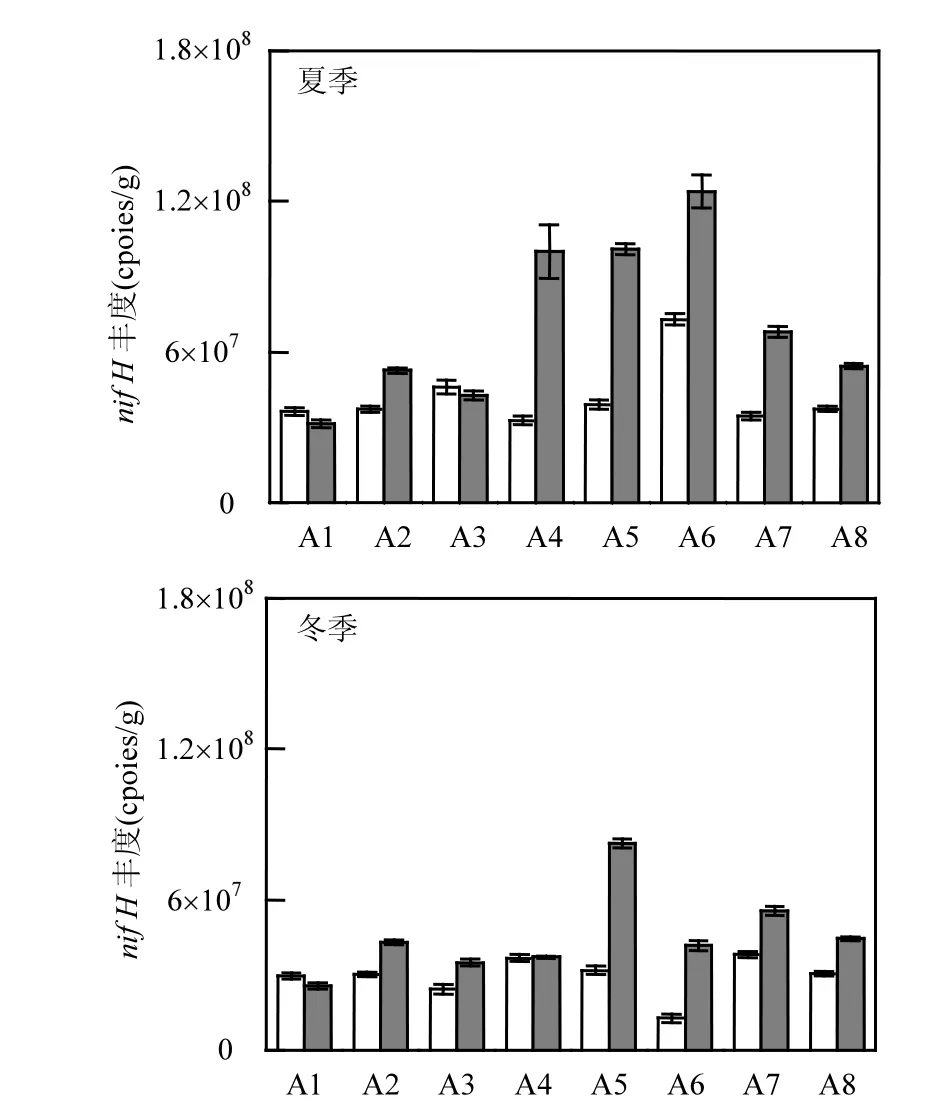
图3 不同水文梯度土壤固氮生物丰度基因Fig.3 Abundance of nitrogen fixation gene soil of with different hydrological gradients

由图3可知,土壤生物nifH丰度整体表现为夏季的nifH丰度值和变化幅度均高于冬季,但不同季节和不同土壤性质的空间分布具有一致性,且都与固氮速率的空间分布存在明显的对应关系.夏季植被表层土壤生物 nifH丰度在样点 A6处达到峰值(1.24×108copies/g),显著高于低潮滩A1的nifH丰度(3.14×107copies/g),并且nifH丰度从低潮滩向高潮滩逐渐增加的趋势在整个研究过程均有表现.裸滩在夏季的nifH丰度最高值同样出现在样点 A6(7.30×107copies/g),明显低于植被生物量,样点 A1处的丰度最低值(3.28×107copies/g)则与植被相近.冬季整个潮滩表层土壤的生物nifH丰度均不同程度的低于夏季,尤其是裸滩样点 A3(夏季:4.61×107copies/g,冬季:2.43×107copies/g)、A6(夏季:7.30×107copies/g 冬季:1.29×107copies/g),植被样点 A4(夏季:1.003×108copies/g,冬季:3.72×107copies/g)、A6(夏季:1.24×108copies/g,冬季:4.18×107copies/g).
2.4 土壤理化性质与固氮速率和固氮基因丰度的相关性
NO3-与冬季植被BNF呈显著负相关(P<0.05)(表 2),与冬季裸滩土壤和夏季植被 BNF呈极显著负相关(P<0.01).Fe3+仅与夏季裸滩 BNF呈现极显著正相关(P<0.01),Fe2+则与冬季植被 BNF呈显著正相关(P<0.05).TOC和 NH4分别与夏季植被BNF和冬季植被BNF呈显著正相关和显著负相关(P<0.05).盐度与夏季和冬季植被 BNF呈极显著(P<0.01)或显著(P<0.05)负相关,但 P 与夏季和冬季植被BNF均呈极显著正相关.这些因素对其他情况下的BNF的影响相对较小.
3 讨论
河口潮汐湿地水淹频率的变化是影响其生态系统的关键因子之一[46-47].Karl等[48]认为不同潮滩水淹频率的不同使土壤中可利用的有机物质含量在潮滩的分布也不同,进而对BNF的影响程度不同.本研究0~5cm土层理化性质含量均表现出随潮滩水淹频率的不同而不同,与该研究结果一致.其中,海水的pH一般偏中性或者偏碱性,使得较低潮滩的土壤pH也中性偏碱一些,且pH与冬季植被 BNF(r=-0.41,P<0.05)和固氮基因nifH(r=-0.41,P<0.05)呈显著负相关,盐度与植被的夏季和冬季的BNF呈极显著(r=-0.57,P<0.01)或显著(r=-0.42,P<0.05)负相关性(表 2).此外,Lin等[45]对上海市河网沉积物土壤固氮速率空间分异特征的研究表明,可溶性无机氮在土壤中的浓度与固氮速率呈反比,本研究0~5cm土层固氮速率总体上随着无机氮NO3-含量的降低而增加,在样点A6处,土壤无机氮NO3-含量最低,土壤固氮速率达到最高,本文研究结果也与之一致.研究区域内NO3-与夏季植被和冬季裸滩BNF均呈极显著负相关(r>0.6,P<0.01),与冬季植被BNF呈显著负相关(r=-0.51,P<0.05),说明夏季植被表层BNF对于土壤中硝酸盐的输入更加敏感[49-51].水周期性淹没不仅会影响土壤理化性质,还会造成土壤微生物的差异.高灯州等[52]对闽江口鳝鱼滩河口潮滩湿地的研究结果表明,随水淹频率增加,地下生物量,微生物丰度降低.本研究显示随水淹频率增加,表层土壤nifH丰度降低,说明高频率的水淹环境造成土壤表层的微生物活动因缺氧而减少,使得土壤微生物的生长也有所降低[53].
这与Poret-Peterson等[54]对潮滩湿地不同水文梯度表层土壤的微生物碳含量研究结果相似.

图4 固氮速率与固氮功能基因nifH丰度的相关性Fig.4 Correlations between nitrogen fixation rate and nitrogen fixation gene nifH abundance

土壤微生物功能基因nifH丰度和活性影响BNF,而植被的生长则会改变土壤的丰度和循环过程[55-56].已有研究表明,在一个不断循环的环境中,植被的生长可以提高表层土壤的 BNF[57-59],本文研究发现对比植被和裸滩表层土壤的 BNF与上述研究结果一致.相关分析(图2、图4)结果表明,大部分生长植被的潮滩表层BNF比裸滩高,且nifH丰度与土壤BNF呈极显著正相关(r>0.5,P<0.01).土壤的微生物活性与植被生物量生产有着密切的联系,植物的生物量越丰富,越能为土壤提供更丰富的底物,微生物丰度也会越大[46].本研究对潮滩同一梯度的裸滩与植被表层土壤中TOC含量分析表明,大部分植被表层土壤 TOC含量均高于同潮滩水位的裸滩土壤.这主要是因为,与裸滩土壤相比,植物(互花米草或芦苇)根围土壤对环境中的N、P具有较强的吸附作用,能够将潮滩湿地土壤以及海水中的N、P等养分截留吸取,并以生物量的形式储存起来,并对其根围细菌活性存在一定的刺激作用[22].在我们研究的环境系统中,植被有地上生物量、凋落物产量,但裸滩并无这些,且植被土壤中的有机质、微生物产量、土壤呼吸率也均高于裸滩土壤[61-62].植物在促进土壤微生物循环的过程中,也会促进土壤中微量营养素的循环,活跃固氮菌.本研究结果表明植 被 表 层 土 壤 BNF(0.62µmol N/(kg·h)~17.91µmol N/(kg·h))和 nifH 丰度(3.14×107copies/g~1.24×108copies/g)大部分高于裸滩(1.41µmol N/(kg·h)~12.11µmol N/(kg·h),3.28×107copies/g~7.30×107copies/g),与 Welsh 等[63]对盐泽草地中的BNF会随着植物初级生产力的提高而提高的研究结果一致.气温可能也是影响 BNF的重要因素之一[64],因为温度在很大程度上直接影响土壤微生物的新陈代谢,从而影响BNF的高低.且夏季植被处于生长期和旺盛期,在此期间植被由于自身需要,其根际微生物会分泌有机酸、磷酸酶等物质,提高土壤速效磷含量[64-65],增加土壤中的可利用营养物质,从而促使这一范围内表层 BNF的提高[66].本研究夏季固氮速率范围和冬季固氮速 率 范围分别为(0.62µmol N/(kg·h)~17.91µmol N/(kg·h))和(0.48µmol N/(kg·h)~3.55µmol N/(kg·h)),夏季表层土壤BNF明显高于冬季,且夏季nifH丰度与固氮速率的相关性更好(r>0.6,P<0.01),也更好的证实了上述观点.此外,Yao等[67]和Hamer等[66]认为,TOC作为影响微生物量的主要因素,其含量也与微生物关系密切,在一定程度上体现了土壤微生物的丰度.本文研究中,TOC含量与夏季植被BNF均呈显著正相关(r=0.45,P<0.05),进一步证实了 TOC对土壤微生物量的影响.虽然长江河口潮滩湿地的土壤 N浓度比其他土壤有机质匮乏区高[68-69],但是土壤中的 N浓度很大程度上受生长的植被影响,也许可以推测长江口潮滩湿地土壤中N:P的比例对于植物生长也是一个重要的因素.
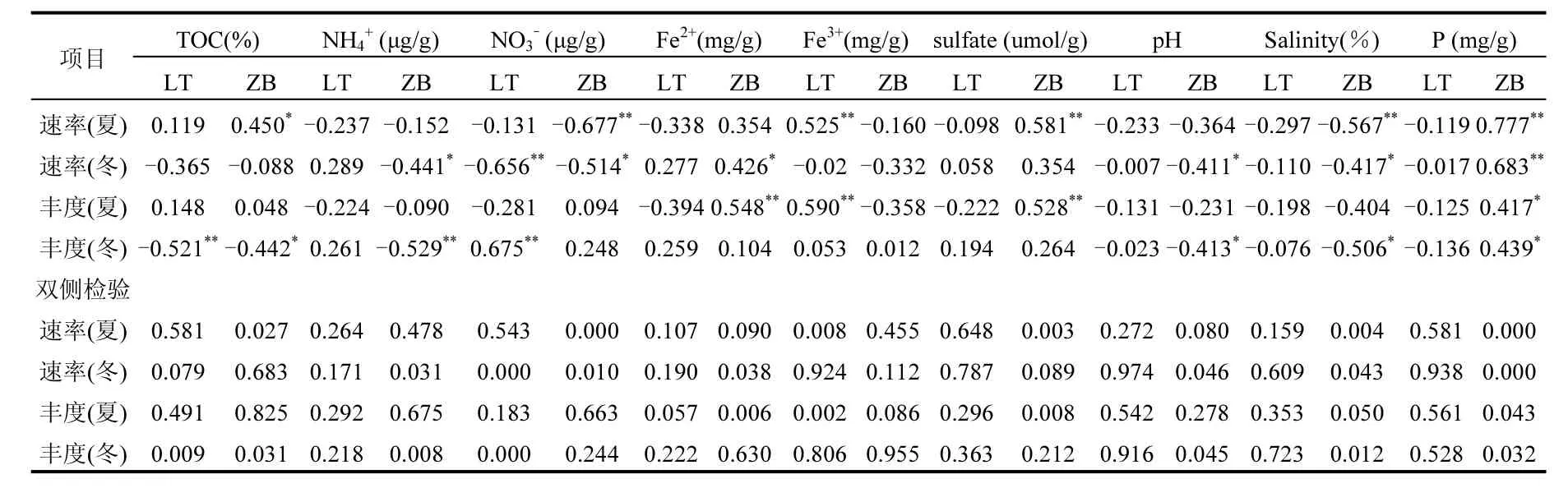
表2 固氮速率与理化因子皮尔逊相关系数分析(n = 24)Table 2 Pearson’s correlation analysis between nitrogen fixation and geochemical properties (n = 24)
不同地区不同生态系统微生物固氮速率相差很大(表3),北部湾北部海域微生物固氮速率的空间分布显示,琼州海峡西侧海域固氮速率要高于湾顶沿海海域,其固氮作用除了主要受无机氮营养盐、温度等因素影响外,可能还与琼州海峡西向流有关[55].通常热带亚热带观测区的固氮速率较高,林峰[73]等估算出我国南海生物年固氮通量为 2.9×1011mol N/a,约占全球年固氮量的2.7%,属于生物固氮作用比较活跃的海域之一.人类活动输入氮量很高的河口等海岸带地区微生物固氮所占的比例较低.
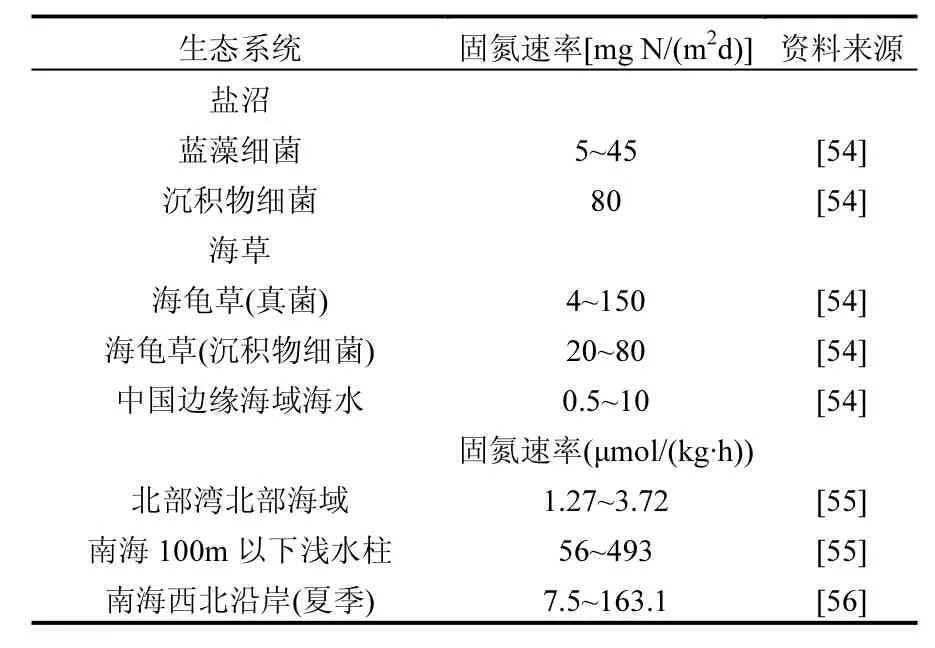
表3 其他生态系统固氮速率Table 3 Nitrogen fixation rate in other ecosystem
长江口河口湿地是一个复杂的生态系统,其湿地表层土壤中的固氮速率是受气候、水体、潮汐、地表植被类型及其生长状况等多种因素综合影响的结果,因此,地表植被类型,不同水文梯度的水淹频率等与潮滩表层土壤固氮速率之间的关系还有待更深入的研究.
4 结论
4.1 土壤 BNF总体上随着水淹频率的增加波动降低,在夏季波动幅度更加明显.
4.2 土壤中固氮nifH丰度沿水文梯度的分布特征与BNF分布特征相似.
4.3 固氮功能基因nifH丰度与固氮速率分布呈极显著正相关,且植被表层土壤BNF和nifH丰度均大部分高于裸滩.
4.4 土壤理化性质对BNF和土壤固氮基因nifH含量均有一定程度的影响.
[1]Deng F, Hou L, Liu M, et al. Dissimilatory nitrate reduction processes and associated contribution to nitrogen removal in sediments of the Yangtze Estuary [J]. Journal of Geophysical Research: Biogeosciences, 2015,120(8):1521-1531.
[2]Deng H, Wang D, Chen Z, et al. Vertical dissolved inorganic nitrogen fluxes in marsh and mudflat areas of the Yangtze Estuary[J]. Journal of environmental quality, 2014,43(2):745-752.
[3]Gardner W S, McCarthy M J, An S, et al. Nitrogen fixation and dissimilatory nitrate reduction to ammonium (DNRA) support nitrogen dynamics in Texas estuaries [J]. Limnology and Oceanography, 2006,51(1part2):558-568.
[4]Camargo J A, Alonso Á. Ecological and toxicological effects of inorganic nitrogen pollution in aquatic ecosystems: a global assessment [J]. Environment international, 2006,32(6):831-849.
[5]Roberts K L, Kessler A J, Grace M R, et al. Increased rates of dissimilatory nitrate reduction to ammonium (DNRA) under oxic conditions in a periodically hypoxic estuary [J]. Geochimica et Cosmochimica Acta, 2014,133:313-324.
[6]Souza V F, Santoro A L, van Weerelt M, et al. Sediment denitrification,DNRA and anammox rates in tropical floodplain lake (Pantanal,Brazil) [J]. Oecologia Australis, 2017,16(4):734-744.
[7]Song G D, Liu S M, Marchant H, et al. Anammox, denitrification and dissimilatory nitrate reduction to ammonium in the East China Sea sediment [J]. Biogeosciences, 2013,10(11):6851-6864.
[8]Li X, Hou L, Liu M, et al. Primary effects of extracellular enzyme activity and microbial community on carbon and nitrogen mineralization in estuarine and tidal wetlands [J]. Applied microbiology and biotechnology, 2015,99(6):2895-2909.
[9]管卫兵,王丽娅,许东峰.珠江河口氮和磷循环及溶解氧的数值模拟 [J]. Ⅰ 模式建立, 2003,25(1):52-60.
[10]范改娜,祝贵兵,王 雨,等.河流湿地氮循环修复过程中的新型功能微生物 [J]. 环境科学学报, 2010,30(8):1558-1563.
[11]龚 骏,张晓黎.微生物在近海氮循环过程的贡献与驱动机制[J]. 微生物学通报, 2013,40(1):44-58.
[12]胡敏杰,任洪昌,邹芳芳,等.闽江河口淡水,半咸水沼泽土壤碳氮磷分布及计量学特征 [J]. 中国环境科学, 2016,36(3):917-926.
[13]Codispoti L A. An oceanic fixed nitrogen sink exceeding 400Tg N a? 1vs the concept of homeostasis in the fixed-nitrogen inventory [J]. Biogeosciences, 2007,4(2):233-253.
[14]Breitbarth E, Oschlies A, LaRoche J. Physiological constraints on the global distribution of Trichodesmium? effect of temperature on diazotrophy [J]. Biogeosciences, 2007,4(1):53-61.
[15]Mulholland M R, Bernhardt P W, Blanco-Garcia J L, et al. Rates of dinitrogen fixation and the abundance of diazotrophs in North American coastal waters between Cape Hatteras and Georges Bank [J]. Limnology and Oceanography, 2012,57(4):1067-1083.
[16]Bentzon-Tilia M, Traving S J, Mantikci M, et al. Significant N 2fixation by heterotrophs, photoheterotrophs and heterocystous cyanobacteria in two temperate estuaries [J]. The ISME journal,2015,9(2):273.
[17]Shiozaki T, Nagata T, Ijichi M, et al. Nitrogen fixation and the diazotroph community in the temperate coastal region of the northwestern North Pacific [J]. Biogeosciences, 2015,12(15):4751-4764.
[18]Varley J B, Wang Y, Chan K, et al. Mechanistic insights into nitrogen fixation by nitrogenase enzymes [J]. Physical Chemistry Chemical Physics, 2015,17(44):29541-29547.
[19]Dang H, Yang J, Li J, et al. Environment-dependent distribution of the sediment nifH-harboring microbiota in the northern South China Sea [J]. Applied and environmental microbiology, 2013,79(1):121-132.
[20]胡晓婷,程 吕,林贤彪,等.沉积物硝酸盐异化还原过程的温度敏感性与影响因素——以长江口青草沙水库为例 [J]. 中国环境科学, 2016,36(9):2624-2632.
[21]Howarth R W, Marino R, Cole J J. Nitrogen fixation in freshwater,estuarine, and marine ecosystems. 2. Biogeochemical controls [J].Limnology and Oceanography, 1988,33:688-701.
[22]Huang J, Xu X, Wang M, et al. Responses of soil nitrogen fixation to Spartina alterniflora invasion and nitrogen addition in a Chinese salt marsh [J]. Scientific Reports, 20384:doi:10.1038/srep20384(2016).
[23]谢文霞,朱鲲杰,崔育倩,等.胶州湾河口湿地土壤有机碳及氮含量空间分布特征研究 [J]. 草业学报, 2014,23(6):54-60.
[24]Moisander P H, Morrison A E, Ward B B, et al. Spatial‐ temporal variability in diazotroph assemblages in Chesapeake Bay using an oligonucleotide nifH microarray [J]. Environmental microbiology,2007,9(7):1823-1835.
[25]Farnelid H, Öberg T, Riemann L. Identity and dynamics of putative N2‐ fixing picoplankton in the Baltic Sea proper suggest complex patterns of regulation [J]. Environmental microbiology reports, 2009,1(2):145-154.
[26]Langlois R J, Hümmer D, LaRoche J. Abundances and distributions of the dominant nifH phylotypes in the Northern Atlantic Ocean [J]. Applied and environmental microbiology,2008,74(6):1922-1931.
[27]Yu Z, Zhou J, Yang J, et al. Vertical distribution of diazotrophic bacterial community associated with temperature and oxygen gradients in a subtropical reservoir [J]. Hydrobiologia, 2014,741(1):69-77.
[28]Hou L J, Liu M, Xu S Y, et al. The effects of semi-lunar spring and neap tidal change on nitrification, denitrification and N2O vertical distribution in the intertidal sediments of the Yangtze estuary, China [J]. Estuarine, Coastal and Shelf Science, 2007,73(3/4):607-616.
[29]Hou L, Liu M, Carini S A, et al. Transformation and fate of nitrate near the sediment—water interface of Copano Bay [J]. Continental Shelf Research, 2012,35:86-94.
[30]Meyerson L A. Tidal wetlands primer: An introduction to their ecology, natural history, status, and conservation [J]. Rhodora,2014,116(968):502-504.
[31]Hou L, Zheng Y, Liu M, et al. Anaerobic ammonium oxidation(anammox) bacterial diversity, abundance, and activity in marsh sediments of the Yangtze Estuary [J]. Journal of Geophysical Research: Biogeosciences, 2013,118(3):1237-1246.
[32]Tang Y, Wang L, Jia J, et al. Response of soil microbial community in Jiuduansha wetland to different successional stages and its implications for soil microbial respiration and carbon turnover [J]. Soil Biology and Biochemistry, 2011,43(3):638-646.
[33]Yu Z, Li Y, Deng H, et al. Effect of Scirpus mariqueter on nitrous oxide emissions from a subtropical monsoon estuarine wetland [J].Journal of Geophysical Research: Biogeosciences, 2012,117(G2).
[34]Zheng Y, Hou L, Liu M, et al. Diversity, abundance, and activity of ammonia-oxidizing bacteria and archaea in Chongming eastern intertidal sediments [J]. Applied microbiology and biotechnology, 2013,97(18):8351-8363.
[35]Andersson B, Sundbäck K, Hellman M, et al. Nitrogen fixation in shallow-water sediments: Spatial distribution and controlling factors[J]. Limnology and Oceanography, 2014,59(6):1932-1944.
[36]Bertics V J, Löscher C R, Salonen I, et al. Occurrence of benthic microbial nitrogen fixation coupled to sulfate reduction in the seasonally hypoxic Eckernförde Bay, Baltic Sea [J].Biogeosciences, 2013,10(3):1243-1258.
[37]Parkinson J A, Allen S E. A wet oxidation procedure suitable for the determination of nitrogen and mineral nutrients in biological material [J]. Communications in Soil Science & Plant Analysis,1975,6(1):1-11.
[38]Zheng Y, Hou L, Newell S, et al. Community dynamics and activity of ammonia-oxidizing prokaryotes in intertidal sediments of the Yangtze Estuary [J]. Applied and Environmental Microbiology, 2014,80(1):408-419.
[39]Lovley D R, Phillips E J P. 1987. Rapid assay for microbially reducible ferric iron in aquatic sediments [J]. Appl. Environ.Microbiol., 53,1536−1540.
[40]Capone D G. Determination of nitrogenase activity in aquatic samples using the acetylene reduction procedure [J]. Handbook of methods in aquatic microbial ecology, 1993:621-631.
[41]Hardy R W F, Burns R C, Holsten R D. Applications of the acetylene-ethylene assay for measurement of nitrogen fixation [J].Soil Biology and Biochemistry, 1973,5(1):47-81.
[42]Montoya J P, Voss M, Kahler P, et al. A simple, high-precision,high-sensitivity tracer assay for N (inf2) fixation [J]. Applied and Environmental Microbiology, 1996,62(3):986-993.
[43]Stewart W D, Fitzgerald G P, Burris R H. In situ studies on N2fixation using the acetylene reduction technique [J].Proceedings of the National Academy of Sciences, 1967,58(5):2071-2078.
[44]Zhang R, Chen M, Yang Q, et al. Physical‐ biological coupling of N2fixation in the northwestern South China Sea coastal upwelling during summer [J]. Limnology and Oceanography,2015,60(4):1411-1425.
[45]Lin X, Li X, Gao D, et al. Ammonium production and removal in the sediments of Shanghai river networks: Spatiotemporal variations, controlling factors and environmental implications [J].Journal of Geophysical Research: Biogeosciences.
[46]徐治国,何 岩,闫百兴,等.营养物及水位变化对湿地植物的影响 [J]. 生态学杂志, 2006,25(1):87-92.
[47]高灯州,曾从盛,章文龙,等.闽江口湿地土壤有机碳及其活性组分沿水文梯度分布特征 [J]. 水土保持学报, 2014,28(6):216-221.
[48]Karl D, Michaels A, Bergman B, et al. Dinitrogen fixation in the world’s oceans[M]//The Nitrogen Cycle at Regional to Global Scales. Springer Netherlands, 2002:47-98.
[49]Kitajima S, Furuya K, Hashihama F, et al. Latitudinal distribution of diazotrophs and their nitrogen fixation in the tropical and subtropical western North Pacific [J]. Limnology and Oceanography, 2009,54(2):537.
[50]Hashihama F, Furuya K, Kitajima S, et al. Macro‐scale exhaustion of surface phosphate by dinitrogen fixation in the western North Pacific [J]. Geophysical Research Letters, 2009,36(3):L03610.
[51]Shiozaki T, Furuya K, Kodama T, et al. Contribution of N2fixation to new production in the western North Pacific Ocean along 155E [J]. Marine Ecology Progress Series, 2009,377:19-32.
[52]高灯州,章文龙,曾 从.闽江河口湿地土壤生物和非生物因子与水淹频率的关系 [J]. 湿地科学, 2016,14(1):27-36.
[53]万忠梅,宋长春,郭跃东,等.毛苔草湿地土壤酶活性及活性有机碳组分对水分梯度的响应 [J]. 生态学报, 2008,28(12):5980-5986.
[54]Poret-Peterson A T, Ji B, Engelhaupt E, et al. Soil microbial biomass along a hydrologic gradient in a subsiding coastal bottomland forest:Implications for future subsidence and sea-level rise [J]. Soil Biology and Biochemistry, 2007,39(2):641-645.
[55]Crooks J A. Characterizing ecosystem‐ level consequences of biological invasions: the role of ecosystem engineers [J]. Oikos,2002,97(2):153-166.
[56]Didham R K, Tylianakis J M, Hutchison M A, et al. Are invasive species the drivers of ecological change? [J]. Trends in Ecology &Evolution, 2005,20(9):470-474.
[57]Ehrenfeld J G. Effects of exotic plant invasions on soil nutrient cycling processes [J]. Ecosystems, 2003,6(6):503-523.
[58]Tye D R C, Drake D C. An exotic Australian Acacia fixes more N than a coexisting indigenous Acacia in a South African riparian zone [J]. Plant ecology, 2012,213(2):251-257.
[59]Vitousek P M, Walker L R. Biological invasion by Myrica faya in Hawai'i: plant demography, nitrogen fixation, ecosystem effects[J]. Ecological monographs, 1989,59(3):247-265.
[60]牛 佳,周小奇,蒋 娜,等.若尔盖高寒湿地干湿土壤条件下微生物群落结构特征 [J]. 生态学报, 2011,31(2):474-482.
[61]Bu N, Qu J, Li Z, et al. Effects of Spartina alterniflora invasion on soil respiration in the Yangtze River Estuary, China [J]. PloS one,2015,10(3):e0121571.
[62]Chen X, Zong Y. Coastal erosion along the Changjiang deltaic shoreline, China: history and prospective [J]. Estuarine, Coastal and Shelf Science, 1998,46(5):733-742.
[63]Welsh J, McClelland M. Fingerprinting genomes using PCR with arbitrary primers [J]. Nucleic acids research, 1990,18(24):7213-7218.
[64]黄 敏,吴金水,黄巧云,等.土壤磷素微生物作用的研究进展[J]. 生态环境, 2003,12(3):366-370.
[65]罗先香,敦 萌,闫 琴.黄河口湿地土壤磷素动态分布特征及影响因素 [J]. 水土保持学报, 2011,25(5):154-160.
[66]Hamer U, Makeschin F, Stadler J, et al. Soil organic matter and microbial community structure in set-aside and intensively managed arable soils in NE-Saxony, Germany [J]. Applied Soil Ecology, 2008,40(3):465-475.
[67]Yao H, He Z L, Wilson M J, et al. Microbial biomass and community structure in a sequence of soils with increasing fertility and changing land use [J]. Microbial Ecology, 2000,40(3):223-237.
[68]Syvitski J P M, Kettner A J, Overeem I, et al. Sinking Deltas Due to Human Activities. Nature Geoscience, 2,681-686 [J]. 2009.
[69]FitzGerald D M, Fenster M S, Argow B A, et al. Coastal impacts due to sea-level rise [J]. Annu. Rev. Earth Planet. Sci., 2008,36:601-647.
[70]Liu J P, Xu K H, Li A C, et al. 2007. Flux and fate of Yangtze River sediment delivered to the East China Sea [J].Geomorphology, 85(3/4):208-224.
[71]Wang R Z, Yuan L, Zhang L Q. Impacts of Spartina alterniflora invasion on the benthic communities of salt marshes in the Yangtze Estuary, China [J]. Ecological Engineering, 2010,36:799-806.
[72]Hanson R B, Gundersen K. Relationship between nitrogen fixation (acetylene reduction) and the C: N ratio in a polluted coral reef ecosystem, Kaneohe Bay, Hawaii [J]. Estuarine and coastal marine science, 1977,5(3):437-444.
[73]林 峰.中国边缘海生物固氮速率的时空分布及其影响因素[D]. 2014.
[74]Zhang R, Chen M, Yang Q, et al. Physical-biological coupling of N2fixation in the northwestern South China Sea coastal upwelling during summer [J]. Limnology and Oceanography, 2015,60(4):1411-1425.
