紫苏叶挥发油组分和化学型影响因素探究Ⅲ
——异地栽培
2018-06-25潘诚魏长玲张琛武郭宝林李卫萍高占祥田景
潘诚,魏长玲,张琛武,郭宝林*,李卫萍,高占祥,田景
(1.中国医学科学院 北京协和医学院 药用植物研究所,北京 100193;2.辉瑞投资有限公司,北京 100010;3.甘肃省正宁县现代农业示范园区,甘肃 正宁 745000)
紫苏在中国分布范围广泛,其生长环境差别也很大。紫苏根据叶挥发油中的主要成分,可分为主要含紫苏醛(perilladehyde)的紫苏醛型(PA型),主要含紫苏酮(perillaketone)的紫苏酮型(PK型)(有时含有一定的异白苏烯酮isoegomaketone,并根据异白苏烯酮的含量分为不含或者仅含有1%~5%异白苏烯酮的PK-I型,和含有较多异白苏烯酮的PK-II型),主要含紫苏烯(perillene)的紫苏烯型(PL型),主要含香薷酮(elsholtzia ketone)的香薷酮型(EK型),以及主要含有苯丙烯类化合物的苯丙烯型(PP型),国内资源中普遍存在PA型和PK型,而PL型、EK型和PP型相对稀少[1-3]。本研究组前期对国内紫苏资源调查和化学型进行了归类分析,研究了PA、PK(PK-II)和PL三种化学型各1份种质在不同发育期以及叶的不同成熟程度对挥发油组分影响[2-5],本论文选择了包括PA、PK、PL、PP、EK五种化学型(及两类主成分兼有的混合化学型,如PAPK、PKEK),来自于国内10个主要产区的20份紫苏种质异地栽培后对叶挥发油成分进行比较,以探究环境条件不同对内在的挥发油组成可能产生的影响。
1 材料和方法
1.1 仪器和试剂
GC-MS(7890B-5977A)气相质谱联用仪器(Agilent安捷伦公司);旋转蒸发仪(EYELA N-1100 上海爱朗仪器有限公司);分析天平(FA2014N型,上海精密科学仪器有限公司);循环式真空泵(CA-1111上海爱朗仪器有限公司);KQ-500E型超声波清洗器(昆山市超声仪器有限公司)。
石油醚(分析纯,北京化工厂);正己烷(色谱纯,fisher公司)无水乙醇(分析纯,北京化工厂)。
1.2 样品
20份不同种质的紫苏果实,包括紫苏变种Perillafrutescensvar.frutescens16份、回回苏变种P.frutescensvar.crispa3份,以及野生紫苏变种P.frutescensvar.acuta1份,由本文作者郭宝林研究员鉴定,具体信息见表1(同一个产地的多份种质形态均有所不同,编号沿用了研究组的总编号)。实验用叶片采集自紫苏果实在北京和甘肃两地种植后生长的植株,于花前期采集的中部的成熟叶片,每个样品约60个单株混合,阴干,阴凉处存放。
1.3 实验地信息
北京实验地:位于北京市海淀区马连洼药植所院内。试验田地势平坦,土壤类型为沙壤土,基础肥力中等偏上。位于北纬39°47′,东经116°25′,海拔为50 m,属于温带大陆性气候,年平均气温8~12 ℃,年降水量600 mm。年日照时数2778 h,无霜期190 d左右。

表1 紫苏果实来源信息表
甘肃实验地:位于甘肃省庆阳市正宁县现代农业示范园。试验田地势平坦,土壤类型为黄绵土,基础肥力中等。位于北纬35°41′,东经108°37′,海拔为1360 m,属于温带大陆性半湿润气候,年平均温度8~9 ℃,年降水量460 600 mm。年日照时数2447 h,无霜期180 d左右。
2 研究方法
挥发油提取和GC-MS分析参见文献[3]。
3 结果和讨论
北京和甘肃实验地的20份种质的叶片挥发油成分及相对含量不一一列出。经化学型比较(见表2),发现仅有2份种质出现了化学型的变化,这2份种质的对应两组样品的成分对照表见表3。其他18份化学型未发生变化的种质则以化学型分类,将共有的主要成分进行了比较,参见图1、图2。
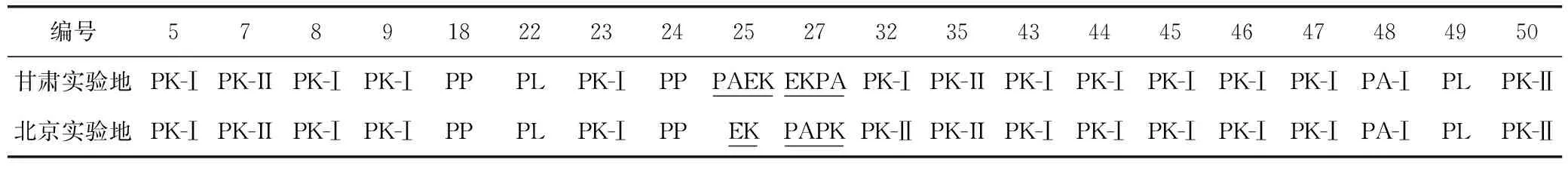
表2 北京和甘肃两地种植紫苏叶挥发油化学型对照表
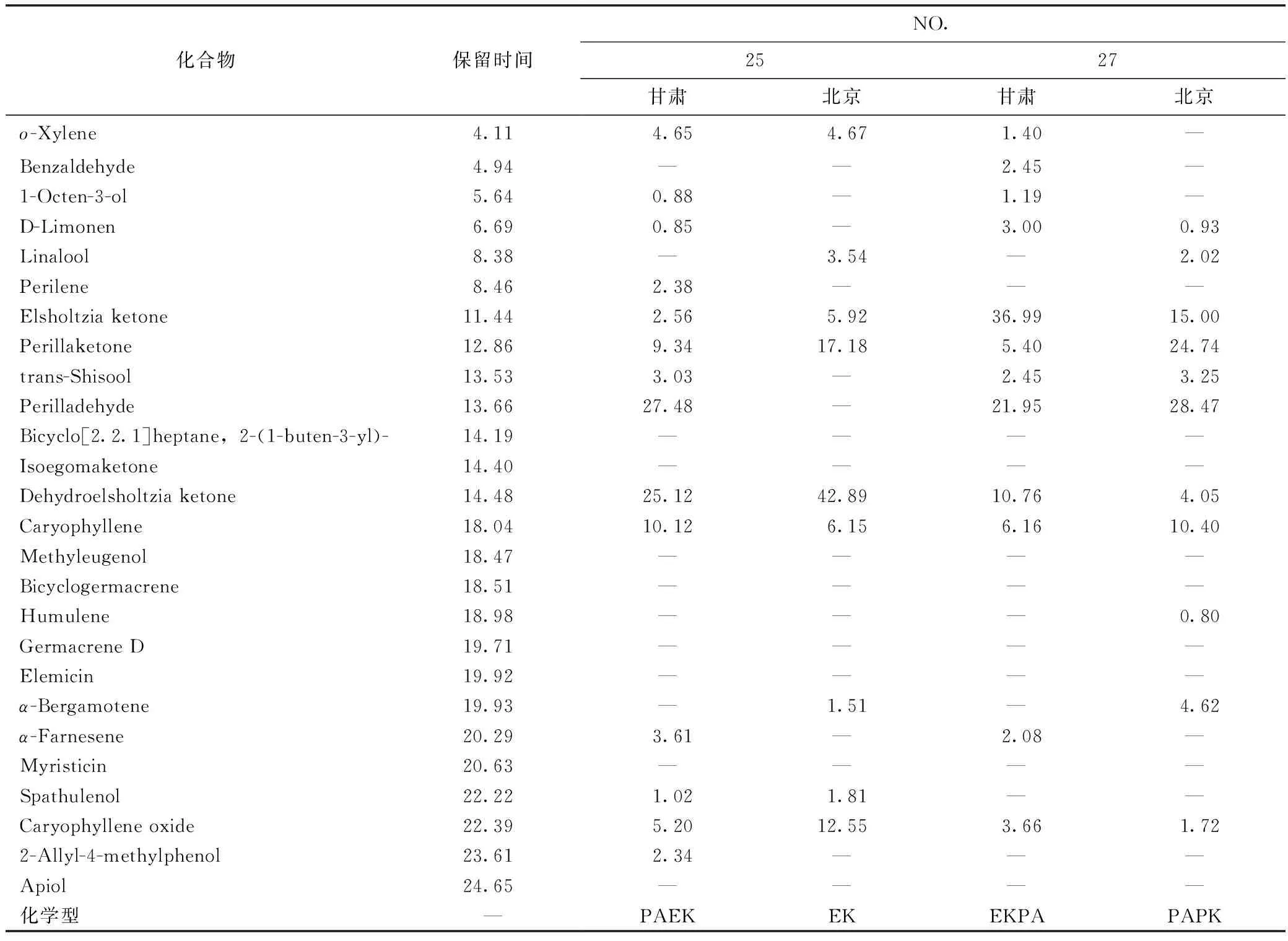
表3 2个化学型变化的种质挥发油组成对比表
注:“—”表示峰面积(%)小于0.01。
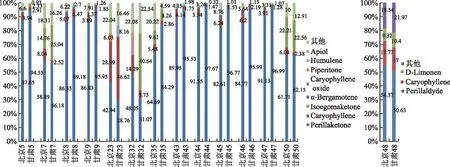
图1 PK和PA型在北京和甘肃两地种植紫苏叶挥发油主要成分对比图

图2 PL和PP型在北京和甘肃两地种植紫苏叶挥发油主要成分对比图
3.1 化学型发生改变
2份种质化学型发生变化,种源均来自河北安国。编号为25和27。
25号,化学型变化为甘肃PAEK型—北京EK型。两地共有高含量的EK型的特征性成分香薷酮或去氢香薷酮(dehydroelsholtzia ketone),只是甘肃实验地种质有高含量紫苏醛(27.48%)而北京实验地的种质不含有紫苏醛,其余多个成分也比较相关,如石竹烯(caryophyllene)、葎草烯(humulene)、大根香叶烯(germacrene D)。
27号,化学型变化为甘肃EKPA型—北京PAPK型。两地共有高含量的PA型特征性成分紫苏醛,及其他代谢相关成分trans-Shisool、1-辛烯-3-醇(2-(1-buten-3-yl)-)和芳樟醇(linalool)。但在另外的主要成分中,北京实验地葎草烯和大根香叶烯D 含量较高,而甘肃实验地α-法呢烯(α- farnesene)更高;
由于河北安国紫苏种植历史在几个种源中最为久远,且当地种植习惯未将不同种质隔离栽培而是多种种质相邻种植,因此导致这些种质中存在与主要化学型特征成分相关的基因可能处于杂合状态,表现上也出现了因环境影响的成分组成多变性。
3.2 化学型未发生改变
PK型(13份种质,5,7,8,9,23,32,35,43,44,45,46,47,50),核心成分紫苏酮在甘肃种质中相比更高一些,但与北京种质相差不大,个别种质例外(23,32,且二者紫苏酮含量均低于50%)。其中23号石竹烯含量北京明显少于甘肃(28.99%,46.62%),同时甘肃蛇麻烯(humulene)含量偏高,而北京则单萜类薄荷酮(piperitone)含量偏高。32号北京样品未检测到异白苏烯酮含量(属于PK-I亚型),而甘肃样品异白苏烯酮含量极高(40.64%)(PK-II亚型),而7号两份种质同为PK-II型,但是异白苏烯酮的含量也是甘肃样品稍高于北京,而35号、50号两份PK-II型种质则在两地的异白苏烯酮含量变化不大。
整体分析,北京和甘肃两个实验地的种质的其他主要成分中均有石竹烯(1.28%~46.62%),其余成分中主要区别在于倍半萜类(如α-佛手柑油烯(α-bergamot)、葎草烯、石竹烯氧化物(caryophyllene oxide))或部分单萜类成分(如薄荷酮)和苯丙烯类成分(如肉豆蔻醚(myristicin)、芹菜脑(apiol)),成分的种类或相对含量都可能存在差异。
PA型(1份种质,48),参见图1。其主要成分种类相同,均为紫苏醛、D-柠檬烯、石竹烯成分,两地主要成分相对含量也较接近。
PL型(2份种质,22,49)两地挥发油主要成分对比情况见图2。两份种质均以紫苏烯(54.51%~81.84%)、石竹烯(10.47%~12.39%)为主要成分。
PP型(2份种质,18,24)两地挥发油主要成分(相对含量在前3位)对比情况见图2。18号种质主要成分均为芹菜脑、石竹烯,北京种质主要成分相对含量较甘肃高,24号种质主要成分为肉豆蔻醚、石竹烯,两地种质中石竹烯相对含量差别不大,肉豆蔻醚成分甘肃种质相对含量较北京高。
4 小结
甘肃和北京实验地的气候地理环境差异有一些,但并不是很大。然而因为环境差异而导致的挥发油组分的差异,在不同种质中则表现出很大的区别。从已有的数据看,因主要成分变化而导致的化学型变化的情况较少(2/20),大多数情况紫苏种质不会因为环境的变化导致化学型的改变(同为PK型的两个亚型之间会产生变化)。
其中25和27号两份种质出现了化学型的改变,但其结果均有一定的相关性。结合分析其种源河北安国混杂种植的情况,表明当种质主要化学型特征成分相关的基因处于杂合状态时,容易导致栽培环境变化而引起挥发油成分组成的多变。
植物次级代谢产物是在各种诱导因子或信号分子的作用下产生的,在植物适应环境和克服胁迫因素中起着重要作用。有研究显示唇形科植物挥发油的数量和质量不仅取决于遗传因素和植物的发育阶段,也与环境因素息息相关,因为环境因素可以影响植物代谢过程中生化途径和生理过程,从而影响挥发油的生物合成[6]。而紫苏在生长过程中各种环境因子与挥发油合成过程之间的对应关系有待深入研究。
[1] Ito M.Studies onPerillarelating to its essential oil and taxonomy[M].Phytochemistry research progress.New York:Nova Science Publishers,2008:13-30.
[2] 魏长玲,郭宝林.紫苏叶挥发油的不同化学型及研究进展[J].中国中药杂志,2015,40(15):32-39.
[3] 魏长玲,郭宝林,张琛武,等.中国紫苏资源调查和紫苏叶挥发油化学型研究[J].中国中药杂志,2016,41(10):1823-1834
[4] 魏长玲,张琛武,郭宝林,等.紫苏叶挥发油化学型和组分影响因素探究Ⅰ——不同生长发育期[J].中国中药杂志,2017,42(4):712-718.
[5] 魏长玲,张琛武,郭宝林,等.紫苏叶挥发油组分和化学型影响因素探究Ⅱ-叶片不同成熟度[J].中国现代中药,2017,19(8):1170-1175,1186.
[6] Shahram Sharafzadeh,Mahdi Zare.Influence of Growth Regulators on Growth and Secondary Metabolites of Some Medicinal Plants from LamiaceaeFamily[J].Advances in Environmental Biology,2011,5(8):2296-2302.