金黄地鼠血液中5种阴离子含量测定方法的建立△
2018-05-30王东辉李先恩
王东辉,李先恩
(1.北京中医药大学 中药学院,北京 102488;2.中国医学科学院 北京协和医学院 药用植物研究所,北京 100193)
血液中含有各种营养成分,如无机盐、氧以及细胞代谢产物、激素、酶和抗体等,有营养组织、调节器官活动和防御有害物质的作用。虽然无机盐在细胞、人体中的含量很低,但是作用非常大。研究表明[1],维持钾离子通道的生存电压依赖于细胞内阴离子环境的性质。无机阴离子与维持体内酸碱度有关,同时无机阴离子是体内各种生化反应的代谢产物,与健康息息相关。乳酸是糖在无氧条件下进行酵解的产物,在血液中以乳酸根形式存在,参与到体内能量物质循环[2];甲酸是体内某些氨基酸代谢过程中产生的;溴离子是形成基底膜所必需的元素,在动物体内有着不可或缺的生理作用;磷是机体内骨矿物质、膜磷脂、核苷酸以及核酸的主要成分之一,参与到机体矿物质代谢、骨骼发育、能量储存、信号传导以及蛋白质功能调节等多种细胞活动过程中[3];硫是构成氨基酸的重要组成部分,它是构成细胞蛋白、组织液和各种辅酶的重要常量元素[4-5]。
血液样品中阴离子的含量测定方法多集中在乳酸根的含量测定,林红赛等[6]建立了离子色谱法测定血液透析液中乳酸根的含量测定方法,样品无需前处理,不受样品中其他组分的干扰。钟志雄等[7]采用干灰化法和LC-SCX(3 mL)柱净化处理样品,建立了海产品中氟、溴、碘与硫的电导-紫外串联检测离子色谱法分析。离子色谱(ion chromatography,IC)在阴离子分析检测方面极具优势,具有简单、快速、选择性强等特点,在环境、食品、化妆品、医药、生命科学等领域得到广泛的应用[8-9]。对于同时测定血液中乳酸根、甲酸根、溴离子、磷酸根、硫酸根5种离子的方法尚无相关报道,本文首次建立同时测定血液中乳酸根、甲酸根、溴离子、磷酸根、硫酸根5种无机阴离子的含量测定方法。
高血脂症是一种全身性疾病,主要危害是导致动脉粥样硬化,进而导致众多的相关疾病[10-11],学者多有研究微量元素与高脂血症的关系[12-15]。铜、铬和硒是高血脂症的危险因素。锌水平的降低可能会加剧机体脂质过氧化、促进肝细胞脂肪变性。已有的研究多集中在金属元素上,而硫元素、磷元素、溴元素等元素及小分子有机酸在高脂血症过程中的变化尚未有相关研究。本实验以高脂血症金黄地鼠为研究对象,建立同时测定血液中乳酸根、甲酸根、溴离子、磷酸根、硫酸根5种离子含量的离子色谱方法,为高脂血症等疾病发生过程中5种离子含量变化的研究提供方法支撑。
1 仪器和材料
1.1 仪器
日本日立7060 型全自动生化分析仪、DIONEX ICS-1000离子色谱仪(包括Chromeleon 7色谱工作站)、德国SIGMA 3K15离心机、KQ5200DV型数控超声波清洗器(昆山市超声仪器有限公司)、AL204万分之一电子天平(梅特勒-托利多上海有限公司)。
1.2 材料
碳酸钠(Sigma公司,纯度≥99.5%),碳酸氢钠(Sigma公司,纯度≥99.7%),血清总胆固醇(TC)、高密度脂蛋白-胆固醇(HDL-C)、低密度脂蛋白-胆固醇(LDL-C)、甘油三酯(TG)试剂盒(北京中生北控生物科技股份有限公司,批号分别为15081,150721,150531,150861),乳酸(西陇化工股份有限公司,批号:141212,纯度:99.0%),甲酸钠(天津市光复精细化工研究所,批号:20150310,纯度:99.5%),溴化钾(天津光复精细化工研究所,批号:20140418,纯度:99.0%),磷酸钠(天津市光复精细化工研究所,批号:20150608,纯度:99.0%),硫酸钠(天津市光复精细化工研究所,批号:20150610,纯度:99.0%),Dionex On GuardTMII RP小柱(美国Thermo,批号:170213-1-RP)。
1.3 动物与饲料
90~120 g金黄地鼠,生产许可证号:SCXY(京)2012-0001,70只,雄性,SPF级,购于北京华阜康生物科技股份有限公司。金黄地鼠高脂饲料(15% 猪油,0.2% 胆固醇,84.8%基础饲料)购自北京华阜康生物科技股份有限公司。
2 方法与结果
2.1 高脂血症金黄地鼠模型建立
2.1.1 饲养条件 金黄地鼠适应性喂养一周后按体重随机分为正常组、高脂血症模型组各3组。动物于SPF条件环境中饲养,温度(21±2)℃,相对湿度(50±5)%,光照周期:12/12 h,10只/笼,正常组给予基础饲料,高血脂模型组给予50%高脂饲料+50%基础饲料,动物自由摄食、饮水。
2.1.2 样品的采集 分别于造模前及造模第10天、20天、30天处理正常组和模型组各一组,乙醚麻醉后眼眶静脉丛取血两管,一管为促凝管,以离心分离血清,用于血脂四项的测定;另一管为肝素抗凝管,以离心得到血浆,用于血液中5种阴离子的含量测定。
2.1.3 生化指标的测定 取造模前及造模第10天、20天、30天正常组、模型组的血清样品,使用全自动生化分析仪采用试剂盒法测定TC、HDL-C、LDL-C、TG的值。表1结果表明建模20 d后,相比于正常组,模型组血清总胆固醇(CHO)、TG、低密度脂蛋白胆固醇(LDL)显著升高,金黄地鼠高脂模型建立;至第30天,模型组CHO、TG、LDL显著高于正常组,且基本稳定在一个较高的范围。
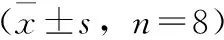
表1 金黄地鼠血清生化指标测定结果 mmol·L-1
注:与正常组比较,*P<0.05,**P<0.01,***P<0.001;下同。
2.2 离子色谱法的建立
2.2.1对照品溶液的制备 精密称取1.677 g十水硫酸钠于500 mL容量瓶中加水定容,配成10.2 mmol·L-1硫酸根标准储备液;精密称取2.000 g十二水磷酸钠于500 mL容量瓶中加水定容,配成10.5 mmol·L-1磷酸根标准储备液;精密称取1.345 g乳酸钠于500 mL容量瓶中加水定容,配成11.1 mmol·L-1乳酸根标准储备液;精密称取3.110甲酸钠于500 mL容量瓶中加水定容,配成22.7 mmol·L-1甲酸根标准储备液;精密称取1.700 g溴化钾于500 mL容量瓶中加水定容,配成12.5 mmol·L-1溴离子标准储备液。
2.2.2 样品溶液的制备 取2.1.2项下血浆样品,精确量取0.4 mL置于10 mL离心管中,加入1 mL乙腈沉淀蛋白质后加入8 mL去离子水,振荡,混匀,5 min后离心10 min(10 000 r·min-1),过活化好的RP小柱收集后流出的5 mL滤液,过0.22 μm滤膜,取续滤液1 mL。
2.2.3 色谱条件 IonPac AS23 离子交换柱(250 mm×4 mm)、IonPac AS23保护柱(50 mm×4 mm)、ASRS300-4mm抑制器,淋洗液浓度:4.5 mmol·L-1碳酸钠和0.8 mmol·L-1碳酸氢钠,流速:1 mL·min-1,进样时间:180 s;ASRS 4 mm阴离子抑制器,加电自动抑制,抑制温度:19 ℃,抑制电流:19 mA;电导检测器,检测池温度:36 ℃,柱温室温,进样量:25 μL。
2.2.4 专属性试验 取血浆样品,按照2.2.2项样品处理方法制备样品溶液,按照2.2.3项下色谱条件,样品溶液进样分析。
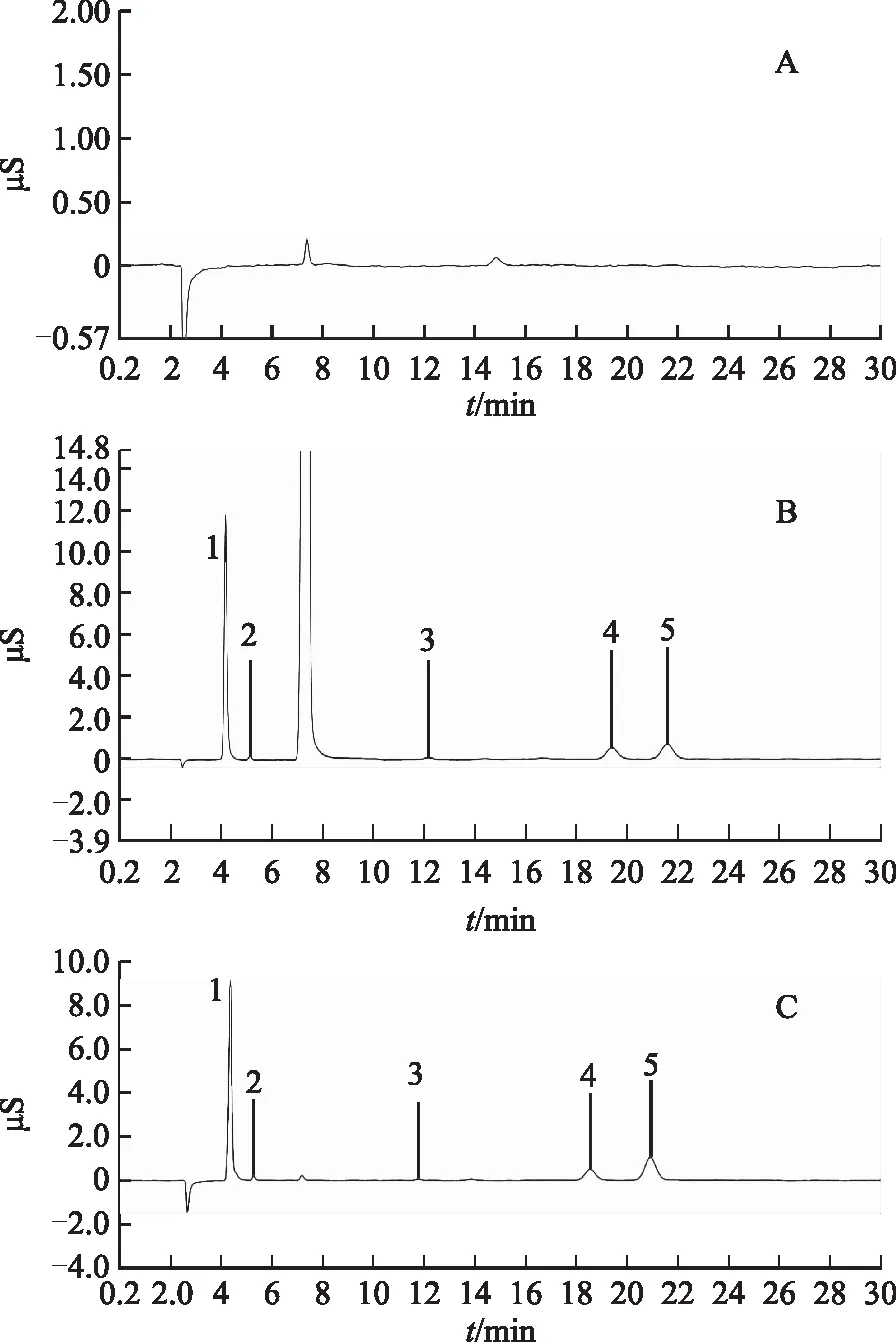
2.2.5 线性关系及最低检出限试验 精密称取32 mL乳酸根储备液、0.2 mL甲酸根储备液、0.2 mL溴离子储备液、4 mL磷酸根储备液、3 mL硫酸根储备液至100 mL容量瓶,加水定容至刻度,配制成乳酸根3.5 mmol·L-1、甲酸根0.045 mmol·L-1、溴离子0.025 mmol·L-1、磷酸根0.42 mmol·L-1、硫酸根0.30 mmol·L-1的混合对照品溶液,然后依次对半稀释,得到系列混合对照品溶液。
分别吸取乳酸根离子、甲酸根离子、溴离子、磷酸根、硫酸根系列混合对照溶液1 mL,注入离子色谱仪,按照上述色谱条件分离,测定。以峰面积为纵坐标,标准溶液的浓度为横坐标,绘制标准曲线。将混合对照品溶液依次稀释至不同浓度,按照2.2.3项的色谱条件分别检测。以信噪比3∶1作为检测限,计算乳酸根离子、甲酸根离子、溴离子、磷酸根、硫酸根的检出限。空白色谱图、样品色谱图、对照品色谱图见图1,线性关系及检测限见表2。
注:A.空白;B.样品;C.对照品;1.乳酸根;2.甲酸根;3.溴离子;4.磷酸根;5.硫酸根。图1 对照品及金黄地鼠血浆样品离子色谱图
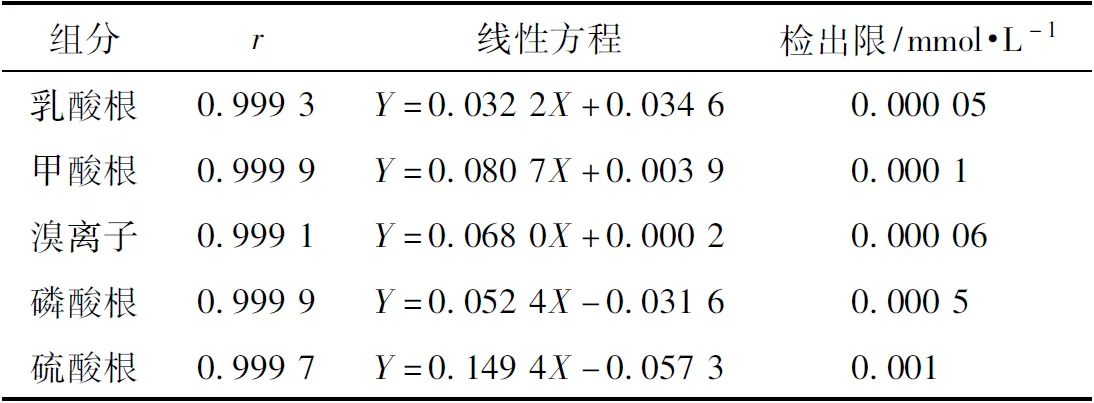
表2 金黄地鼠血浆中5种阴离子的线性方程
2.2.6 精密度试验 将乳酸根离子、甲酸根离子、溴离子、磷酸根、硫酸根混合对照品溶液连续进样6次,分别计算5种离子平均色谱峰面积的RSD为1.6%、2.7%、2.4%、2.2%、1.8%。
2.2.7 加样回收率试验 精密量取已知浓度的血浆样品 6 份,各0.2 mL,分别精密加入0.2 mL一定浓度的混合对照品,按2.2.2项下的方法制备供试品溶液,进样10 μL测定,通过对照品加入量和实际测定的含量计算其回收率,结果见表3。
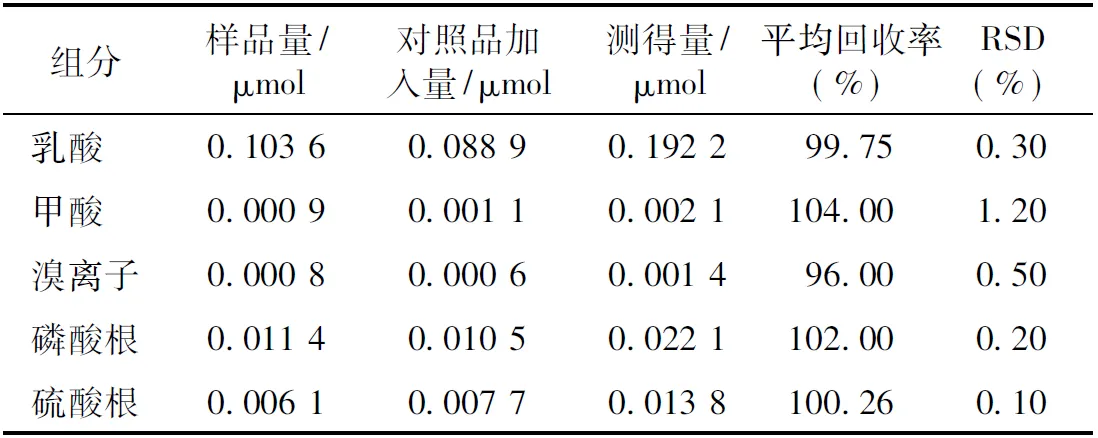
表3 金黄地鼠血浆中5种阴离子测定的回收率试验结果
2.2.8 稳定性试验 取一份血浆样品溶液,分别于0、2、4、8、12、24 h进行测定,记录乳酸根离子、甲酸根离子、溴离子、磷酸根、硫酸根的峰面积,计算RSD分别为0.2%、2.6%、1.4%、0.9%、0.2%。结果表明供试品溶液在24 h内基本稳定。
2.3 数据统计与分析
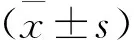
2.4 血液中5种阴离子浓度测定结果
表4结果显示,正常组30 d内血液中乳酸根浓度范围为15.24~15.95 mmol·L-1,模型组浓度范围为12.85~15.75 mmol·L-1,较正常组逐渐降低。建模第10天,模型组与正常组乳酸根浓度无统计学差异;建模第20天,模型组乳酸根浓度显著降低(P<0.05);建模第30 d,模型组乳酸根浓度更低,与正常组差异增大。甲酸根正常组30 d内浓度范围为0.06~0.11 mmol·L-1,模型组浓度范围为0.05~0.11 mmol·L-1。建模第10天,模型组浓度低于正常组(P<0.05);建模第20、30天,模型组与正常组无统计学差异。溴离子正常组30天内浓度范围为0.10~0.12 mmol·L-1,模型组浓度范围为0.10~0.12 mmol·L-1,建模第10、20、30天正常组和模型组浓度均无统计学差异。正常组30 d内磷酸根浓度范围为0.83~1.47 mmol·L-1,模型组浓度范围为0.87~1.47 mmol·L-1,建模第10天,模型组和正常组无统计学差异;建模第20天,模型组显著低于正常组(P<0.05);建模第30天,模型组浓度显著高于正常组(P<0.001)。硫酸根正常组30 d内浓度范围为0.79~1.05 mmol·L-1,模型组浓度范围为0.79~0.88 mmol·L-1,建模第10天,模型组与正常组无统计学差异;建模第20天,模型组与正常组无统计学差异;建模第30天,模型组显著低于正常组(P<0.05)。
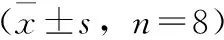
表4 金黄地鼠血液中5种阴离子浓度测定结果 mmol·L-1
3 讨论
研究高血脂可选择的模型动物有很多,其中金黄地鼠脂蛋白结构与人类相似,其肝脏内源性胆固醇合成比例约为 85%,相比其他实验动物与人类更为接近,是目前较为公认的模型动物,本实验用高脂饲料喂养金黄地鼠,造模20 d,即可得到较为稳定的高脂血症模型。测得高血脂症模型组相比于正常组,血脂4项中TC、TG、LDL逐渐升高,并维持在一个较高的水平,为血液中阴离子的含量测定提供了良好的基础。与杨康敏[16]分别对短、中、长期(4、21、42周)高脂血症模型组造模前和造模后第1~42周血脂水平进行动态连续监测的研究结论基本一致。
血液中乳酸根、甲酸根、磷酸根、硫酸根在高血脂症形成的过程中发生了一定的变化,血液中乳酸根、硫酸根含量较正常组逐渐降低,磷酸根含量较正常组逐渐升高。模型组与正常组血液中甲酸根离子含量变化无统计学差异。模型组和正常组血液中溴离子基本保持稳定,两组之间无统计学差异。正常组血液中乳酸根含量基本稳定,模型组逐渐降低,在建模20、30 d显著降低。Wang等[17]研究表明高脂血症模型大鼠与对照组相比较乳酸、柠檬酸等的水平显著降低,乳酸的减少表明葡萄糖代谢途径的改变,导致有氧代谢或脂质合成增强。乳酸的减少将使葡萄糖代谢途径转变为脂质合成。正常组血液磷酸根逐渐降低,孙成亮[18]研究表明,随着年龄的增加,血钙、血磷的浓度会出现下降的趋势,血磷在幼年时含量较高与幼年时成骨发育活动强有关。模型组较正常组逐渐升高,建模30 d后与正常组有统计学差异,较高血清磷酸根是增加心力衰竭发生率的独立危险因素[19],高脂血症发病时所引起的血液磷酸根水平上升,是心血管疾病的危险因素,增加了冠心病、心力衰竭的可能性。正常组血液硫酸根逐渐升高,硫酸盐在生长发育中有重要的作用,Qi等[20]发现制备高硫酸盐含量衍生物(HU),比绿藻(ulvan)有更高的抗高血脂活性,提示高硫酸盐具有促进脂质代谢的作用。本实验中模型组较正常组血液中硫酸根含量显著降低。甲酸根正常组变化波动较大,模型组血液中甲酸根在30 d显著高于正常组,关于血液中甲酸根含量变化与高脂血症的关系需要进一步研究。
血液样品因含有较多的大分子物质,一般需经过一系列的前处理,唐磊等[21]用乙腈沉淀血液中的蛋白质后依次过 C18柱、Ag柱和Na柱,用于去除其中的有机物和氯离子后进行离子色谱检测。Bowling等[22]使用Dionex ICS2000通过离子色谱法测量血浆和尿中硫酸盐,使用抑制电导检测。本研究在预试验过程中发现以2.2.3中色谱条件进样,氯离子在7.4 min出峰,与其他待测峰不存在干扰,所测5种离子得到良好分离,因此确定前处理方法为高血脂症金黄地鼠血样经乙腈沉淀蛋白,过Dionex On GuardⅡRP柱,过0.22 μm微孔滤膜后取续滤液进样,相比常规方法省去了过Ag柱和Na柱的处理,节省了成本。本文建立了同时测定血液中5种离子含量的方法,5种阴离子达到基线分离,线性关系良好,r为0.999 1~0.999 9,加样回收率和仪器精密度(RSD<3.0%)等良好。方法简便、快速、灵敏度高,可以用于高脂血症血液中5种阴离子的含量测定。
本文初步研究了高脂血症等疾病发生过程中乳酸根、甲酸根、溴离子、磷酸根、硫酸根含量变化,高脂血症发病过程中,血液中乳酸根含量不断下降,磷酸根含量偏高,硫酸根含量降低,溴离子、甲酸根变化不大。建立的离子色谱法可为高脂血症等疾病发生过程中乳酸根、甲酸根、溴离子、磷酸根、硫酸根含量变化的研究提供方法支撑。
[1] Adams D J,Oxford G S.Interaction of Internal Anions with Potassium Channels of the Squid Giant Axon[J].J Gen Physiol,1983,82(4):429-448.
[2] 王镜岩.生物化学[M].北京:高等教育出版社,2002:4-16.
[3] 王梦婧.磷代谢与慢性肾脏病[J].医学继续教育,2011,20(6):548-552.
[4] 吴茂江.硫与人体健康[J].微量元素与健康研究,2011,28(2):67-68.
[5] 汪子铮.常用跌打损伤中药中硫元素的含量测定与研究[D].太原:山西大学,2012.
[6] 林红赛,黄永富,岳卫华,等.离子色谱法测定血液透析液中乳酸根的含量[J].北京生物医学工程,2015,34(5):515-516.
[7] 钟志雄,李攻科.海产品中氟、溴、碘与硫的电导-紫外串联检测离子色谱法分析[J].分析测试学报,2009,28(5):572.
[8] 周伟娥,杨立佼,谢巍,等.离子色谱法同时测定感冒清热颗粒中9种无机阴离子[J].中国药房,2015,26(18):2546-2549.
[9] 杜涛,王莹,高超,等.离子色谱法测定饮用水中无机阴离子[J].沈阳师范大学学报(自然科学版),2011,29(2):260-263.
[10] Chen J X,Zhao H H,Ma X L,et al.The effects of jiang-zhi-ning and its main components on cholesterol metabolism[J].eCAM,2012,928234.
[11] 叶振南,李楠,盛丹丹,等.青钱柳多糖对高脂血症大鼠血脂及抗脂质过氧化作用的影响[J].现代食品科技,2014,30(4):1-5,20.
[12] 龚帅昌,杨大刚.锌、镁、钙水平与血脂代谢的研究进展[J].实用中西医结合临床,2014,14(12):92-94.
[13] 刘佳佳,孙琳,张红颖,等.基于 ICP-MS 法筛选高脂血症患者与健康人血浆中差异金属元素[J].沈阳药科大学学报,2017,34(4):303-306.
[14] Jenner A,Ren M,Rajendran R,et al.Zinc supplementation inhibits lipid peroxidation and the development of atherosclerosis in rabbits fed a high cholesterol diet[J].Free Radic Biol Med,2007,42(4):559-566.
[15] 杨朝菊.糖脂代谢异常人群血清微量元素和脂肪因子的测定及临床意义[D].石家庄:河北医科大学,2015.
[16] 杨康敏.熟利亚金黄地鼠高脂血症和动脉粥样硬化模型快速建立及药效学评价关键技术研究[D].北京:北京协和医学院,2013.
[17] Wang M,Wang F,Wang Y N.Metabonomics study of the therapeutic mechanism of gynostemma pentaphyllum and atorvastatin for hyperlipidemia in Rats[J].PLoS One,2013,8(11):e78731.
[18] 孙成亮.四川部分地区藏獒血液生化指标分析和进食对血糖、血钙、血磷及相关调控激素的影响[D].雅安:四川农业大学,2016.
[19] 陈楚,陆齐,黄荫浩,等.血清磷酸根水平与HFp/mrEF伴房颤患者的关系及其对预后评价的意义[J].南京医科大学学报(自然科学版),2017,37(10):1296-1272.
[20] Qi H M,Sheng J W.The antihyperlipidemic mechanism of high sulfate content ulvan in rats[J].Mar Drugs,2015,13(6):3407-3421.
[21] 唐磊,应剑波,高珊,等.离子色谱法检测全血中的亚硝酸盐及其代谢产物[J].中国法医学杂志,2014,29(5):464-465.
[22] Bowling F G,Heussler H S,McWhinney A,et al.Plasma and urinary sulfate determination in a cohort with autism[J].Biochem Genet,2013,51(1/2):147-153.
