基因编码钙指示剂在药物反应性细胞核钙信号实时动态检测中的应用
2018-06-23龚明涛张晨光
龚明涛 张晨光,2 丁 卫,2*
(1. 首都医科大学基础医学院生物化学与分子生物学系,北京 100069; 2.肿瘤侵袭和转移机制研究北京市重点实验室,首都医科大学肿瘤研究所, 北京 100069)
钙离子是真核细胞内最为重要的第二信使物质之一,参与调控多种细胞活动,如细胞的增生、分化、生长、凋亡以及基因转录和兴奋性生理表型[1]。在神经元等可兴奋细胞中,细胞对核内钙离子浓度的变化十分敏感;并且细胞核钙浓度的异常,与多种人类疾病,特别是神经系统疾病的关系密切。有研究[2-3]表明,在阿尔茨海默病、亨廷顿舞蹈症以及帕金森病的发生和进展中均伴随着细胞核钙离子浓度在不同程度上的异常变化。近年来的研究[4]还陆续显示,细胞核钙离子还参与了对多种基因的表达调控过程,其中包括Atf3、Btg2、GADD45β、GADD45γ等一些重要的转录活化调控因子。
在活细胞水平对钙离子的功能研究中,钙指示剂是必不可少的工具。传统用于检测细胞质中钙离子浓度的化学指示剂有Fura2和Fluo3等[5-6]。随着基因工程技术的发展,新型的钙离子指示剂——基因编码钙指示剂(genetically-encoded calcium indicators, GeCI)得到日益广泛的应用,并且以其出色的表现和独特的功能和优点受到研究者的青睐[7]。GeCI可以实现在体实验中对钙离子的长时程检测和实时动态监测,并且还可以借助细胞器的特异性定位信号表征某些特定的亚细胞结构的钙离子变化情况[7]。近几年来对GeCI的不断改进部分弥补了其相对于化学合成钙指示剂灵敏度偏低的不足。Chen等[8]所研发的GCaMP6属于较新一代GeCI中的一种,其检测灵敏度有很大提升,并且在细胞内的表达更加稳定。Qi等[9]将核质蛋白(nucleoplasmin)的核定位序列(nuclear localization signal, NLS)以及一种红色荧光蛋白(tdTomato)与GCaMP6s进行融合,构建出nuGCaMP6s-tdTomato重组质粒。经过细胞转染后,tdTomato作为非钙离子敏感的表达荧光基团,可作为校准的转染效率和荧光漂白作用的内参分子。
在本研究中,笔者将重组质粒转染到U87MG细胞和非兴奋细胞HeLa细胞中,在青蒿素、过氧化氢以及Paxilline等药物的作用下,核钙离子均有明显的增多。但不同的药物作用以及在不同的细胞之间,其核钙的变化情况有很大的区别。在肿瘤细胞中,异质性是其一个重要的标志,肿瘤细胞的异质性与肿瘤的耐药性有着至关重要的关系[10]。并且已有研究[10]表明细胞内氧自由基(reductive oxidative species,ROS)水平的增高,对肿瘤细胞的异质性有很大的影响。在低浓度ROS情况下,ROS可能作为促进肿瘤异质性发生的重要信号分子[10]。深入研究肿瘤细胞的异质性,有助于分析和了解肿瘤产生的机制、演化规律,解释肿瘤治疗过程中出现不同适应性表型的原因。
1 材料与方法
1.1 实验材料
1.1.1 质粒和细胞
重组质粒nuGCaMP6s-tdTomato由首都医科大学医学遗传与发育生物学系叶海虹教授馈赠。分子克隆的载体为pcDNA3.1真核细胞基因过表达质粒。HeLa人宫颈癌细胞和U87MG人恶性胶质母细胞瘤细胞均购自中国医学科学院基础医学研究所。
1.1.2 主要试剂和药物
新生牛血清购自美国Hyclone公司;DMEM培养基购自美国Corning公司;蕈青霉素(Paxilline)购自英国Tocris生物科学公司;转染试剂Lipofectamine 2000购自美国Thermo Fisher Scientific公司。
1.2 实验方法
1.2.1 细胞培养和转染
HeLa细胞和U87MG细胞置于含10%(体积分数)新生牛血清(fetal bovine serum, FBS)、1×105U/L青霉素、1×105U/L链霉素的DMEM培养基。在37 ℃、5%(体积分数) CO2培养箱中培养,隔天给细胞更换新鲜DMEM完全培养基。HeLa细胞48 h传代一次,U87MG细胞48~72 h传代一次。
细胞生长到对数生长期时,将1.5×105个HeLa细胞或2.5×105个U87MG细胞铺板于35 mm共聚焦显微镜专用培养皿中。铺板18 h后的细胞换无FBS的DMEM培养基。将重组质粒nuGCaMP6s-tdTomato与Lipofectamine 2000TM和DMEM培养基混合,静置20 min,加入到换液后的细胞中,6 h之后给细胞换新鲜DMEM完全培养基。
1.2.2 转盘荧光共聚焦钙成像
将转染重组质粒nuGCaMP6s-tdTomato 24 h后的细胞,置于转盘共聚焦显微镜(UltraVIEW VoX)下每间隔约25 s进行实时荧光图像采集。在成像过程中完成基线数据记录后,加入青蒿素(ART,100 ng/mL)等药物刺激细胞,分别记录核钙成像信号和内参荧光信号(激发波长分别为488 nm与560 nm,检测波长区间相应为490~550 nm与590~700 nm)。
1.2.3 荧光共聚焦钙成像
HeLa细胞生长到对数生长期时,将细胞铺板于放置有玻片的24孔板上。铺板18 h后,细胞换无FBS的DMEM培养基,进行nuGCaMP6s-tdTomato质粒转染。转染24 h之后,向细胞中加入Hoechst进行细胞核染色,20 min后弃去Hoechst染液,PBS清洗3次,每次5 min。将玻片置于加有封片剂的载玻片上固定。室温静置1 h后将玻片置于STED超高分辨率共聚焦显微镜(TCS SP8 STED)下观察[激发波长分别为488 nm与561 nm,检测发射波长为(520±30)nm与(650±35)nm]。
1.2.4 数据分析
共聚焦钙成像图像使用Image J分析灰度值,再通过绿色荧光(GCaMP6s)与红色荧光(tdTomato)的比值,绘制统计图像。细胞核钙的动态曲线通过自定制的EXCEL程序及其界面完成。将Image J取得的荧光灰度值置于Cluster V3.0软件后,采用“complete linkage”选项的缺省参数进行聚类分析。根据聚类分析结果进行的细胞分类和统计过程采用K-mean算法由计算机程序自动完成。将所得的输出文件导入JavaTreeView软件中,根据可视化的显示结果进行后续的细胞分组和异质性比较分析。
2 结果
2.1 重组质粒Nu-GCaMP6s-tdTomato转染后荧光观察
脂质体介导重组质粒nuGCaMP6s-tdTomato(图1A)转染到HeLa细胞中24 h之后,将4%(质量分数)多聚甲醛固定的细胞样本玻片置于STED超高分辨率共聚焦显微镜下进行扫描成像(图1B)。可见红色荧光蛋白tdTomato在转染细胞中表达并且特异定位在细胞核区域,与Hoechst染料复染的细胞核完全共定位;而GCaMP6s的荧光信号在未经刺激的细胞很弱,甚至低于可检测水平,表明在正常培养条件下细胞核内的钙离子浓度处于较低水平。将转染重组质粒24 h后的未固定活细胞置于荧光共聚焦显微镜下进行观察(图1C),在向共聚焦培养皿中加入Paxilline(10 μmol/L)后,可见HeLa细胞核内的GCaMP6s荧光信号显著增强,且浓度随着药物作用时间的延长持续增加,而tdTomato的红色荧光强度除激光漂白作用略有下降基本保持稳定。将GCaMP6s荧光强度与tdTomato荧光强度在去除基线本底信号后计算比值可用于细胞核钙离子浓度的相对定量指示(图1D)。

图1 细胞核定位的GCaMP6s荧光信号经tdTomato标准化后用于核钙水平的定量分析Fig.1 Fluorescence signal of nuclei-localized GCaMP6s used for quantitative analysis ofnuclear calcium level after normalization with tdTomato
A: plasmid map of nuGCaMP6s-tdTomato;B: confocal imaging of HeLa cells after nuGCaMP6s-tdTomato transfection;C: real-time fluorescence imaging of HeLa cells with Paxilline treatment after nuGCaMP6s-tdTomato transfection;D: quantitative analyse of fluorescence intensity ratio between GCaMP6s and tdTomato in the same cell;NLS:nuclear localization sequence.
2.2 细胞内在遗传背景及外在环境刺激因素对核钙信号的影响
在进一步的研究中,笔者首先利用Paxilline给药作为细胞核钙信号的刺激条件,将重组GeCI质粒分别转染到HeLa细胞和U87MG细胞,以前述的规一化的绿色/红色荧光强度比值为测量参数,观察和比较了两种细胞的反应性动态核钙信号变化(图2A、B)。结果显示,在HeLa和U87MG细胞中均可检测到在40 min记录时程中细胞核钙浓度的进行性增加,且增加的幅度相对比较接近,以HeLa细胞中的数值略高。然而,在两种细胞中,核钙增加的动力学模式则存在显著的差别。在HeLa细胞组中,快速增加的时相从700 s起开始出现,呈渐进性;而在U87MG细胞中,核钙的迅速增加从150 s左右已经开始,并且较快达到平台峰值。表明细胞内在环境,即主要由遗传背景所决定基因表达核稳态差异,能够显著影响细胞核钙水平对外界刺激的反应性。
此外,为了探索一些具有生物活性的化合物是否能够引起类似Paxilline的核钙刺激反应,笔者在经过nuGCaMP6s-tdTomato转染的HeLa细胞培养中,即时加入不同的药物并观测活细胞核钙水平的动态变化。研究ART同样能够导致细胞核钙的持续增加(图2C)。在HeLa细胞中与Paxilline的作用有类似之处,存在约600 s的缓慢上升的滞后时段;但是增加的幅度较小,约为1/4左右。ART引起的核钙变化与H2O2的作用明显不同,其核钙的反应性增加更为强烈且持续;而同时通过图中所显示较大的数据标准误,可潜在提示出细胞对H2O2的刺激反应存在一定的异质性(图2D)。为排除加药或记录等操作过程对细胞刺激所引起细胞核钙变化的可能性,笔者使用了多种药物的溶剂DMSO作为实验对照,发现其对于细胞核钙离子没有明显的影响(图2E)。

图2 细胞内在遗传背景及外在环境刺激因素对核钙信号的影响Fig.2 Effect of genetic background and external environmental stimuli on nuclear calcium signal
A: real time nuclear calcium signal profiles of HeLa cells treated with Paxilline(50 μmol/mL);B: real time nuclear calcium signal profiles of U87MG cell treated with Paxilline;C-E: real time nuclear calcium signal profiles of HeLa cell treated with ART(artemisinin) (100 μg/mL), H2O2(100 μmol/mL) and 10% DMSO.
2.3 U87MG细胞中核钙水平的变化可反映对外界刺激应激反应表现的异质性
为进一步观察细胞在受到应激刺激后是否具有异质性的反应,笔者在GeCI质粒转染的U87MG细胞给予Paxilline核钙激动之前,先期将其短期暴露于H2O2(100 μmol/L)中。在利用Image J软件分析绿色红色荧光灰度值并计算荧光比值的动态变化之后,将获得的数据依次导入至Cluster V3.0和JavaTreeView软件,进行U87MG细胞异质性表现的聚类统计。在图3中可见,受到H2O2应激刺激后,U87MG细胞的表现大致被分为3类。可见大部分(68.2%)细胞的核钙曲线与图2中未经H2O2处理的情况较为类似,但核钙离子的增加在初始时更为迅速。另分别有约13%和18%的细胞则表现出显著不同特征,前者在后期出现钙信号的变异较大,呈持续上升,后者在一过性的峰值过后,钙离子浓度恢复至稳定的较低水平。
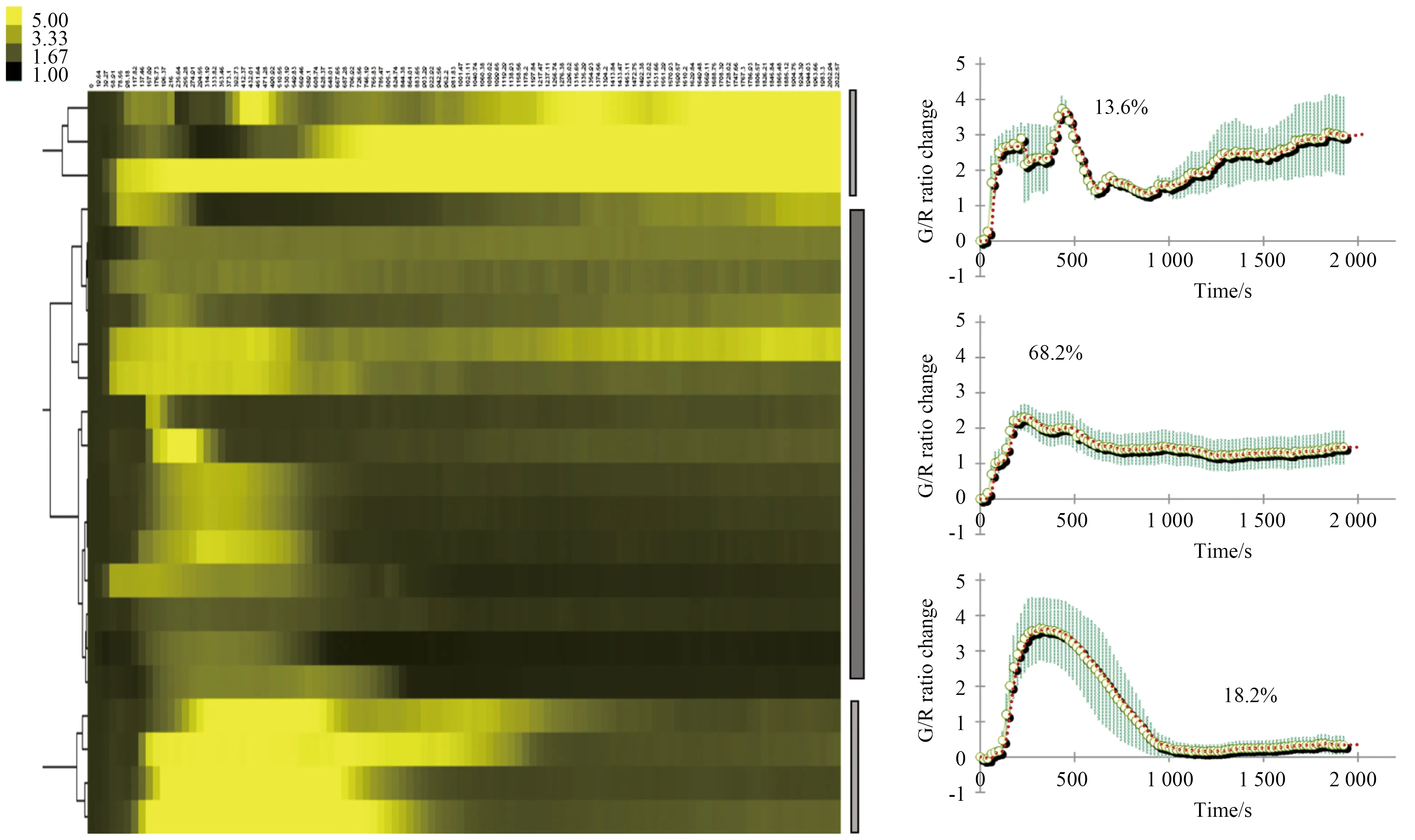
图3 过氧化氢处理引发U87MG细胞Paxilline反应性核钙变化的异质性表现Fig.3 Heterogeneity of nuclear calcium alteration in U87MG cells with sequential treatment of H2O2 and Paxilline
U87MG cells were first transfected with nuGCaMP6s-tdTomato, and 24 h later, were treated with H2O2(100 μmol/mL) for 5 minutes, followed with Paxilline(50 μmol/mL) stimulation. The dynamics of the nuclear calcium alteration were recorded.
3 讨论
在兴奋细胞的研究中,钙离子及其多样性的生物学研究一直受到较多的重视。近些年来,细胞核钙浓度的变化逐渐引起人们的关注,并且已被证实与诸多的基因表达调控关系密切[11],但是就总体而言,关于核钙功能的研究仍然很不充分,而在非兴奋性细胞研究中更为缺少[12]。传统用于钙离子研究的指示剂通常属于化学合成的指示剂,如Fura2、Fluo3等,但是这些指示剂并不能满足细胞核钙研究的要求,在使用中常常受到许多胞质因素的干扰[11]。新型GeCI在许多领域的研究中优势显著,特别是以GCaMP6为基础的改进型分子。GCaMP6分为GCaMP6f和GCaMP6s两种,相较于GCaMP6f,GCaMP6s药代动力学缓慢,在细胞内可以长时间存在,更加耐受荧光的激发漂白作用。本课题中为适应非兴奋性细胞模型所使用的GCaMP6s指示剂,不仅检测灵敏,而且由于NLS的存在,可以直接将指示剂定位到细胞核,基本上排除了胞质钙离子等因素的干扰。再通过绿色荧光(GCaMP6s)和红色荧光(tdTomato)的灰度比值,可以更准确和迅速地检测细胞核内钙离子的变化情况。
在本研究中,笔者构建了可用于细胞核钙水平动态分析的钙指示剂载体,并且建立和完善了相应的定量指标与技术流程。应用此方法不仅可以比较不同遗传背景细胞系之间的核钙调控差异性,而且可以快速简便地筛选各种可引起细胞核钙浓度改变的天然及合成化合物。据文献[13-14]报道,青蒿素具有抗炎、抗癌以及改变细胞内包括酸碱度和其他多种代谢物丰度的生物学活性,参与其作用机制的信号途径之一是PI3K相关的细胞钙离子第二信使介导的转录激活效应。尽管ART能否直接引起细胞核钙浓度的变化此前尚无报道,但鉴于细胞核钙与细胞质钙离子的水平变化往往呈现出一定的关联性,本研究所发现的ART刺激后的核钙离子浓度增加现象也并非完全意外的结果[15]。此外,本研究的结果还表明,核钙对外界刺激的反应性的分析可以用于揭示细胞生命过程中存在的功能异质性。肿瘤细胞的异质性是恶性肿瘤的特征之一,细胞异质性的研究也是肿瘤研究中的一个重要领域[16]。在肿瘤生长过程中,经过多次分裂增生,细胞异质性可能在遗传、环境和细胞内过程等许多层面参与肿瘤细胞表型的决定[17],而对肿瘤细胞异质性的研究在癌细胞的扩散转移机制研究、以及肿瘤的治疗和预后方面有着重要的意义[16,18-19]。通过比较不同的细胞在相同药物刺激下或某种细胞在不同的药物刺激下核钙离子变化的情况,可以作为细胞行为或细胞改变的最初功能性检测指标;同时细胞在接受刺激后核钙变化的异质性表现也可能成为细胞分类或分选的依据,这一不依赖于基因检测的策略具有与其他组学分析方法所不同的快速、及时和动态特点,并且具有和组学研究互补结合的可能性,在实际应用中将会展示极大的潜力。例如,通过此方法进行大量药物的筛选,可以帮助归类药物的适宜靶向细胞类型,提示药物间作用机制的共性与差异,或者优化药物作用剂量、组合或溶剂/剂型等。
关于细胞核钙离子的来源问题,在神经元中被认为是从细胞双层核膜中释放进入胞核[20]。由于细胞核膜与内质网存在连通,因而可能更多受到内质网钙浓度变化的影响。当细胞外钙离子进入细胞时[21],也有可能部分进入到细胞核,但其快速和脉冲式的动力学表现似乎与本研究中所见的核钙缓慢且持续性的增加不甚一致。当然是否也存在内质网钙释放到胞质后,再进入到细胞核的情况,需要在一些特定的实验模型中进行后续的探讨。关于细胞核钙的变化与细胞核膜以及内质网钙离子的关系,在本研究所发现和描述的现象中得到实验结果的支持,这也进一步提示了细胞在应激状态下,特别是内质网应激出现时,细胞核钙水平的改变对细胞基因表达的调控以及细胞稳态的维持可能具有重要的生理和病理意义。
尽管越来越多的研究[22]开始涉及核钙离子对细胞的影响,但是关于核钙离子生物学意义和作用机制的一些关键问题尚未解决。在神经细胞中,已有研究[23-25]表明钙离子受到一些激酶和膜通道分子的调控,可以通过核孔复合物(nuclear pore complex, NPC)进入到细胞核。在非可兴奋细胞中,核内钙离子是否存在不同的调控机制或影响因素,并且如何影响甚至改变细胞的非兴奋性表型,此类重要的科学问题的解决需要对细胞核钙离子进行动态和细致的描述,本研究恰恰为此提供了帮助。但是本研究尚未能够对细胞核钙的动态曲线和描述参数提供确切的生物学意义诠释,这是需要在今后的研究和应用中力图解决的迫切问题。
此外,本研究所用的技术方法在今后的实验室应用中还存在持续获得优化和改良的空间,具体的改进可包括如下方面:1)延长观测时程,如果能够达到6 h以上则可以随着部分基因转录和编码蛋白表达的完成,得到更加丰富和具有提示意义的信息;2)考虑在提高系统稳定性的基础上,尝试药物或刺激因素的组合,如此可使得本方法具有多种电生理实验的特征,通过特异性激动剂或阻断剂的联合或组合使用,进行相关因素的解析或因果关系的研判;3)增加分析能力和通量,本研究具备单细胞分析的特征,可以与多种高内涵或微流控分析设备的软硬件系统结合使用,同时所记录的数据也能够自然形成大数据分析中的一个特殊层面,成为与形态学和组学分析相互补的直接功能性指标。4)追踪和保持与新型载体和荧光指示剂在实验室应用中的及时更新,包括病毒载体和与在体实验荧光检测装备结合应用的可能性,同时随着更敏感的GeCI的研发和使用,本研究所创建的技术方法在核钙信号研究中的推广和应用将能够取得更加令人瞩目的结果和发现。
致谢:感谢首都医科大学中医药学院仇峰博士提供本研究所使用的研究级青蒿素试剂。
[1] Clapham D E. Calcium signaling[J]. Cell,2007,131(6):1047-1058.
[2] Reddy K, Cusack C L, Nnah I C, et al. Dysregulation of nutrient sensing and CLEARance in presenilin deficiency[J]. Cell Rep,2016,14(9):2166-2179.
[3] Pchitskaya E, Popugaeva E, Bezprozvanny I. Calcium signaling and molecular mechanisms underlying neurodegenerative diseases[J]. Cell Calcium,2017,70:87-94.
[4] Zhang S J, Zou M, Lu L, et al. Nuclear calcium signaling controls expression of a large gene pool: identification of a gene program for acquired neuroprotection induced by synaptic activity[J]. PLoS Genet,2009,5(8):e1000604.
[5] Al Mamun Bhuyan A, Nussle S, Cao H, et al. Simvastatin, a novel stimulator of eryptosis, the suicidal erythrocyte death[J]. Cell Physiol Biochem,2017,43(2):492-506.
[6] Rabenstein M, Peter F, Joost S, et al. Decreased calcium flux in Niemann-Pick type C1 patient-specific iPSC-derived neurons due to higher amount of calcium-impermeable AMPA receptors[J]. Mol Cell Neurosci,2017,83:27-36.
[7] Rose T, Goltstein P M, Portugues R, et al. Putting a finishing touch on GECIs[J]. Front Mol Neurosci,2014,7:88.
[8] Chen T W, Wardill T J, Sun Y, et al. Ultrasensitive fluorescent proteins for imaging neuronal activity[J]. Nature,2013,499(7458):295-300.
[9] Qi T, Yang H Q, Fan X X, et al. Engineering of GCaMP6-based calcium indicators for nuclear calcium imaging[J]. Chin J Bio Molecul Biol,2015,31(6):592-598.
[10] de Sa Junior P L, Camara D, Porcacchia A S, et al. The roles of ROS in cancer heterogeneity and therapy[J]. Oxid Med Cell Longev,2017,2017:2467940.
[11] Bengtson C P, Bading H. Nuclear calcium signaling[J]. Adv Exp Med Biol,2012,970:377-405.
[12] Bading H. Nuclear calcium signalling in the regulation of brain function[J]. Nat Rev Neurosci,2013,14(9):593-608.
[13] Wei T, Liu J. Anti-angiogenic properties of artemisinin derivatives (Review)[J]. Int J Mol Med,2017,40(4):972-978.
[14] Mbengue A, Bhattacharjee S, Pandharkar T, et al. A molecular mechanism of artemisinin resistance in Plasmodium falciparum malaria[J]. Nature,2015,520(7549):683-687.
[15] Qiao G, Li S, Yang B, et al. Inhibitory effects of artemisinin on voltage-gated ion channels in intact nodose ganglion neurones of adult rats[J]. Basic Clin Pharmacol Toxicol,2007,100(4):217-224.
[16] Koren S, Bentires-Alj M. Breast tumor heterogeneity: source of fitness, hurdle for therapy[J]. Mol Cell,2015,60(4):537-546.
[17] Meacham C E, Morrison S J. Tumour heterogeneity and cancer cell plasticity[J]. Nature,2013,501(7467):328-337.
[18] 徐晨,王玉,李昕頔,等.外周血miR-378表达对肿瘤诊断价值系统评价[J].中华肿瘤防治杂志,2015,22(10):809-813,818.
[19] 张蒙,吴松,蔡志明.肾细胞癌异质性与个性化医疗现状[J].中华肿瘤防治杂志,2015,22(15):1249-1252.
[20] Bootman M D, Fearnley C, Smyrnias I, et al. An update on nuclear calcium signalling[J]. J Cell Sci,2009,122(Pt 14):2337-2350.
[21] Purali N. Fast calcium transients translate the distribution and conduction of neural activity in different regions of a single sensory neuron[J]. Invert Neurosci,2017,17(3):7.
[22] Zhang S J, Zou M, Lu L, et al. Nudear Calcium signaling controls expression of a large gene pool: identification of a gene program for acquired neuroprotection induced by synaptic activity[J]. PLoS Genet, 2009,5(8): e1000604.
[23] Eder A, Bading H. Calcium signals can freely cross the nuclear envelope in hippocampal neurons: somatic calcium increases generate nuclear calcium transients[J]. BMC Neurosci,2007,8:57.
[24] Allbritton N L, Oancea E, Kuhn M A, et al. Source of nuclear calcium signals[J]. Proc Natl Acad Sci U S A,1994,91(26):12458-12462.
[25] Brini M, Marsault R, Bastianutto C, et al. Nuclear targeting of aequorin. A new approach for measuring nuclear Ca2+concentration in intact cells[J]. Cell Calcium,1994,16(4):259-268.
