膀胱平滑肌细胞乙酰胆碱M3受体干扰RNA慢病毒载体的构建
2018-06-23尚振华贾春松王巨昆欧彤文
尚振华 贾春松 颜 灏 王巨昆 王 旭 崔 波 王 琦 欧彤文
(首都医科大学宣武医院泌尿外科,北京 100053)
膀胱平滑肌的副交感神经调控主要通过神经递质乙酰胆碱作用于膀胱平滑肌细胞(bladder smooth muscle cells,BSMCs)的乙酰胆碱受体发挥作用。乙酰胆碱M型受体分为5型而BSMCs主要表达M2和M3型[1]。虽然M2受体在数量上明显多于M3受体,但是M2受体通过抑制交感神经β受体介导的膀胱舒张功能而间接发挥收缩膀胱的作用[2-3],而M3受体直接介导膀胱的收缩功能[4-7]。小干扰RNA(small interference RNA,siRNA)通常含有21~25个核苷酸,它通过与Dicer 酶等复合物的一系列生物化学酶学反应降解同源序列mRNA[8]从而发挥抑制基因的翻译、下调目的基因表达的作用。目前广泛应用的siRNA慢病毒载体是以人类免疫缺陷1型病毒(human immunodeficiency virus-1, HIV-1)为基础构建的,siRNA慢病毒载体与具有病毒包装辅助功能的质粒共同转染293T 细胞后可以获得靶基因的siRNA慢病毒。慢病毒携带siRNA可以稳定、高效、持续地干扰靶细胞目的基因的翻译过程从而达到下调目的蛋白表达的目的。由于M3受体在膀胱平滑肌收缩中起主要作用,因此,选择M3受体作为干扰靶点。
本研究拟通过体外原代培养BSMCs,构建M3受体siRNA慢病毒载体,研究siRNA干扰M3受体表达的效果,为下一步探索M3受体基因干扰抑制神经源性膀胱患者膀胱过度活动和纤维化的可能性奠定基础。
1 材料与方法
1.1 材料
雌性Wistar大鼠(220~250 g),实验动物使用许可证号:SYXK(京)2017-0033,北京维通利华实验技术有限公司提供,饲养于首都医科大学宣武医院动物中心SPF级动物房。293T细胞,pHelper 1.0、pHelper 2.0质粒及重组载体GV118购自上海吉凯基因化学技术有限公司。Lipofectamine 2000转染系统购自美国Invitrogen公司。DMEM培养基、胎牛血清、胰酶、Ⅳ型胶原酶和青霉素、链霉素购自美国Gibco公司。
1.2 方法
1.2.1 体外原代培养大鼠BSMCs
脱颈法处死Wistar大鼠,75%(体积分数)乙醇浸泡5 min,下腹正中切口从膀胱颈部切下膀胱,超净台内用100 U/mL庆大霉素浸泡5 min,再在PBS溶液中将黏膜层、黏膜下层和浆膜层除去。将肌层尽可能剪碎后置于0.25%(质量分数)胰酶中37 ℃震荡消化30 min,1 000 r/min离心5 min,将沉淀置于0.1%(质量分数)Ⅳ型胶原酶中37 ℃震荡消化30 min。100 目细胞筛过滤后1 000 r/min离心5 min,用含15%(体积分数)胎牛血清、100 U/mL青霉素和链霉素的DMEM培养基重悬沉淀的细胞,将细胞移入25 mL培养瓶并置于5%(体积分数)CO2、37 ℃饱和湿度的孵育箱中进行培养,培养液每2 d更换一次。BSMCs增生达到约80%融合时按1∶4的比例进行传代。
1.2.2 GV118-sh-M3载体构建及病毒制备
设计4条siRNA干扰靶点如下。M3target 1: GGAAAGAAGGAGAGGCATA;M3target 2:GCAACAGCAAGGCGTGAAA;M3target 3:GGCAATACTTTGTAGGGAA;M3target 4: ACAAACAGCTGAAGACAGT并合成下列寡核苷酸链,详见表1。

表1 siRNA干扰序列Tab.1 siRNA sequence
引物溶于缓冲液中90 ℃水浴15 min,冷却退火配对产生双链。阴性对照(negative control,NC)慢病毒载体的序列为:5′-TTCTCCGAACGTGTCACGT-3′。限制性核酸内切酶双酶切慢病毒载体GV118后与退火产物连接,将连接产物转入DH5α感受态细胞,氨苄西林筛选阳性克隆并测序验证。测序验证后分别命名为GV118-sh-M3-1(KD1)、GV118-sh-M3-2(KD2)、GV118-sh-M3-3(KD3)、GV118-sh-M3-4(KD4)和NC-sh-M3(NC)。利用Lipofectamine 2000将pHelper 1.0、pHelper 2.0及4种GV118-sh-M3和NC-sh-M3载体分别共转染处于对数生长期的293T细胞,培养8 h后弃掉培养基,PBS洗涤后加入培养基25 mL,培养箱内继续培养48 h。收集293T细胞上清液在4 ℃离心机4 000 g离心10 min。0.45 μm滤器过滤上清后将病毒提取液移入过滤杯中,4 000 g离心10 min,再将过滤杯倒扣在收集杯上800 g离心2 min,收集杯中即为病毒浓缩液。
1.2.3 荧光法测定滴度
将293T细胞种于96孔板,每个孔细胞数为4×104个,体积为100 μL。准备8个无菌EP管,每个管加入90 μL无血清培养基。将病毒液10 μL加到第1个管,混匀后取10 μL加到第2个管,继续相同操作直到最后一个EP管。选取细胞孔,将90 μL培养基弃掉加入90 μL EP管中稀释的病毒溶液,放入培养箱中培养。24 h后加入完全培养基100 μL,4 d后观察荧光蛋白表达情况。
1.2.4 慢病毒转染BSMCs
将5×104的BSMCs悬液接种于12孔板,培养至细胞融合度约为30%。取干扰病毒和NC病毒加入12孔板孔内。每个孔干扰病毒感染复数(multiply of infection,MOI)值,分别为30、10、l2和12,将未转染BSMCs作为空白对照。感染12 h后更换培养基,感染24 h后荧光显微镜下观察细胞感染状况。
1.2.5 RT-PCR检测M3受体mRNA
收集上述BSMCs,分别提取总RNA,然后进行RT-PCR,M3受体的上游引物为5′-GGCTACTGGCTGTGCTATATC-3′, 下游引物为5′-TCTTGAAGGTGGTTCTGAATGT-3′。磷酸甘油醛脱氢酶(glyceraldehyde-phosphate dehydrogenase,GAPDH)的上游引物为5′-TTCAACGGCACAGTCAAGG-3′, 下游引物为5′-CTCAGCACCAGCATCACC-3′。两步法进行RT-PCR并制作熔解曲线。根据各组M3mRNA和GAPDH的原始ct值,2-ΔΔCt法进行数据分析。
1.2.6 Western blotting法检测M3受体蛋白表达
收集上述BSMCs, 细胞裂解后离心取沉淀,经聚丙烯酰胺凝胶电泳分离后电转至聚偏氟乙烯膜,用 5%(质量分数)脱脂奶粉封闭4 ℃过夜,M3一抗(1∶1 000)37 ℃温育2 h,用含0.5% (体积分数)Tween-20的Tris-HCl缓冲液(Tris buffered saline tween,TBST)洗涤 3 次,每次10 min,二抗(1∶2 000)37 ℃温育1 h,TBST洗涤 3 次,每次10 min, 加入ECL化学发光试剂进行胶片曝光显影,Image Pro Plus进行灰度统计。
1.3 统计学方法
2 结果
2.1 测序结果
重组载体测序结果,其干扰序列的峰形图均为单峰,无突变,说明在重组载体的发夹结构中序列符合设计序列,详见图1。

图1 基因测序Fig.1 Gene sequencing
A: recombinant vector KD1;B: recombinant vector KD2;C: recombinant vector KD3;D: recombinant vector KD4;KD1: BSMCs transfected by recombinant lentivirus KD1 group;KD2: BSMCs transfected by recombinant lentivirus KD2;KD3: BSMCs transfected by recombinant lentivirus KD3;KD4: BSMCs transfected by recombinant lentivirus KD4;BSMCs: bladder smooth muscle cells.
2.2 慢病毒滴度测定
荧光法测病毒滴度, NC、KD1、KD2、KD3和KD4滴度分别为8×108、2×108、6×108、5×108和5×108TU/mL。
2.3 慢病毒转染BSMCs
未转染BSMCs、阴性病毒和干扰病毒转染BSMCs组荧光蛋白表达量, KD1组荧光蛋白表达量最高,详见图2。
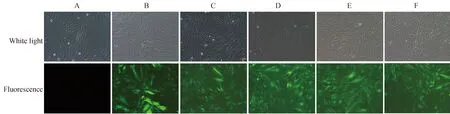
图2 各组BSMCsFig.2 BSMCs in each group (100×)
A:blank control group;B: negative control group;C: BSMCs transfected by recombinant lentivirus KD1 group;D: BSMCs transfected by recombinant lentivirus KD2;E: BSMCs transfected by recombinant lentivirus KD3;F: BSMCs transfected by recombinant lentivirus KD4;BSMCs:bladder smooth muscle cells.
2.4 RT-PCR检测M3受体mRNA
RT-PCR所得各组相对mRNA水平,KD1组M3受体基因干扰效率达到78.9%,为最符合要求的有效靶点,详见图3。
2.5 Western blotting法检测M3受体蛋白相对表达量
Western blotting测得各组细胞M3受体蛋白相对表达量,KD1组M3受体表达量最低,与阴性对照组比较,差异有统计学意义(P<0.05),详见图4。
3 讨论
膀胱在储尿期的调控主要是交感神经在发挥作用,交感神经释放去甲肾上腺素作用于BSMCs的β3受体而使其舒张并作用于膀胱颈口平滑肌的α1受体使其收缩[9-10];而副交感神经节后神经纤维释放的乙酰胆碱通过作用于BSMCs的M2和M3受体而使膀胱平滑肌收缩[11]。但是M2受体通过抑制交感神经β受体介导的膀胱舒张而间接发挥收缩膀胱的作用[2-3],而M3受体直接介导膀胱的收缩[4-7]。M3受体是由CHRM3基因编码的乙酰胆碱毒蕈碱型受体[12],毒蕈碱型受体主要介导内脏器官平滑肌和上皮的神经调控,包括呼吸道、胃肠道和泌尿道[13]。毒蕈碱型受体分为具有不同的功能的5个类型M1~M5。M3受体与Gq蛋白偶联发挥作用,当乙酰胆碱作用于M3受体时,M3受体与Gq蛋白的偶联导致磷酸肌醇水解产生三磷酸肌醇(inositol 1,4,5-trisphosphate,IP3)和前列腺素(prostaglandin,PG),IP3和PG作为信使介导钙离子内流从而导致逼尿肌收缩[14-15]。

图3 各组相对mRNA水平Fig.3 mRNA expression of M3 in each group
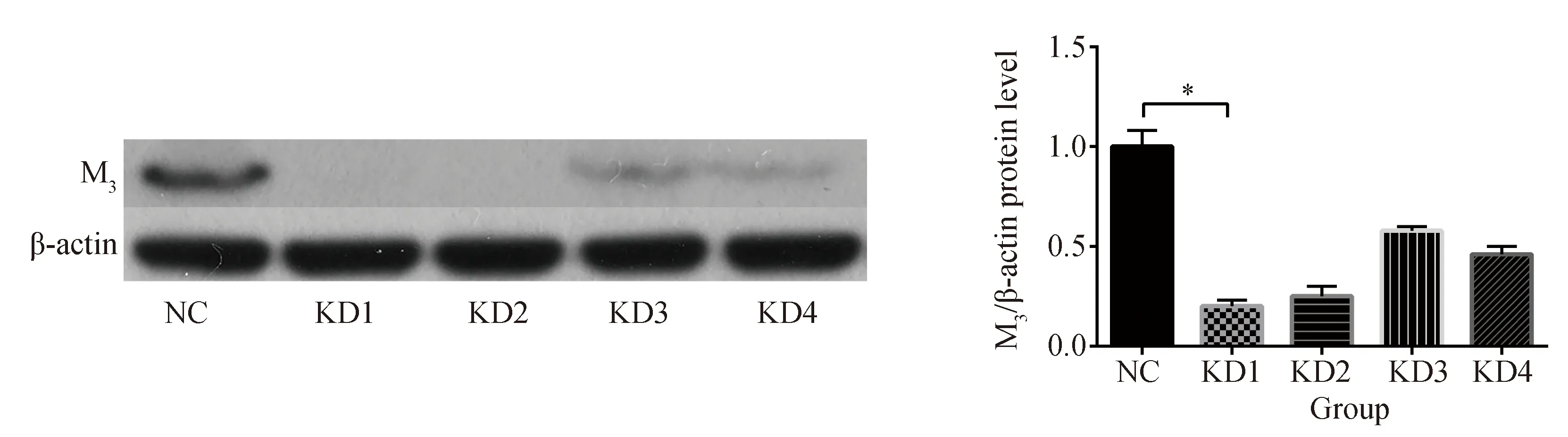
图4 各组M3受体蛋白相对表达量Fig.4 Protein expression of M3 in BSMCs in each group
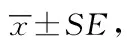
慢病毒为目前常用的基因运输载体,具有诸多优点[16-17]。首先,慢病毒载体具有较高的感染效率,它不仅可以感染分裂细胞,还可以感染非分裂细胞。本研究构建的慢病毒载体干扰效率为78.9%,国内其他研究[18-21]也取得较高的干扰效率,而反转录病毒载体转染效率不及慢病毒[22]。其次,慢病毒载体作用稳定且时间长[23],它可以携带目的基因稳定的整合进基因组。研究比较了慢病毒载体、腺病毒载体等转染靶细胞后作用时间,结果显示腺病毒载体作用时间明显短于慢病毒载体[22-24];而且慢病毒载体免疫源性低而具有很好的安全性。慢病毒为剔除毒性基因的假病毒,感染靶细胞后不会再产生新的病毒颗粒。
本研究中慢病毒载体所携带的为M3受体siRNA序列。siRNA通过与Dicer 酶等复合物的一系列生物化学酶学反应降解同源序列mRNA[8]。本研究中慢病毒载体为GV118 载体,GV118载体含有HIV基本元件5′LTR和3′LTR以及其他辅助元件,带有绿色荧光蛋白基因和puro 抗性基团标记;pHelper 1.0中含有分别编码HIV病毒的主要结构蛋白、病毒特异性酶和调节gag和pol基因表达调节因子的基因;pHelper 2.0含有编码包膜蛋白的基因[25]。基因测序结果显示M3受体siRNA序列成功插入GV118 载体并利用Lipofectamine 2000 系统收获慢病毒。荧光法测得病毒滴度后转染BSMCs,通过绿色荧光蛋白表达量以及RT-PCR检测选取干扰效率最高的KD1组病毒进行后续实验。
综上所述,成功包装并筛选了GV118-sh-M3慢病毒颗粒,为后续进一步研究干扰M3型受体在神经源性膀胱中的作用奠定了基础。
[1] Lin C S, Wu T T, Chang C H, et al. Changes of bladder M1,3muscarinic receptor expression in rats fed with short-term/long-term high-fat diets[J]. Low Urin Tract Symptoms,2017,[Epub ahead of print].
[2] Berndt-Paetz M, Herbst L, Weimann A, et al. Highly specific detection of muscarinic M3 receptor, G protein interaction and intracellular trafficking in human detrusor using Proximity Ligation Assay (PLA)[J].Acta Histochem, 2018,[Epub ahead of print].
[3] Liu Q, Luo D Y, Yang T, et al. Protective effects of antimuscarinics on the bladder remodeling after bladder outlet obstruction[J].Cell Physiol Biochem, 2017, 44(3): 907-919.
[4] Giglio D, Podmolikova L, Tobin G. Changes in the neuronal control of the urinary bladder in a model of radiation cystitis[J].J Pharmacol Exp Ther, 2018,365(2):327-335.
[5] Ehrhardt A, Wang B, Yung A C, et al. Urinary retention, incontinence, and dysregulation of muscarinic receptors in male mice lacking mras[J].PLoS One, 2015, 10(10): e0141493.
[6] Wang C T, Chen T M, Mei C T, et al. The functional haplotypes of modulate mRNA expression and associate with bladder cancer among a Chinese han population in kaohsiung city[J].Biomed Res Int, 2016, 2016: 4052846.
[7] Di Salro J, Nagabukuro H, Wickham L A, et al. Pharmacological characterization of a novel beta 3 adrenergic agonist, vibegron: evaluation of antimuscarinic receptor selectivity for combination therapy for overactive bladder[J].J Pharmacol Exp Ther, 2017, 360(2): 346-355.
[8] Dong X, Liu A, Zer C, et al. siRNA inhibition of telomerase enhances the anti-cancer effect of doxorubicin in breast cancer cells[J]. BMC Cancer,2009,9:133.
[9] Fowler C J, Griffiths D, de Groat W C. The neural control of micturition[J]. Nat Rev Neurosci, 2008,9(6):453-466.
[10] Hannan J L, Powers S A, Wang V M, et al. Impaired contraction and decreased detrusor innervation in a female rat model of pelvic neuropraxia[J]. Int Urogynecol J, 2017,28(7):1049-1056.
[11] Hirose H, Aoki I, Kimura T, et al. The subtypes of muscarinic receptors for neurogenic bladder contraction in rats[J]. Eur J Pharmacol, 2002,452(2):245-253.
[12] Weber S, Thiele H, Mir S, et al. Muscarinic acetylcholine receptor M3 mutation causes urinary bladder disease and a prune-belly-like syndrome[J]. Am J Hum Genet, 2011,89(5):668-674.
[13] Jositsch G, Papadakis T, Haberberger R V, et al. Suitability of muscarinic acetylcholine receptor antibodies for immunohistochemistry evaluated on tissue sections of receptor gene-deficient mice[J]. Naunyn Schmiedebergs Arch Pharmacol,2009,379(4):389-395.
[14] Somogyi G T, de Groat W C. Function, signal transduction mechanisms and plasticity of presynaptic muscarinic receptors in the urinary bladder[J]. Life Sci, 1999,64(6-7):411-418.
[15] Igawa Y. Discussion: functional role of M(1), M(2), and M(3) muscarinic receptors in overactive bladder[J]. Urology, 2000,55(5A Suppl):47-49; discussion 50.
[16] 房超, 尹晶,于秋爽,等.慢病毒介导的靶向干扰MEX3A基因膀胱癌稳定细胞株的建立[J].首都医科大学学报,2017,38(12):1057-1061,1066.
[17] 朱圣韬, 孙秀静, 李鹏,等. PHF8基因对食管鳞状细胞癌裸鼠移植瘤生长的影响[J]. 首都医科大学学报, 2016, 37(1):12-16.
[18] 杨洋, 郑军, 徐江,等. Naa10基因RNA干扰慢病毒载体的构建及其对口腔鳞癌细胞生长的影响[J]. 口腔医学研究,2017(7):707-711.
[19] 孙达权, 罗福丽, 廖美, 等. HuR基因的慢病毒干扰载体构建及其病毒包装[J]. 贵州医药,2017(6):563-565,673.
[20] 莫柒艳, 陈龙, 李龄, 等. 慢病毒介导的靶向干扰PARP-1基因乳腺癌稳定细胞株的构建[J]. 中国癌症防治杂志,2017,9(2):129-133.
[21] 程玉霜, 王慧艳, 肖东. 慢病毒介导RNA干扰HES1鼻咽癌稳定细胞株的建立与鉴定[J]. 山东医药, 2017,57(18):9-11.
[22] Gagnoux-Palacios L, Hervouet C, Spirito F, et al. Assessment of optimal transduction of primary human skin keratinocytes by viral vectors[J]. J Gene Med, 2005,7(9):1178-1186.
[23] Lawson S K, Dobrikova E Y, Shveygert M, et al. p38alpha mitogen-activated protein kinase depletion and repression of signal transduction to translation machinery by miR-124 and-128 in neurons[J]. Mol Cell Biol, 2013,33(1):127-135.
[24] Stewart S A, Dykxhoorn D M, Palliser D, et al. Lentivirus-delivered stable gene silencing by RNAi in primary cells[J]. RNA, 2003,9(4):493-501.
[25] 丰昀. KCTD10基因干扰RNA慢病毒载体的构建[J]. 湖南师范大学学报:医学版,2017,14(2):9-11.
