盐度和淹水对长江口潮滩盐沼植物碳储量的影响
2018-06-22李秀珍闫中正丁文慧
薛 莲,李秀珍,闫中正,张 骞,丁文慧,黄 星
华东师范大学河口海岸学国家重点实验室,上海 200062
河口及滨海盐沼因其显著的“碳汇”功能和对全球变化的快速响应已成为当前生态学研究的热点领域[1- 3]。作为盐沼生态系统的重要组成部分,盐生植物可通过光合作用固定大气中的CO2,合成有机物转化为自身生物量进入生态系统[4- 5]。死亡后的植物残体沉积、埋藏进入土壤,是盐沼生态系统有机碳输入的主要途径[5-6]。同时,“海-陆”交汇的独特地理位置,有利于盐生植物接受径流和潮汐等机械搬运带来的大量有机碎屑、营养盐等[2],一定程度上可补充其生长、发育所需养分,有利于维持相对较高的初级生产力[1,7]。盐生植物还可通过枝叶直接捕获含碳泥沙悬浮物,并借助植物群落的缓冲作用降低湍流能,进而影响潮汐水体中悬浮颗粒物沉降速率[8]。总的来说,盐生植物“内源”输入和“外源”捕获两种方式共同促进了盐沼滩面垂向淤涨,对“碳汇”功能的实现极为关键。
随着盐沼滩面向海距离渐近,地势逐渐降低,潮汐和风暴潮等干扰程度明显增加,非生物逆境胁迫更为严峻[9],使得河口及滨海盐沼对多数植物而言是极具压力的栖息环境。盐生植物能在此定居,反映其对潮滩理化环境极强的适应能力[10-11]。潮差范围内与滩面高程共变的土壤盐度梯度和淹水梯度,被公认为是影响盐生植物生长、繁殖和空间分布的关键压力因素[9-10]。然而在全球气候变化背景下,伴随着人类活动强烈干扰,海平面上升、盐水入侵、风暴潮频率和强度增加等严重影响着盐沼生态系统结构和功能的稳定[12-13],并会进一步导致潮滩水盐环境的改变,通过抬升潮汐作用基础水位,造成淹水深度和频率增加、盐水入侵加剧等严重后果。
联合国政府间气候变化专门委员会(IPCC)发布的第五次评估报告指出,1993年至2010年间,全球海平面上升速率约为3.2mm/a。而我国沿海海平面上升速率约为3.7mm/a(1993—2015年)[14],高于全球平均水平。据美国国家海洋和大气管理局(NOAA)监测数据显示,长江口吕四站(江苏启东境内)海平面上升速率达4.97mm/a(1961—2011年)。预计未来30年,长江口海平面将上升65—150mm[15]。高海平面可导致海岸侵蚀加剧和盐水入侵发生。如2014年2月份长江口盐水入侵持续超过23d,青草沙水库取水口最大氯度值为5000mg/L[16]。过度淹水或高盐分环境既可直接限制盐生植物初级生产力和降低植物碳储量,又会导致盐生植物枝叶对泥沙悬浮颗粒捕获效率的下降,进而改变盐沼生态系统有机碳累积和循环过程。
尽管长江口盐沼植物群落组成简单、自海向陆分带渐变、非生物逆境梯度明显,为分析水盐环境变化对盐沼“碳汇”能力的影响提供了理想的实验场所。但不可否认的是,当前盐沼碳储量规模与空间分布格局是多因素综合作用的结果,难以排除其他生物或非生物因素干扰,且难以量化不同环境因子对不同盐生植物碳储量变异的实际贡献,也无法准确模拟海平面上升和盐水入侵等极端环境变化产生的影响。为此,本文采用盆栽控制实验,将海平面上升、盐水入侵通过潮汐作用带来的水盐变化划分为3个维度,即淹水盐度、淹水深度和淹水频率,探究盐生植物碳储量大小对单一环境因子变化的响应。这对应对海平面上升,制定盐沼生态系统“碳汇”功能提升策略,丰富滨海湿地生态系统碳循环研究具有重要意义,同时也是对野外采样观测实验有益和必要的补充。
1 材料与方法
1.1 研究区域概况
崇明东滩(31°25′—31°38′N,121°50′—122°05′E)位于崇明岛东部,是长江口规模最大、发育最完善的河口型潮汐滩涂湿地,在调节气候、净化水质、促淤造陆和抵御风暴潮等方面发挥着重要作用[17-18],于2002年被列入《湿地公约》的国际重要湿地名录,2005年晋升为国家级自然保护区。该区域地处欧亚大陆东部与北亚热带南缘,属于海洋性季风气候区,年平均气温15.3°C,年平均日照时数2138h,无霜期长达229d,年平均降雨量1022mm,夏季热带气旋及其伴随的暴雨和风暴潮时有侵袭[19-20]。崇明东滩属于非正规半日潮型,多年最大潮差和平均潮差分别为4.62—5.95m和1.96—3.08m[21],每日有两次涨潮和落潮过程,每月有两次大潮和小潮,且潮汐日不等现象十分明显。
在20世纪90年代,因促淤造陆和海岸线稳定维护需要引入互花米草(Spartinaalterniflora)前,崇明东滩盐沼植被以芦苇(Phragmitesaustralis)群落和海三棱藨草(Scirpusmariqueter)群落为主[17, 20]。由于互花米草极强的适应和扩散能力,迅速发展成为该区域优势物种之一,形成比较典型的植被带状分布格局:光滩-海三棱藨草带-芦苇带,和光滩-海三棱藨草带-互花米草带-芦苇带[22]。近期实施的互花米草生态治理和海三棱藨草种群重建工程,对崇明东滩盐沼植被空间格局影响显著,尤其是互花米草分布范围明显缩减。
1.2 实验设计
本文以长江口潮滩本地种芦苇和海三棱藨草,及入侵种互花米草3种典型盐生植物为研究对象,采用露天盆栽培养方法,设置单因素控制实验,量化分析淹水盐度(0、5、10、15、25和35)、淹水深度(0、10、20、40、60cm和80cm,0cm即达最大持水量后停止淹水,约200mL/盆)和淹水频率(每天、每3天、每7天、每10天和每15天淹水)变化对盐生植物地上、地下和总体碳储量大小的影响,每个处理3次重复。为突出展现单一环境因子梯度变化的影响,未予考虑的另外2个环境因子均统一设定为崇明东滩盐沼常见的环境状态。即在淹水盐度实验中,淹水深度和淹水频率分别为20cm和每3天淹水;在淹水深度实验中,淹水盐度和淹水频率分别为15和每3天淹水;而在淹水频率实验中,淹水盐度和淹水深度分别为15和20cm。淹水当天分早晚2次,模拟日潮和夜潮。由于崇明东滩涨潮迅速,从光滩到各植被带依次经历潮水的时间差较小,约在1h左右,且各植被带单次潮汐持续淹水约为4—5h,短期模拟潮汐的控制实验难以准确展现较小淹水时间差异所产生的影响,故未将其列为处理因素,并简化潮汐日不等规律,确定所有处理中单次淹水时间为4h(日潮5—9am,夜潮5—9pm)。
于2014年4月初在崇明东滩潮间带选择高度一致、分布均匀、长势健康且未被扰动的单物种群落挖取目标植物的无性系分株,确保根系完整并带有原生土壤,土层厚度约30cm,以野外密度移栽至花盆(上口内径32cm、下口内径26cm、高度30cm,盆底2个3cm直径圆孔)。芦苇和互花米草移栽入盆后为提升存活率直接修剪掉地上部分(高约20—30cm),待新枝芽破土而出。海三棱藨草根系较浅且移栽时幼苗高约2—5cm,故不予修剪。本实验包括预培养(5—6月)和实验处理阶段(7—10月),移栽后未立刻实施胁迫处理而是给予一段缓冲期,旨在减轻移栽损伤对实验结果的影响。海三棱藨草因物候特点会较早衰老,故实施时间为7—9月。实验期间不施用生根粉或缓释肥,每2周清除杂草,避免非目标植物种间竞争对实验结果的影响。各盆栽植物在实验周期内未发现病害或虫害。控制处理实施前(6月底)测得芦苇、互花米草和海三棱藨草供试盆栽中植株密度分别为48±9(n=51)、12±2(n=51)和306±32(n=51)株/盆,且同类型植物盆栽土壤盐度背景值无显著差异。
每个潮汐模拟装置由2个水箱(长97cm,宽76cm和高70cm)构成,其中一个放置待处理的同类型3盆植物(即每个处理的3个重复),另一个盛放设定浓度盐水,水箱下部安装连通水管和控制水龙头。对于40至80cm淹水深度处理,盛放水箱换成更大容量水桶(直径100cm,高135cm)。“潮涨潮落”模拟借助水泵实现,且水泵处理时间不计入4h内。选用人工海水养殖专用海盐和经初步过滤沉淀沟渠水(盐度2—5)进行不同浓度(5—35)盐水配置。淡水(0)使用自来水或雨水,单次流经潮汐模拟装置,其他浓度盐水回收使用,每2周换新。每次处理实施前均用便携式盐度计(Master-S/Millα,ATAGO,日本)测定并调整(添加海盐或水),确保符合盐度设置要求。
1.3 分析方法
控制实验结束后(11月初)收割芦苇和互花米草地上部分,海三棱藨草10月初收获。所有植株齐地修剪,区分为茎、叶(含叶鞘)、穗/果实和枯立物不同构件,分装入纸袋进烘箱在105°C下杀青2h,再在60°C下烘干72h后称量干重。完成地上生物量收获后,用内径7cm聚氯乙烯管在每个花盆随机取3个柱状样,木锤敲至盆底后拔出,记录土柱高度,土样放入100目网袋(长45cm,宽30cm)冲洗去除杂质,烘干后获得根状茎和须根的集合作为地下生物量。地上生物量和地下生物量共同构成总生物量,均换算成以g/m2为单位,且地下生物量是单位面积表层土壤(0—30cm)中的干物质重量。植物不同构件样品烘干、粉碎后过100目筛,采用元素分析仪(Vario Macro,Elementar Analysensysteme GmbH,德国)测定有机碳含量,再以植物各构件生物量乘以有机碳含量求得其碳储量,加和获得各植物地上、地下和总体碳储量。盆栽土壤样品使用数显电导率仪(DDS- 11A,雷磁,上海)测量电导率并换算成土壤全盐量(g/kg)。
1.4 数据处理
利用SPSS 22.0进行数据分析,Origin 9.0完成插图制作。采用单因素方差分析(One-way ANOVA)检验植物碳储量在不同环境梯度下的差异显著性,用最小显著性差异法(Least significant difference,LSD)进行多重比较,当P<0.05时具有显著性差异。为确保均值比较结果准确性,在分析前对数据进行转化,以满足正态分布和方差齐性检验。采用逐步回归分析定量解释环境变异的相对贡献。
2 结果与分析
2.1 淹水盐度变化对植物碳储量的影响
随着淹水盐度增加,芦苇、互花米草和海三棱藨草地上部分碳储量均显著降低(P<0.05)(图1a)。淡水处理(0)和半咸水处理(15)下各植物地上部分碳储量分别为海水处理(35)下的3.4倍、2.0倍、4.5倍和2.9倍、1.4倍、2.2倍,而地下部分碳储量差异均不显著(P>0.05)。各植物总体碳储量也随淹水盐度增加而显著降低(P<0.05)(图1b)。海水处理下芦苇、互花米草和海三棱藨草总体碳储量仅为淡水处理下的51.0%、57.4%和42.2%,为半咸水处理下的57.2%、76.0%和76.4%。
芦苇、互花米草和海三棱藨草地上部分、总体碳储量与其对应的土壤盐度呈现显著线性回归关系(P<0.05)。随着土壤盐度增加,3种盐生植物地上部分和总体碳储量均显著下降(P<0.05)。土壤盐度可分别解释芦苇地上部分、总体碳储量变异的47.2%、34.7%(图2a和2b),和互花米草相应变异的66.5%、45.0%(图2e和2f)。海三棱藨草地上部分、总体碳储量变异有72.7%、62.0%由土壤盐度不同造成(图2i和2j)。
2.2 淹水深度变化对植物碳储量的影响
随着淹水深度增加,芦苇和海三棱藨草地上部分碳储量显著降低(P<0.05),地下部分碳储量差异并不显著(P>0.05)(图1c)。当淹水深度增加到80cm时,芦苇总体碳储量和海三棱藨草总体碳储量呈显著下降趋势(P<0.05)(图1d)。互花米草恰好相反,相较于0cm淹水深度处理,有水覆盖(10—80cm)更利于地上部分和总体碳储量提升,但对淹水深度的增加并未表现出明显的响应趋势。

图2 3种盐生植物地上部分、总体碳储量与土壤盐度回归关系;3种盐生植物地上部分、总体碳储量与淹水深度(10—80cm)回归关系Fig.2 Regression relationships between soil salinity and aboveground carbon storage, total carbon storage of three halophytes; regression relationships between flooding depth levels (10—80cm) and aboveground carbon storage, total carbon storage of three halophytes
通过对土壤盐度的逐月监测发现,10—80cm淹水深度处理下,同一植物类型盆栽土壤盐度差异均不显著(P>0.05),但均显著高于0cm处理(P<0.05)。可见,芦苇、互花米草和海三棱藨草碳储量对淹水深度(10—80cm)变化的响应差异与土壤盐度无关。由此构建了淹水深度(10—80cm)变化与各盐生植物地上部分和总体碳储量的回归方程,其中芦苇地上部分和总体碳储量均随淹水深度增加而显著降低(P<0.05),并在40cm淹水深度处理下地上部分碳储量达到最大值,淹水深度变化可分别解释其变异的68.6%、28.5%(图2c和2d)。互花米草地上、地下和总体碳储量与淹水深度变化均不存在显著线性关系(P>0.05)(图2g和2h)。海三棱藨草地上部分碳储量随淹水深度增加而显著降低(P<0.05)(图2k),其地上部分碳储量变异的71.1%与淹水深度变化有关,但总体碳储量与淹水深度的回归关系并未达到显著水平(P>0.05)(图2l)。
2.3 淹水频率变化对植物碳储量的影响
由图1e和1f可知,芦苇、互花米草和海三棱藨草地上、地下部分和总体碳储量在不同淹水频率处理下差异均不显著(P>0.05)。土壤盐度的逐月监测结果显示,每天淹水处理下的土壤盐度要显著高于其他淹水频率下的土壤盐度(P<0.05),随着淹水频率处理实施时间延长,土壤盐度差异逐步缩小。可见,淹水频率处理对各盐生植物碳储量的影响与土壤盐度有关。但并未随土壤盐度增加而呈现出显著下降趋势,可能与本控制实验较短的处理周期(3—4个月)有关。
3 讨论
3.1 盐生植物碳储量对水盐变化的响应探讨
水盐变化是河口及滨海盐沼生态系统区别于其他生态系统类型最典型的环境特征。其中,土壤盐分主要通过渗透胁迫(即时效应,引起生理干旱)和离子胁迫(累积效应,引发中毒)对植物生长、发育构成威胁[23];而潮水浸没常会导致土壤呈现低氧、甚至缺氧状态,进而影响植物维持正常新陈代谢过程的能力[24]。多数植物对水盐胁迫都具有敏感性,主要采取基因水平上的遗传分化和个体水平上的表型可塑两种对策来适应胁迫环境[25],即同一物种内的植株个体可在体积大小、生长速率、器官配置和繁殖策略等外在表型上产生差异以增加环境适合度。植物初级生产力和碳储量大小作为抵消压力影响后直观的综合表现,可较好地反应其对逆境胁迫的耐受能力。
文中,当淹水盐度从0增加到35时,互花米草地上部分、总体碳储量下降程度(49.5%、42.6%)要低于芦苇(70.3%、49.0%)和海三棱藨草(77.8%、57.8%)。淹水深度增加显著降低芦苇和海三棱藨草地上部分碳储量、总体碳储量,但互花米草在80cm淹水深度下仍有较高的地上部分碳储量和总体碳储量。可见,互花米草对水盐胁迫的耐受能力要强于本地种芦苇和海三棱藨草。这与前人研究结论较为一致,即逆境胁迫下互花米草的种间竞争能力相对更强[26-27]。在当前持续上升的海平面及盐水入侵作用下,3种盐生植物耐受能力差异会在一定程度上促进互花米草在群落组成中优势度的提升和空间格局上的散布扩张,进而影响河口及滨海盐沼生态系统有机碳累积动态。
植物和土壤作为盐沼生态系统中有机碳储存的两大蓄库[1, 28],对河口及滨海湿地“碳汇”能力的维持十分关键。但植物因生长周期限制,相对于土壤中有机碳长期、稳定的蓄积而言,仅充当着有机碳储存固定的“临时库”[28]。植物衰老死亡后,地上和地下碎屑残体在土壤微生物作用下分解转化,进一步稳定成为土壤有机质前体[5]。在本文设置水盐梯度下,3种盐生植物碳储量大小均受到不同程度抑制,输入土壤中的植物碳量显著降低。海三棱藨草碳储量((636±168)g/m2,n=51)本就不高,水盐胁迫会使其对土壤碳库的贡献更加微弱。尽管互花米草((2597±590)g/m2,n=51)和芦苇((1533±318)g/m2,n=51)有着相对较高的植物碳储量,但海平面上升及盐水入侵等逆境胁迫带来的抑制影响也不容忽视。
3.2 盆栽实验与野外调查的盐生植物碳储量对比分析
一般来说,不同区域野外调查数据的对比分析会受到气候条件、地貌特征、植物物候、养分补给和遗传特性等诸多因素共同影响。为减少区域差异,本文仅选择了崇明东滩、九段沙和杭州湾等野外调查数据与控制实验结果进行比较,目的在于考查盆栽培养方式对各盐生植物碳储量大小的限制程度。由表1可知,本文芦苇地上部分碳储量低于梅雪英和张修峰[29]、邵学新等[30]分别在崇明东滩、杭州湾的测定结果,但高于刘钰等[31]、张天雨[32]在九段沙、崇明东滩的调查数据。而互花米草和海三棱藨草地上部分碳储量均高于野外监测结果。芦苇因地下根系碳储量累积受限,导致总体碳储量略低于野外。互花米草总体碳储量和野外数据接近,海三棱藨草地下部分和总体碳储量均高于野外调查数据。可见,尽管盆栽培养方式因花盆空间限制、养分制约,及原位移栽带来的机械损伤,不可避免地影响到了供试盐生植物生长,但并未过度限制碳储量大小,也不会影响碳储量对水盐变化的响应研究。而且,3种盐生植物碳储量排序为互花米草>芦苇>海三棱藨草,与梅雪英和张修峰[29]、张天雨[32]在崇明东滩调查结果表现一致,证实了芦苇和互花米草对河口盐沼生态系统有机碳累积的重要贡献。
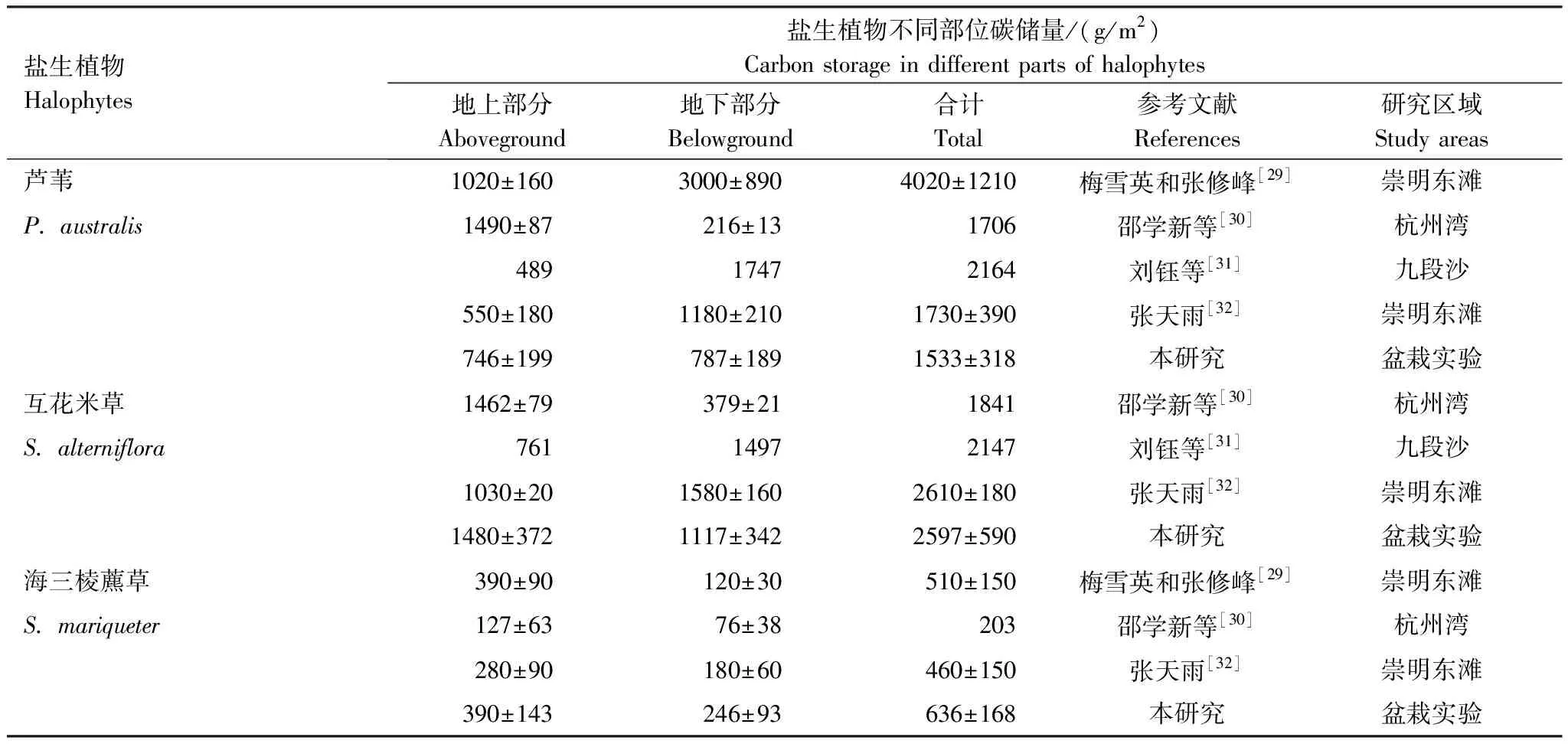
表1 盆栽实验与野外调查条件下植物碳储量对比分析
此外,由于淡水径流、潮汐等携带“外源”有机碳或营养盐输入通量具有明显的时空异质性,控制实验难以模拟,故本文暂未考虑其对各盐生植物碳储量大小的影响。同时,海平面上升和盐水入侵带来的淹水和盐度变化往往是同时存在的,本文仅采用单因素控制实验,未考虑两者交互作用,与野外实际存在一定偏差。但分析盐生植物与单一环境因子的定量关系,是了解复杂生态问题的重要前提,也是评价各项环境因子在生态系统中共同作用的基础。下一步还需充分了解两者的耦合机制,并在更长的时间尺度上探讨海平面上升及盐水入侵等逆境胁迫对盐沼“碳汇”能力的影响,这对于维持和发挥河口及滨海湿地固碳潜力,应对全球气候变化具有重要现实意义。
4 结论
互花米草地上、地下部分和总体碳储量均相对最高,芦苇次之,海三棱藨草最低,表明互花米草和芦苇对长江口盐沼生态系统有机碳累积具有重要贡献。随着水盐逆境胁迫加剧,芦苇、互花米草和海三棱藨草地上部分、总体碳储量均受到不同程度抑制,输入土壤中的植物碳量显著降低,但互花米草对水盐胁迫的耐受能力要强于本地种芦苇和海三棱藨草。海三棱藨草碳储量本就不高,海平面上升及盐水入侵等逆境胁迫会进一步削弱其对土壤碳库的相对贡献。
致谢:本研究在样品采集和室内分析过程中得到华东师范大学河口海岸学国家重点实验室杨斌、张运清和姜俊彦等同学的大力协助,特此致谢。
参考文献(References):
[1] Mcleod E, Chmura G L, Bouillon S, Salm R, Björk M, Duarte C M, Lovelock C E, Schlesinger W H, Silliman B R. A blueprint for blue carbon: toward an improved understanding of the role of vegetated coastal habitats in sequestering CO2. Frontiers in Ecology and the Environment, 2011, 9(10): 552- 560.
[2] Hopkinson C S, Cai W J, Hu X P. Carbon sequestration in wetland dominated coastal systems-a global sink of rapidly diminishing magnitude. Current Opinion in Environmental Sustainability, 2012, 4(2): 186- 194.
[3] Mueller P, Jensen K, Megonigal J P. Plants mediate soil organic matter decomposition in response to sea level rise. Global Change Biology, 2016, 22(1): 404- 414.
[4] Sousa A I, Lillebø A I, Pardal M A, Caçador I. Productivity and nutrient cycling in salt marshes: contribution to ecosystem health. Estuarine, Coastal and Shelf Science, 2010, 87(4): 640- 646.
[5] De Deyn G B, Cornelissen J H C, Bardgett R D. Plant functional traits and soil carbon sequestration in contrasting biomes. Ecology Letters, 2008, 11(5): 516- 531.
[6] Burd A B, Frey S, Cabre A, Ito T, Levine N M, Lønborg C, Long M, Mauritz M, Thomas R Q, Stephens B M, Vanwalleghem T, Zeng N. Terrestrial and marine perspectives on modeling organic matter degradation pathways. Global Change Biology, 2016, 22(1): 121- 136.
[7] Morris J T, Sundberg K, Hopkinson C S. Salt marsh primary production and its responses to relative sea level and nutrients in estuaries at Plum Island, Massachusetts, and North Inlet, South Carolina, USA. Oceanography, 2013, 26(3): 78- 84.
[8] Morris J T, Barber D C, Callaway J C, Chambers R, Hagen S C, Hopkinson C S, Johnson B J, Megonigal P, Neubauer S C, Troxler T, Wigand C. Contributions of organic and inorganic matter to sediment volume and accretion in tidal wetlands at steady state. Earth′s Future, 2016, 4(4): 110- 121.
[9] Engels J G, Rink F, Jensen K. Stress tolerance and biotic interactions determine plant zonation patterns in estuarine marshes during seedling emergence and early establishment. Journal of Ecology, 2011, 99(1): 277- 287.
[10] Davy A J, Brown M J H, Mossman H L, Grant A. Colonization of a newly developing salt marsh: disentangling independent effects of elevation and redox potential on halophytes. Journal of Ecology, 2011, 99(6): 1350- 1357.
[11] Brownstein G, Wilson J B, Burritt D J. Waterlogging tolerance on a New Zealand saltmarsh. Journal of Experimental Marine Biology and Ecology, 2013, 446: 202- 208.
[12] Kirwan M L, Megonigal J P. Tidal wetland stability in the face of human impacts and sea-level rise. Nature, 2013, 504(7478): 53- 60.
[13] Osland M J, Enwright N M, Day R H, Gabler C A, Stagg C L, Grace J B. Beyond just sea-level rise: considering macroclimatic drivers within coastal wetland vulnerability assessments to climate change. Global Change Biology, 2016, 22(1): 1- 11.
[14] 国家海洋局. 2015年中国海平面公报. (2016-03- 24) [2017-03-08]. http://www.soa.gov.cn/zwgk/hygb/zghpmgb/201603/t20160324_50508.html.
[15] 国家海洋局. 2016年中国海平面公报. (2017-03- 22) [2017-05- 27]. http://www.soa.gov.cn/zwgk/hygb/zghpmgb/201703/t20170322_55304.html.
[16] 国家海洋局. 2014年中国海平面公报. (2015-03- 03) [2017-03-08]. http://www.soa.gov.cn/zwgk/hygb/zghpmgb/201503/t20150318_36408.html.
[17] Li B, Liao C Z, Zhang X D, Chen H L, Wang Q, Chen Z Y, Gan X J, Wu J H, Zhao B, Ma Z J, Cheng X L, Jiang L F, Chen J K.Spartinaalterniflorainvasions in the Yangtze river estuary, China: an overview of current status and ecosystem effects. Ecological Engineering, 2009, 35(4): 511- 520.
[18] Ma Z J, Melville D S, Liu J G, Chen Y, Yang H Y, Ren W W, Zhang Z W, Piersma T, Li B. Rethinking China′s new great wall. Science, 2014, 346(6212): 912- 914.
[19] 马云安, 马志军. 崇明东滩国际重要湿地. 北京: 中国林业出版社, 2006: 22- 87.
[20] Li X Z, Ren L J, Liu Y, Craft C, Mander Ü, Yang S L. The impact of the change in vegetation structure on the ecological functions of salt marshes: the example of the Yangtze estuary. Regional Environmental Change, 2014, 14(2): 623- 632.
[21] Ge Z M, Guo H Q, Zhao B, Zhang C, Peltola H, Zhang L Q. Spatiotemporal patterns of the gross primary production in the salt marshes with rapid community change: a coupled modeling approach. Ecological Modelling, 2016, 321: 110- 120.
[22] Tang L, Gao Y, Li B, Wang Q, Wang C H, Zhao B.Spartinaalterniflorawith high tolerance to salt stress changes vegetation pattern by outcompeting native species. Ecosphere, 2014, 5(9): art116.
[23] Galvan-Ampudia C S, Testerink C. Salt stress signals shape the plant root. Current Opinion in Plant Biology, 2011, 14(3): 296- 302.
[24] Colmer T D, Pedersen O, Wetson A M, Flowers T J. Oxygen dynamics in a salt-marsh soil and inSuaedamaritimaduring tidal submergence. Environmental and Experimental Botany, 2013, 92: 73- 82.
[25] Grativol C, Hemerly A S, Ferreira P C G. Genetic and epigenetic regulation of stress responses in natural plant populations. Biochimica et Biophysica Acta (BBA)-Gene Regulatory Mechanisms, 2012, 1819(2): 176- 185.
[26] Wang C H, Lu M, Yang B, Yang Q, Zhang X D, Hara T, Li B. Effects of environmental gradients on the performances of four dominant plants in a Chinese saltmarsh: implications for plant zonation. Ecological Research, 2010, 25(2): 347- 358.
[27] Medeiros D L, White D S, Howes B L. Replacement ofPhragmitesaustralisbySpartinaalterniflora: the role of competition and salinity. Wetlands, 2013, 33(3): 421- 430.
[28] Minden V, Kleyer M. Testing the effect-response framework: key response and effect traits determining above-ground biomass of salt marshes. Journal of Vegetation Science, 2011, 22(3): 387- 401.
[29] 梅雪英, 张修峰. 长江口典型湿地植被储碳、固碳功能研究——以崇明东滩芦苇带为例. 中国生态农业学报, 2008, 16(2): 269- 272.
[30] 邵学新, 李文华, 吴明, 杨文英, 蒋科毅, 叶小齐. 杭州湾潮滩湿地3种优势植物碳氮磷储量特征研究. 环境科学, 2013, 34(9): 3451- 3457.
[31] 刘钰, 李秀珍, 闫中正, 陈秀芝, 何彦龙, 郭文永, 孙培英. 长江口九段沙盐沼湿地芦苇和互花米草生物量及碳储量. 应用生态学报, 2013, 24(8): 2129- 2134.
[32] 张天雨. 崇明东滩湿地沉积物有机碳和总氮储量动态研究[D]. 上海: 华东师范大学, 2016.
