短期夜间增温对亚高山针叶林云杉幼苗根系分泌物速率和化学成分的影响
2018-06-22张子良乔明锋尹华军
蒋 铮,肖 娟,张子良,乔明锋,何 为,刘 庆,尹华军,,*
1 中国科学院成都生物研究所,中国科学院山地生态恢复与生物资源利用重点实验室,生态恢复与生物多样性保育四川省重点实验室,成都 610041 2 中国科学院大学,北京 100049 3 西华师范大学环境科学与工程学院,南充 637000 4 四川旅游学院,成都 610100
随着人们对地下生态学研究的不断深入,植物根系在调控土壤功能和养分循环过程中的重要作用逐渐被人们关注和认知[1- 2]。在植物生长过程中, 根系作为植物和土壤的重要媒介,除了从生长介质中摄取必需的养分和水分外,还可以向生长介质中主动或被动地分泌质子、离子和大量的有机物质,即狭义的根系分泌物[3]。近年来的研究表明,根系分泌物主要包括一些低分子(有机酸、糖类、酚类和各种氨基酸等)和高分子(蛋白质、黏液等)有机化合物,大约占植物光合同化产物的5%—20%[4]。作为根际生态过程的关键驱动要素,根系分泌物是根系-土壤-微生物之间进行物质、能量和信息交流的重要媒介,在土壤结构形成、土壤养分活化、植物养分吸收、化感作用、缓解环境胁迫以及调节根际微生态系统活力和功能等方面都具有十分重要的作用[5- 6]。因此,根系分泌物输入及其介导的土壤生物地球化学过程已成为地下生态学研究的关键环节[7- 8]。
伴随着全球气候变暖加剧,森林类型、物种组成、地下C分配格局以及菌根浸染变化都直接影响根系分泌物输入数量与质量,并进一步深刻地影响根际土壤有机质分解与养分代谢过程[9- 10]。IPCC发布的第五次评估报告指出, 全球平均温度在过去的100多年显著上升,到21世纪末全球预估增温1.1—6.4℃,在高纬度和高海拔地区增温幅度可能会更大[11-12]。温度是植物生长发育和生理功能的重要环境因子,同时也是调节陆地生态系统生物地球化学循环的关键因素。前人研究表明,温度变化能够显著影响植物根系的生长、形态和生理等特征,并进而影响根系分泌物输入数量与质量[13-14]。然而,目前关于增温对森林根系分泌物输入的影响研究较为缺乏,已有的少量研究也仅关注了增温对根系分泌物碳(C)输入的影响,而忽略了增温背景下森林根系分泌物化学组分与含量的变化[10,15-16]。考虑到植物根系分泌物不同组分与含量变化对土壤微生物过程具有特异化的生态学功能[17],这种忽略极大地限制了对森林根系-土壤-微生物互作机制全面深入的认识。因此开展森林根系分泌物化学组分与含量变化对增温的响应规律研究已成为一个非常重要但又极为缺乏了解的研究课题。
西南亚高山针叶林(subalpine coniferous forest)是青藏高原东部高寒森林的主体,对该区域水土保持、水源涵养、气候调节和生物多样性保育等方面具有十分重要的作用和地位,也是研究全球变化对森林生态系统影响的关键地区和重要森林类型[18]。粗枝云杉(PiceaasperataMast.)是西南亚高山针叶林的主要建群种之一,属于浅根系物种,容易受到环境温度变化的影响[19]。因此,本研究以粗枝云杉作为试验对象,通过红外辐射增温装置模拟气候变暖,采用自制的根系分泌物收集装置,并结合气相色谱和质谱联用技术,量化分析了增温对云杉根系碳(C)分泌速率、氮(N)分泌速率、分泌物化学组分及各组分中主要化合物含量变化的影响,旨在为全球变化背景下森林根系分泌物组分及其诱导的特异性生态学效应和功能研究提供理论基础。
1 材料和方法
1.1 研究地概况
研究区域位于中国科学院成都生物研究所茂县山地生态系统定位研究站(31°41′N,103°53′E),海拔1820m。该区域年降水量919.5mm,年蒸发量795.8mm,年均温度8.9℃,年积温2690.8℃,年均日照时数1139.8h,森林土壤以淋溶褐土和棕壤土(0—30cm)为主,pH值5.8—6.0。该区域属于暖温带亚高山季风气候,夏季多雨、冬季寒冷干燥。该地区自然植被丰富,从高山底部到顶部,植被带包括灌木、落叶阔叶林、亚高山针叶林和高山草甸[20]。
1.2 试验材料与设计
试验植物为株高、基径和生长状况一致的4a生云杉幼苗,由米亚罗原301林场苗圃提供,并于2006年10月移栽入试验样地,进行一段时间的适应和驯化。供试土壤为茂县生态站附近的森林表层土,过5mm筛混匀后采用客土法将实验地40cm深土壤全部换作实验土。供试土壤初始理化性质为土壤pH值6.8,容重0.91g/cm3,全氮含量4.0g/kg,有机碳含量61g/kg[21]。
试验共设3对2m×2m的小区,每对小区中,一个为增温小区,另一个为对照小区。在增温小区中,将红外线辐射加热器HS- 2420(Kalglo Electronics Inc., Bethlehem, PA, USA)悬挂于增温小区上方距地面1.5m处,自2007年4月起对样地进行连续增温。增温时间为12h夜间连续增温,从当日19:00到次日7:00。为了去除红外线辐射加热器的遮荫干扰,在对照小区中采用相同大小的虚拟加热器悬挂于距地面1.5m处。同时,为了避免增温的边缘效应,对照与增温小区间隔2m以上;为使增温小区树种受热均匀,将红外线辐射加热器每隔1个月90°转换一次。试验中,定期清除样地内新生杂草,并对土壤水分进行监测,及时浇水以保证各小区土壤水分状况一致。试验设计共包括对照与增温两个处理。
1.3 环境因子监测
于2008年4月在试验地内安装温度自动检测装置,利用传感器监测增温与对照样地内20cm高的空气温度。测定位置为小区正中央,高度和幼苗高度齐平,在温度仪的上方约10cm处悬挂小塑料板遮挡,以避免红外辐射加热器的直接照射影响。传感器每2h记录1次,并自动输出数据储存于记录仪(Campbell AR5, Avalon, USA)中。同时,利用传感器监测增温与对照样地内土壤0、5cm和15cm深的温度,每2h记录一次,并自动输出数据储存于记录仪(Campbell AR5, Avalon, USA)中。试验选取2014年3月—2015年7月监测的距地20cm处空气温度和5cm深的土壤温度数据进行分析。
1.4 试验方法
1.4.1 根系分泌物收集
于2014年7—8月份生长旺季,利用改进的静态原位收集装置收集根系分泌物。在每个样方随机选取一株云杉幼苗,沿着其根系生长方向找一根未受损伤的细根(直径<2mm,长20—30cm),用去离子水小心冲洗细根3次以除去杂质,再用不含C、N元素的营养液(0.1mmol/L KH2PO4,0.2mmol/L K2SO4,0.2mmol/L MgSO4·7H2O和0.3mmol/L CaCl2·2H2O)温和地冲洗细根表面的矿物质,并用镊子去除细根表面吸附的有机质。将洗净的细根转移至装有玻璃棉的针筒中(玻璃棉经2mol/L HCl浸泡24h,以防止抽滤时玻璃珠堵塞筒口),用盐酸浸泡过的玻璃砂填满,加盖后用铝箔、保鲜膜密封,通过导管向玻璃管中注射上述盐溶液作为细根培养的缓冲液,最后埋入土中培养。间隔24h后利用真空泵抽滤3次至棕色塑料瓶中。每次抽滤结束后注入10mL上述营养液继续培养,每次取样连续收集3d。同时以无根的培养装置作为对照,每个样方设3个重复。试验结束后,将针筒中用于根系分泌物收集的细根带回实验室,置于60℃的烘箱中烘干至恒重,测定根系的干重,以定量表征不同处理下根系分泌物速率变化。
1.4.2 根系分泌物C和N速率测定
利用总碳/氮分析仪(Multi-N/C 2100, Analytik Jena AG, Germany)测定根系分泌物溶液中总有机碳(TOC)和总氮(TN)的含量,将样品中TOC和TN浓度减去对照后,计算出单位时间内根系分泌的C、N含量,再除以根系干重和收集时间,换算成单位根干重的根系分泌速率(μg C g-1h-1,μg N g-1h-1)。
1.4.3 根系分泌物总糖分泌速率测定
采用硫酸-蒽酮比色法[22]测定根系分泌物总糖含量。测定方法简要如下:将收集的根系分泌物溶液中总糖浓度调整到测定范围(稀释10倍),精确吸取2mL置于干燥洁净试管中,立即加入蒽酮试剂6mL,振荡混匀,并置于沸水浴中加热15min。取出后迅速浸于冰水浴中冷却15min,冷却后在620nm波长下迅速测定各试管中样品的吸光度值。根据葡萄糖含量的标准曲线,由样品溶液吸光度值计算各样品溶液中总糖的含量,并以单位时间单位根干重所分泌的总糖含量(μg糖 g-1h-1)表示根系分泌物中总糖分泌速率。
1.4.4 根系分泌物氨基酸分泌速率测定
采用全波长扫描式多功能读数仪(Varioskan Flash, Thermo, USA)测定氨基酸含量,以邻苯二甲醛和β-巯基乙醇为衍生化试剂,甘氨酸为标准物做标准曲线,用荧光光度法测定根系分泌物原液中氨基酸浓度,其激发波长为360nm,发射波长为420nm[23]。并以单位时间单位根干重所分泌的氨基酸含量(μg氨基酸 g-1h-1)来表征根系分泌物中氨基酸分泌速率。
1.4.5 根系分泌物GC-MS分析根系分泌物化学组分
将原位采集的根系分泌物用乙酸乙酯连续萃取3次(1∶1),合并萃取液,乙酸乙酯部分经旋转蒸发仪浓缩得粗提物,用1mL乙酸乙酯溶解并过0.22μm滤膜。实验采用色谱柱为弹性石英毛细管柱HP- 5 MS 5% Phenyl Methyl Siloxane(30m×0.25mm×0.25μm);初始柱温50℃,保留1min;以8℃/min升温至280℃,保持10min;气化室温度250℃,传输线温度280℃,载气为高纯He(99.999%),流速1.0mL/min;柱前压7.62psi,进样量为1μL,离子源为EI源,温度250℃,溶剂延迟3min;检测质量范围40—700amu。GC-MS谱图中各色谱峰通过计算机按照相似度、正匹配因子和反匹配因子自动在质谱数据库中查找相似化合物,对相似度和匹配指数较高的化合物进行鉴定,并利用峰面积归一化法计算各组分相对百分含量[24]。
1.5 数据处理
实验数据采用SPSS 17.0软件进行统计分析,利用独立样本T检验(Independent-Samples T Test)方法比较增温处理与对照处理云杉根系分泌物TOC、TN、氨基酸和总糖分泌速率及挥发性物质相对含量的差异显著性。文章所有图为Origin 8.0绘制,表为Microsoft Excel 2010绘制。
2 结果与分析
2.1 红外增温效果
图1表明,在2014年3月1日至2015年5月25日整个试验期间,增温处理下样地内平均气温(地上20cm处)比对照提高了1.83℃。类似地,增温样地内日平均土壤温度(地下5cm处)比对照区域提升了3.88℃(图1)。
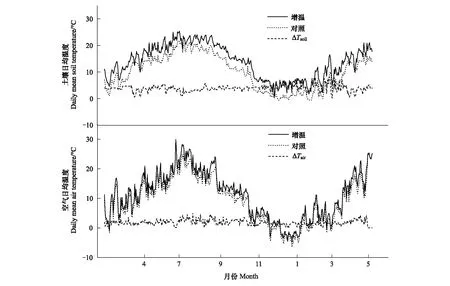
图1 增温对土壤日均温度和空气日均温度的影响 Fig.1 Effects of warming on daily mean soil temperature (a) and daily mean air temperature (b)△Tsoil代表土壤增温前后温差,△Tair代表空气增温前后温差
2.2 增温对云杉根系分泌物C、N分泌速率及C∶N比的影响
由图2可知,增温显著地促进了云杉根系分泌物中C的分泌,增温后的云杉根系分泌物C分泌速率为570.93μg C g-1根重 h-1,与对照相比,显著增加了43.89%(P<0.05)。增温对云杉根系分泌物N分泌速率无显著影响(P>0.05)。另外,增温增加了云杉根系分泌物的C∶N比,与对照相比,显著提高了28.36%(P<0.05),表明增温对根系C分泌的促进作用大于对N分泌的促进作用。
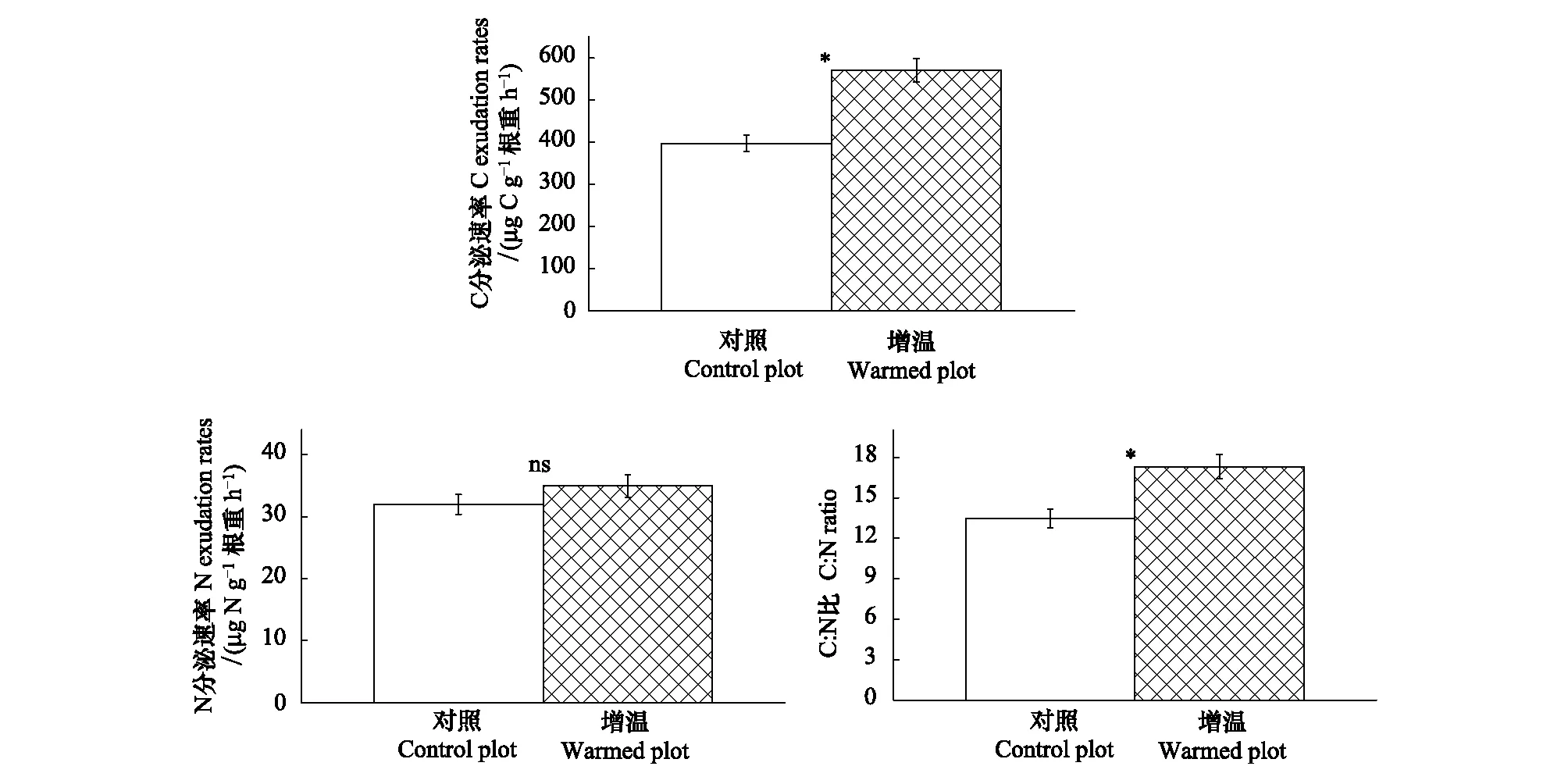
图2 增温对云杉根系分泌物C、N分泌速率及C∶N比的影响Fig.2 Effects of warming on mass-specific C exudation rates (a) and N exudation rates (b) for the P. asperata seedlings. In c, values represent the warming effects on C∶N ratio of the root exudates*表示增温处理在P < 0.05水平上差异显著,ns表示差异不显著
2.3 增温对根系分泌物总糖、氨基酸输入速率及主要挥发性组分的影响
由图3可知,增温显著地促进了云杉根系分泌物中总糖分泌速率。增温后的云杉根系分泌总糖速率为10.57μg 糖 g-1根重 h-1,与对照相比,显著增加了38.6%(P<0.05)。根系分泌物中氨基酸的分泌速率对增温的响应与总糖分泌速率呈现相同的规律。增温后根系分泌物中氨基酸分泌速率为2.14μg 氨基酸 g-1根重 h-1,与对照相比,显著增加了43.16%(P<0.05)。
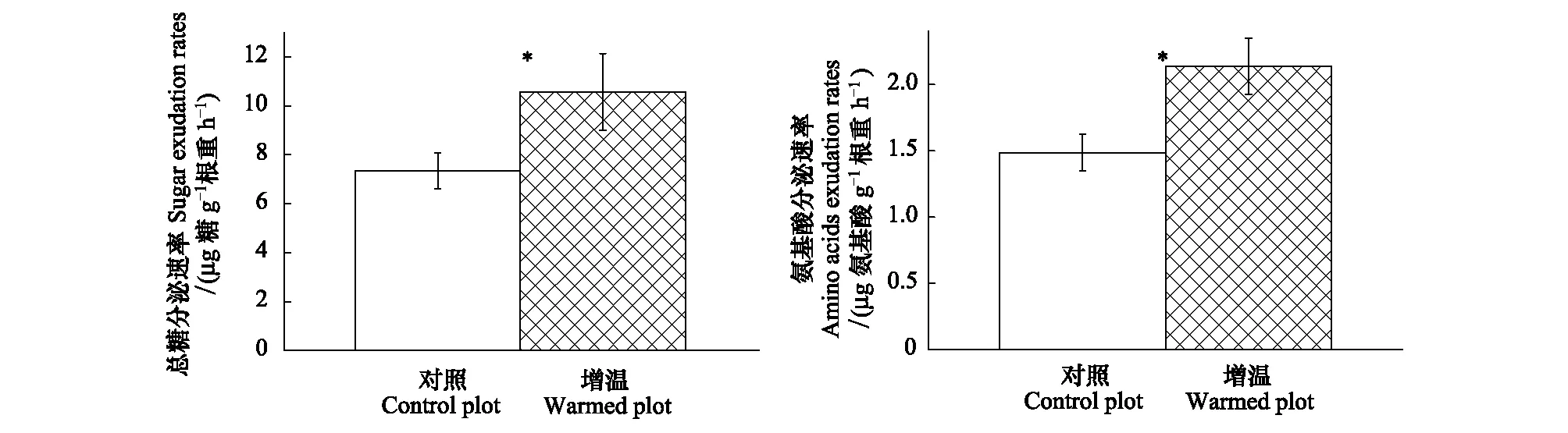
图3 增温对云杉根系分泌物中总糖分泌速率和氨基酸分泌速率的影响Fig.3 Effects of warming on mass-specific sugar exudation rates (a) and amino acids exudation rates (b) for the P. asperata seedlings*表示增温处理在P< 0.05水平上差异显著
由表1可知,增温显著影响了云杉根系分泌物中部分挥发性组分的相对含量。具体而言,与对照相比,增温条件下云杉根系分泌物中酚类化合物相对含量显著增加了89.1%(P<0.01);相反地,增温却显著降低了云杉根系分泌物中酯类、醚类物质的相对含量,与对照相比,增温导致酯类、醚类两大类物种相对含量分别降低了59.5%(P<0.01)和51.4%(P<0.05)。此外,增温导致酮类相对含量增加,而降低了根系分泌物中烃类、固醇类、胺类、醛类相对含量,但这些组分在对照与增温处理之间均无显著性差异(P>0.05)。
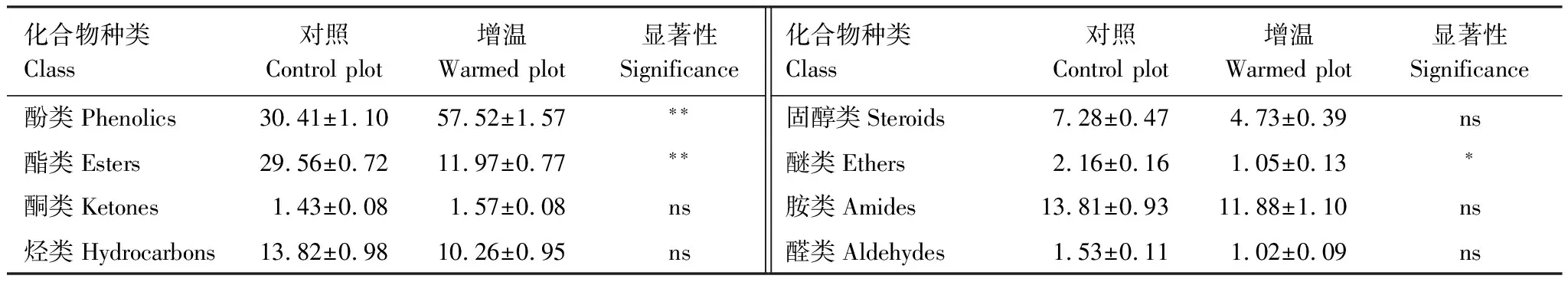
表1 云杉根系分泌物中各类挥发性物质相对含量对增温的响应(平均值±标准误,n=3)
*表示增温处理在P< 0.05水平上差异显著,**表示在P< 0.01水平上差异极显著,ns表示没有显著差异
2.4 增温处理下云杉根系分泌物挥发性组分中各物质相对含量变化
结合表2中数据,进一步分析根系分泌物挥发性组分中具体物质的相对含量变化可以发现,一些成分的相对含量在增温后发生了显著的改变。与对照相比,增温条件下发生了显著变化的组分,酚类化合物中2,6-二叔丁基- 4-甲基苯酚和4-叔丁基杯[4]芳烃增温后相对含量显著增加了88.9%(P<0.01)和375.7%(P<0.05);酯类化合物中1,2-苯二甲酸单丁酯、16-脱氢孕烯醇酮乙酸酯和柠檬酸丁酯相对含量分别显著降低了79.4%(P<0.01)、48.1%(P<0.01)和67.4%(P<0.05);醚类化合物的主要成分2-(7-十七烷氧基)四氢- 2H-吡喃含量显著降低了51.9%(P<0.05)。此外,一些组分在处理间虽然总体上未见显著差异,但其部分化学成分仍有显著变化。例如,在增温处理下,酮类化合物中异长叶烯酮显著降低了28.6%(P<0.05),而7,9-二-叔丁基- 1-氧杂螺(4.5)癸烷- 6,9-二烯- 2,8-二酮含量显著增加了59.1%(P<0.05);烃类化合物中3-乙基- 5-(2-乙基丁基)十八烷含量显著下降了71.7%(P<0.01);固醇类化合物中β-谷甾醇显著降低了84.7%(P<0.05);胺类化合物中4,4′-二辛基二苯胺显著下降49.5%(P<0.05);醛类化合物中3,5-二叔丁基- 4-羟基苯甲醛显著降低44.9%(P<0.05)。
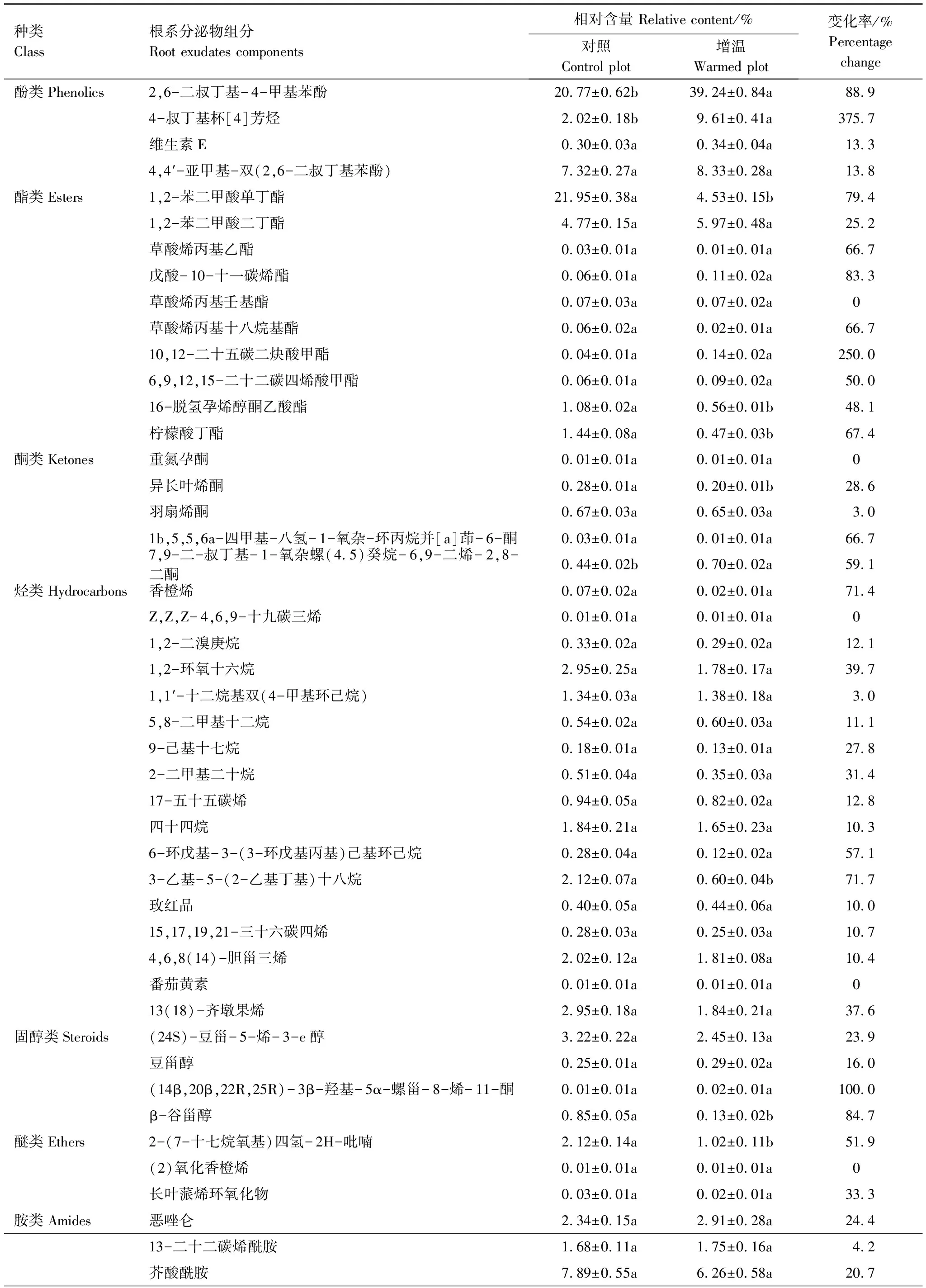
表2 云杉根系分泌物挥发性组分及其相对含量(平均值±标准误,n=3)
同一行中不同字母表示增温后差异显著(P<0.05)
3 讨论
3.1 增温对云杉根系分泌物C、N分泌速率的影响
伴随着全球气候变暖加剧,气温和土壤温度逐渐升高,这势必会深刻地影响植物的生长发育、光合作用、碳分配格局、根系生长和生理活性,并进而调控根系分泌物输入数量与质量[25]。本研究表明,增温显著地促进了云杉幼苗根系分泌物C源输入(图2)。推测可能的原因是由于在增温条件下,植物根系通过生理调节增加根系碳源输入,提高土壤微生物代谢酶活性和N养分转化过程,以满足树木持续生长所需的土壤养分,即采取高C输入-高N收益的养分策略[15]。类似的研究结果已在前期研究中得到了有效验证。例如,Uselmen等研究表明:增温4℃可显著增加了固氮植物刺槐(RobiniapseudoacaciaL.)根系分泌物中可溶性有机碳的释放[26]。需要说明的是,增温也可通过改变细根生物量[27]、菌根浸染[28]等其它途径来调控根系C源输入,关于根系分泌物输入的调控机理有待进一步深入研究。同时,C源作为微生物重要的能量物质,含量的显著变化必然会引起强烈的根际效应[25],改变根际生物活性,对该地区微生物群落产生深远影响。增温处理下云杉根系N输入并无显著变化(图2),这表明在增温条件下云杉根系没有向土壤中释放额外的N。推测其可能原因之一是由于亚高山针叶林为典型的受N限制的森林生态系统,在增温条件下需要更多的N养分来提高树木生长和林分生产力,植物自身通过限制根系N损失所形成的一种生理调节机制[29]。此外,由于云杉根系C和N输入对增温有着不同的响应趋势,增温导致云杉根系分泌物C∶N化学计量比显著增加(图2),表明增温改变了云杉根系分泌物输入的化学质量。考虑到植物根系分泌物N含量或C∶N化学计量特征是驱动根际微生物群落组成和活性的重要调控因子[30],因此,增温条件下云杉根系分泌物C∶N化学计量比增加势必将深刻地调控土壤养分循环过程及其生态反馈效应,未来应加强该方面的深入研究。
3.2 增温对根系分泌物化学组分及其含量的影响效应
植物在生长过程中,能够分泌出大量的根系分泌物,其化学成分复杂多变,包括糖类、氨基酸、有机酸、酚酸类、脂肪酸、甾醇类、蛋白质、生长因子等[5]。本研究中云杉根系分泌物被检测到的化学组分主要包括糖类、氨基酸以及酚类、酯类、酮类、烃类、固醇类、醚类、胺类、醛类等挥发性化学成分(图3、表1)。进一步分析表明,不同化学组分输入含量变化对增温的响应具有明显差异,其响应幅度和方向与化学组分种类有关。具体而言,糖类、氨基酸作为根系分泌物中常见的两类低分子量化合物[31],增温显著地促进了云杉根系分泌物中这两类低分子物质的输入(图3)。增温下根系分泌物这两类物质输入增加可为土壤微生物提供更多的碳源和氮源,进而促进微生物的生长与繁殖[32],这在一定程度上佐证了前人研究得出的增温能够促进根际土壤微生物的生长与活性的结论[33]。对于根系分泌物挥发性化学组分而言,酚类化合物是被检测的根系分泌物挥发性化学组分中含量最高的一类物质,增温显著地增加了根系分泌物中酚类化合物含量,而酯类、醚类组分含量在增温后表现出显著降低的趋势(表1)。此外,增温对特定挥发性组分中不同化合物的相对含量影响也存在明显差异(表2)。以酚类化合物为例,增温仅导致酚类化合物主要成分2,6-二叔丁基- 4-甲基苯酚和4-叔丁基杯[4]芳烃含量显著增加(分别比对照增加了88.9%和375.7%),而对其余酚类化合物成分含量无显著影响。总之,增温导致根系分泌物组分及各组分中部分化合物含量发生了较明显的变化。
目前有关环境条件变化对植物根系分泌物输入数量与质量的影响与调控机理并不十分清楚。然而,越来越多的研究表明,根系分泌物是植物在长期进化和生长过程中形成的一种适应策略,并在很大程度上受植物光合作用、植物生长、根系生理活性以及环境要素等多种生物与非生物要素的影响与制约[34]。一方面,植物在不同环境条件下可通过自身生理调整选择性地向土壤中释放特定的根系化合物,进而影响微生物活性与功能生长与功能[25]。另一方面,土壤微生物可通过影响根细胞膜流动性与通透性、根代谢活动、土壤养分有效性等途径而对根系分泌物输入具有重要的修饰限制作用,是驱动根系分泌物输入数量与质量变化的另一个重要因素[35- 36]。此外,根际微生物被证明还可以通过有选择地利用根系分泌物中的特定成分来调控植物根分泌物输入的组成成分与含量[37]。本研究中,由于增温持续地促进了云杉幼苗生长[27],根系分泌物作为植物应对环境条件的一种自我生理调节手段,增温条件下云杉通过根系向土壤微生物投入更多的C源以促进土壤微生物活性和N素转化过程来满足植物生长需要。但遗憾地是,受研究方法和试验设计的限制,本研究中我们很难进一步阐释增温条件下云杉根系分泌物组分含量变化的内在驱动机制,这有待于我们进一步深入研究。
大量研究表明,不同的根系分泌物化学组分输入对土壤过程具有特异性的生态学效应与功能[17,35]。例如有机酸可作为信号分子促进微生物的生长[38],也能够络合土壤中的重金属元素来缓解重金属胁迫[32];酚类化合物能够直接参与调控土壤微生物活性和生物地球化学过程,进而影响土壤C积累和养分循环[39-40]。同时,酚类化合物被认为具有很强的化感作用,能对植物根系本身及根际微生物根系生长和活性产生抑制作用[41-42]。因此,作为森林土壤C-养分循环的重要“启动者”和“驱动者”[43],根系分泌物在气候变暖背景下化学组分与含量变化势必会对该区土壤C-N养分循环过程产生重要的潜在影响,并进一步反馈于亚高山针叶林生态系统结构和功能。未来研究应聚焦于气候变暖条件亚高山针叶林根系分泌物组分与含量变化与土壤生物化学循环过程的耦合机制研究,以便更深入地揭示亚高山针叶林生态系统地下生态学过程对环境变化的响应机制及其生态反馈效应。
通过我们的研究,获得的主要结论如下:(1) 增温显著增加了云杉幼苗根系分泌物C分泌速率和C∶N化学计量比;(2)增温显著改变了根系分泌物中部分化学组分及各组分中部分化合物的含量。需要说明的是,该试验本身具有一定的局限性。比如,受试验条件和方法限制,本研究所获得的根系分泌物化学成分也许不够全面和充分,尚未能全面真实地反映出增温下云杉幼苗根系分泌物组分与含量变化规律。此外,本研究的试验对象为4年生幼苗,由于植物成株与幼苗在生长、形态和生理活性等方面都有较大差异,所获得的云杉幼苗根系分泌物化学成分与含量可能与野外成株有所不同,因而在用本文研究结果外推到森林生态系统尺度时,必须足够谨慎。这需要我们进一步深入开展根系分泌物化学成分分析的长期野外原位研究和数据积累, 并在未来研究中充分重视植物根系分泌物组分与含量变化与土壤生物化学循环过程的耦合机制。
致谢:感谢中国科学院成都生物研究所茂县生态站对野外监测和采样工作给予的帮助。
参考文献(References):
[1] Björk R G, Majdi H, Klemedtsson L, Lewis-Jonsson L, Molau U. Long-term warming effects on root morphology, root mass distribution, and microbial activity in two dry tundra plant communities in northern Sweden. New Phytologist, 2007, 176(4): 862- 873.
[2] Volder A, Gifford R M, Evans J R. Effects of elevated atmospheric CO2, cutting frequency, and differential day/night atmospheric warming on root growth and turnover ofPhalarisswards. Global Change Biology, 2007, 13(5): 1040- 1052.
[3] 涂书新, 吴佳. 植物根系分泌物研究方法评述. 生态环境学报, 2010, 19(10): 2493- 2500.
[4] Dijkstra F A, Cheng W X. Interactions between soil and tree roots accelerate long-term soil carbon decomposition. Ecology Letters, 2007, 10(11): 1046- 1053.
[5] 吴林坤, 林向民, 林文雄. 根系分泌物介导下植物-土壤-微生物互作关系研究进展与展望. 植物生态学报, 2014, 38(3): 298- 310.
[6] Phillips R P, Finzi A C, Bernhardt E S. Enhanced root exudation induces microbial feedbacks to N cycling in a pine forest under long-term CO2fumigation. Ecology Letters, 2011, 14(2): 187- 194.
[7] Finzi A C, Abramoff R Z, Spiller K S, Brzostek E R, Darby B A, Kramer M A, Phillips R P. Rhizosphere processes are quantitatively important components of terrestrial carbon and nutrient cycles. Global Change Biology, 2015, 21(5): 2082- 2094.
[8] Keiluweit M, Bougoure J J, Nico P S, Pett-Ridge J, Weber P K, Kleber M. Mineral protection of soil carbon counteracted by root exudates. Nature Climate Change, 2015, 5(6): 588- 595.
[9] Drake J E, Gallet-Budynek A, Hofmockel K S, Bernhardt E S, Billings S A, Jackson R B, Johnsen K S, Lichter J, McCarthy H R, McCormack M L, Moore D J P, Oren R, Palmroth S, Phillips R P, Pippen J S, Pritchard S G, Treseder K K, Schlesinger W H, Delucia E H, Finzi A C. Increases in the flux of carbon belowground stimulate nitrogen uptake and sustain the long-term enhancement of forest productivity under elevated CO2. Ecology Letters, 2011, 14(4): 349- 357.
[10] Cheng W X, Parton W J, Gonzalez-Meler M A, Phillips R, Asao S, McNickle G G, Brzostek E, Jastrow J D. Synthesis and modeling perspectives of rhizosphere priming. New Phytologist, 2014, 201(1): 31- 44.
[11] IPCC. Climate Change 2014: Synthesis Report. Contribution of Working Groups I, II and III to the Fifth Assessment Report of the Intergovernmental Panel on Climate Change. Geneva, Switzerland: IPCC, 2014.
[13] Xu M H, Peng F, You Q G, Guo J, Tian X F, Xue X, Liu M. Year-round warming and autumnal clipping lead to downward transport of root biomass, carbon and total nitrogen in soil of an alpine meadow. Environmental and Experimental Botany, 2015, 109: 54- 62.
[14] Wu Y B, Zhang J, Deng Y C, Wu J, Wang S P, Tang Y H, Cui X Y. Effects of warming on root diameter, distribution, and longevity in an alpine meadow. Plant Ecology, 2014, 215(9): 1057- 1066.
[15] Yin H J, Li Y F, Xiao J, Xu Z F, Cheng X Y, Liu Q. Enhanced root exudation stimulates soil nitrogen transformations in a subalpine coniferous forest under experimental warming. Global Change Biology, 2013, 19(7): 2158- 2167.
[16] Brzostek E R, Greco A, Drake J E, Finzi A C. Root carbon inputs to the rhizosphere stimulate extracellular enzyme activity and increase nitrogen availability in temperate forest soils. Biogeochemistry, 2013, 115(1/3): 65- 76.
[17] Zhang Z L, Qiao M F, Li D D, Zhao C Z, Li Y J, Yin H J, Liu Q. Effects of two root-secreted phenolic compounds from a subalpine coniferous species on soil enzyme activity and microbial biomass. Chemistry and Ecology, 2015, 31(7): 636- 649.
[18] 尹华军, 赖挺, 程新颖, 蒋先敏, 刘庆. 增温对川西亚高山针叶林内不同光环境下红桦和岷江冷杉幼苗生长和生理的影响. 植物生态学报, 2008, 32(5): 1072- 1083.
[19] 李月蛟, 朱利英, 尹华军, 刘庆, 蒋先敏, 赵春章. 连续三年夜间增温和施氮对云杉外生菌根及菌根真菌多样性的影响. 生态学报, 2015, 35(9): 2967- 2977.
[20] 陈智, 尹华军, 卫云燕, 刘庆. 夜间增温和施氮对川西亚高山针叶林土壤有效氮和微生物特性的短期影响. 植物生态学报, 2010, 34(11): 1254- 1264.
[21] 卫云燕, 尹华军, 刘庆, 黎云祥. 夜间增温和施肥对川西亚高山针叶林两种树苗根际效应的影响. 生态学报, 2011, 31(3): 698- 708.
[22] 汤灿辉, 彭新君, 文礼章, 江星明. 蒽酮-硫酸比色法测定三叶虫茶中总糖的含量. 湖南中医药大学学报, 2008, 28(5): 38- 40.
[23] Jones D L, Owen A G, Farrar J F. Simple method to enable the high resolution determination of total free amino acids in soil solutions and soil extracts. Soil Biology and Biochemistry, 2002, 34(12): 1893- 1902.
[24] 石鑫, 魏天兴, 陈珏, 解建强, 周毅. 低效刺槐林根系分泌物的GC-MS分析. 湖南农业科学, 2011, (15): 135- 137, 142- 142.
[25] Phillips R P, Meier I C, Bernhardt E S, Grandy A S, Wickings K, Finzi A C. Roots and fungi accelerate carbon and nitrogen cycling in forests exposed to elevated CO2. Ecology Letters, 2012, 15(9): 1042- 1049.
[26] Uselman S M, Qualls R G, Thomas R B. Effects of increased atmospheric CO2, temperature, and soil N availability on root exudation of dissolved organic carbon by a N-fixing tree (RobiniapseudoacaciaL.). Plant and Soil, 2000, 222(1/2): 191- 202.
[27] Yin H J, Xiao J, Li Y F, Chen Z, Cheng X Y, Zhao C Z, Liu Q. Warming effects on root morphological and physiological traits: the potential consequences on soil C dynamics as altered root exudation. Agricultural and Forest Meteorology, 2013, 180: 287- 296.
[28] Treseder K K, Holden S R. Fungal carbon sequestration. Science, 2013, 339(6127): 1528- 1529.
[29] Qiao M F, Zhang Z L, Li Y J, Xiao J, Yin H J, Yue B S, Liu Q. Experimental warming effects on root nitrogen absorption and mycorrhizal infection in a subalpine coniferous forest. Scandinavian Journal of Forest Research, 2016, 31(4): 347- 354.
[30] 梁儒彪, 梁进, 乔明锋, 徐振锋, 刘庆, 尹华军. 模拟根系分泌物C∶N化学计量特征对川西亚高山森林土壤碳动态和微生物群落结构的影响. 植物生态学报, 2015, 39(5): 466- 476.
[31] 刘军, 温学森, 郎爱东. 植物根系分泌物成分及其作用的研究进展. 食品与药品, 2007, 9(03A): 63- 65.
[32] Haase S, Neumann G, Kania A, Kuzyakov Y, Römheld V, Kandeler E. Elevation of atmospheric CO2and N-nutritional status modify nodulation, nodule-carbon supply, and root exudation ofPhaseolusvulgarisL. Soil Biology and Biochemistry, 2007, 39(9): 2208- 2221.
[33] Yin H J, Xu Z F, Chen Z, Wei Y Y, Liu Q. Nitrogen transformation in the rhizospheres of two subalpine coniferous species under experimental warming. Applied Soil Ecology, 2012, 59: 60- 67.
[34] Kuzyakov Y, Cheng W. Photosynthesis controls of rhizosphere respiration and organic matter decomposition. Soil Biology and Biochemistry, 2001, 33(14): 1915- 1925.
[35] 贺永华, 沈东升, 朱荫湄. 根系分泌物及其根际效应. 科技通报, 2006, 22(6): 761- 766.
[36] Aroca R, Ruiz-Lozano J M. Induction of plant tolerance to semi-arid environments by beneficial soil microorganisms——a review//Lichtfouse E, ed. Climate Change, Intercropping, Pest Control and Beneficial Microorganisms. Netherlands: Springer, 2009: 121- 135.
[37] Graham R D. Genotypic differences in tolerance to manganese deficiency//Graham R D, Hannam R J, Uren N C, eds. Manganese in Soils and Plants. Dordrecht: Springer, 1988: 261- 276.
[38] Steinkellner S, Lendzemo V, Langer I, Schweiger P, Khaosaad T, Toussaint J P, Vierheilig H. Flavonoids and strigolactones in root exudates as signals in symbiotic and pathogenic plant-fungus interactions. Molecules, 2007, 12(7): 1290- 1306.
[39] Lattanzio V, Lattanzio V M T, Cardinali A. Role of phenolics in the resistance mechanisms of plants against fungal pathogens and insects//Imperato F, ed. Phytochemistry: Advances in Research. Trivandrum: Research Signpost, 2006: 23- 67.
[40] Li Z H, Wang Q, Ruan X, Pan C D, Jiang D A. Phenolics and plant allelopathy. Molecules, 2010, 15(12): 8933- 8952.
[41] 申建波, 张福锁. 根分泌物的生态效应. 中国农业科技导报, 1999, 1(4): 21- 27.
[42] 谢星光, 陈晏, 卜元卿, 戴传超. 酚酸类物质的化感作用研究进展. 生态学报, 2014, 34(22): 6417- 6428.
[43] Paterson E, Gebbing T, Abel C, Sim A, Telfer G. Rhizodeposition shapes rhizosphere microbial community structure in organic soil. New Phytologist, 2007, 173(3): 600- 610.
