四川盆地亚热带常绿阔叶林凋落叶多酚类物质在不同降雨期间的降解特征
2018-06-22马志良杨万勤吴福忠
马志良, 杨万勤, 吴福忠, 谭 波
四川省林业生态工程省级重点实验室, 四川农业大学生态林业研究所, 成都 611130
凋落物分解是重要的森林生态系统过程之一,在维持森林生态系统生产力、净碳储量、土壤有机质的形成、森林植被群落演替等方面具有不可替代的作用和地位[1]。凋落物分解过程同时受到气候、凋落物基质质量、分解者群落等生物和非生物因素的综合调控[1- 2]。植物多酚,也称单宁,是植物体合成的一类复杂的次生代谢产物,具多元酚结构,在结构上可分为水解单宁和缩合单宁两大类,广泛分布于植物的皮、根、叶和果实中,在许多针叶树种的树皮中含量可高达20%—40%,仅次于纤维素、半纤维素和木质素[3]。植物多酚由多环芳烃核和活性官能团聚合而成,相对分子质量大,结构复杂,化学性质活泼[4]。这类物质虽不能通过各种代谢途径直接影响植物的生长发育,但是其在植物进化过程中扮演着重要作用,如能提高植物对环境的适应性和空间竞争能力、抵御植食性动物的啃食、增强抗病性及化感作用等[5];同时对整个森林生态系统过程具有重要的生态反馈意义[6]。多酚类物质在植物体内不易迁移,不能被植物重新利用,在森林凋落物中,尤其是针叶树种凋落物,多酚类物质含量常常很高[7]。凋落物多酚类物质含量是一类重要的基质质量指标,其含量的多寡常被用作预测凋落物分解速率的指标[1,7- 9]。一般地,多酚类物质含量越高,凋落物分解速率越慢[10- 11],同时也受到水解单宁和缩合单宁含量相对比例的调控。然而,目前关于凋落物分解的研究主要集中在大量元素释放动态(如C、N、P等)[12- 13]以及木质素、纤维素降解特征等[14- 15]方面,凋落物分解过程中多酚类物质的降解动态仍不十分清楚。在湿热的亚热带常绿阔叶林区,凋落物分解由生物降解主导,土壤微生物和土壤动物对凋落物难分解成分(木质素、纤维素和多酚等)的降解过程具有显著贡献[16- 17]。四川盆地亚热带常绿阔叶林每年在秋冬季节出现叶凋落高峰[18],新鲜的凋落叶首先经过几个月的旱季分解,迎来水热条件较好的雨季。季节性降雨期间,良好的水热环境更适宜于生物分解者生长、繁殖和活动,凋落物生物降解过程强烈进行。然而,凋落物的生物降解同时受到分解者群落、凋落物基质质量和降解所处的环境条件的综合影响[19]。不同分解时期凋落物的基质质量和分解所处的环境不断发生变化,分解者群落结构与活性也在不断变化[20]。因此,不同基质质量的凋落叶多酚类物质在不同降雨时期可能具有明显不同的降解特征。然而,目前仍然缺乏季节性降雨对凋落物多酚类物质降解过程的影响研究[21]。
四川盆地地处长江上游的亚热带常绿阔叶林区,具有雨热同季的气候特点,干湿季分明,季节性降雨期长达5—6个月。前期研究结果发现,季节性降雨期间,由于相对较好的水、热等环境条件,凋落物具有更为明显的分解特征,凋落叶在第一年分解了27.75%—72.09%,季节性降雨期的凋落叶质量损失达到69%以上,显著高于旱季[22]。因此,凋落叶多酚类物质降解过程在季节性降雨期间可能加快,且受到不同树种凋落叶基质质量的影响。本文以四川盆地亚热带常绿阔叶林最具代表性的3个针叶树种马尾松(Pinusmassoniana)、柳杉(Cryptomeriafortunei)、杉木(Cunninghamialanceolata)和3个阔叶树种香樟Cinnamomumcamphora)、红椿(Toonaciliata)、麻栎(Quercusacutissima)凋落叶为研究对象,根据实际降雨特征,采用凋落物袋法研究了6种凋落叶多酚类物质在不同雨热季节的降解特征,以期为更好的认识亚热带常绿阔叶林凋落物分解过程提供基础理论依据。
1 材料与方法
1.1 研究区概况
本研究区域位于四川省崇州市桤泉镇四川农业大学现代农业研发基地,该基地占地面积133.33hm2,坐落于长江上游四川省川西平原西部,地理坐标103°38′31′′—103°39′22′′E,30°33′16′′—30°33′54′′N,海拔516m,属四川盆地亚热带湿润季风气候。该地区年平均气温16.0℃,年平均降水量1015.2mm,降雨主要集中在5—9月,降雪稀少。年平均日照时数为1161.5h,平均无霜期为283d。土壤类型为老冲积黄壤。研究区域土壤性质以及植被状况详见文献[23]。
1.2 试验方法
1.2.1 试验设计和样品处理
2012年10月底在四川盆地典型生态系统用尼龙网收集马尾松、柳杉、杉木、香樟、红椿、麻栎的新鲜凋落叶。收集好的6种凋落叶带回实验室,经自然风干后,每个树种准确称取10g装入凋落物袋内(规格为20cm×20cm,网孔大小为底部0.5mm,表面层1mm)并标记,每种凋落叶分别装15袋,共计90袋。另外分别称取相同质量(10g)的6种树种凋落叶各3份,在65℃下烘干至恒量,测定含水量,用于推算放置在凋落物袋内凋落叶的初始干质量。烘干的凋落叶样品粉碎后用于初始多酚类物质含量及其他基质质量指标的测定。其中,多酚类物质含量采用福林酚法测定。6种凋落叶分解前多酚类物质含量见表1,凋落叶其他初始基质质量特征详见文献[22]。
根据前期调查,于2013年1月18日在研究区域内选择3块无高大乔木和灌木遮掩、地形平坦的空旷地表作为重复试验样地,每块样地之间间隔大约10m。首先去除试验样地土壤表面的植物和凋落物,再将凋落物袋平铺于地表,每种凋落物袋在每块试验样地上放置5袋。样品埋设后,在试验地地表凋落物袋内设置一个纽扣式温度记录器(iButton DS1923-F5, Maxim/Dallas Semiconductor, Sunnyvale, USA),设定为每120min读取一次温度数据,自动记录试验期间地表的温度变化(图1)。根据崇州市多年降雨资料以及试验期间实际降雨状况(图1),将试验时间划分为微量降雨期(MRS: 2013年1月18日—2013年2月19日)、春季少雨期(SRS: 2013年2月19日—2013年4月22日)、雨季前期(ERS: 2013年4月22日—2013年8月19日)、雨季后期(LRS: 2013年8月19日—2013年10月22日)和冬季少雨期(WRS: 2013年10月22日—2014年1月18日)5个时期。各时期降雨量数据详见文献[22]。具体采样时间为2013年2月19日、4月22日、8月19日、10月22日和2014年1月18日,每次从每块样地内采集每种凋落物袋各1袋,带回实验室。小心去除表面泥土和新长入的细根,于65℃烘干至恒量,测定剩余凋落叶的质量,粉碎后测定多酚类物质含量。
1.2.2 数据计算
多酚类物质降解率计算公式为:
E(%) = (M0×C0-Mt×Ct)/ (M0×C0) × 100%;
多酚类物质降解量计算公式为:
R=Mt×Ct-Mt+1×Ct+1;
式中,M0为放置凋落物袋时袋内凋落叶的干质量(g);Mt和Mt+1分别为t和t+1采样时期凋落物袋内凋落叶的干质量(g);C0为初始多酚类物质含量(mg/g);Ct和Ct+1分别为t和t+1采样时期多酚类物质含量(mg/g)。
1.3 数据统计分析
使用Excel 2003和SPSS 20.0进行数据统计与分析。使用单因素方差分析(one-way ANOVA)和最小显著差异法(LSD)比较凋落叶分解前多酚类物质含量和各分解时期多酚类物质降解量之间的差异。当方差不齐时执行不等方差假设项下的Dunnett′s T3差异显著性检验。制图使用Origin 9.0完成。
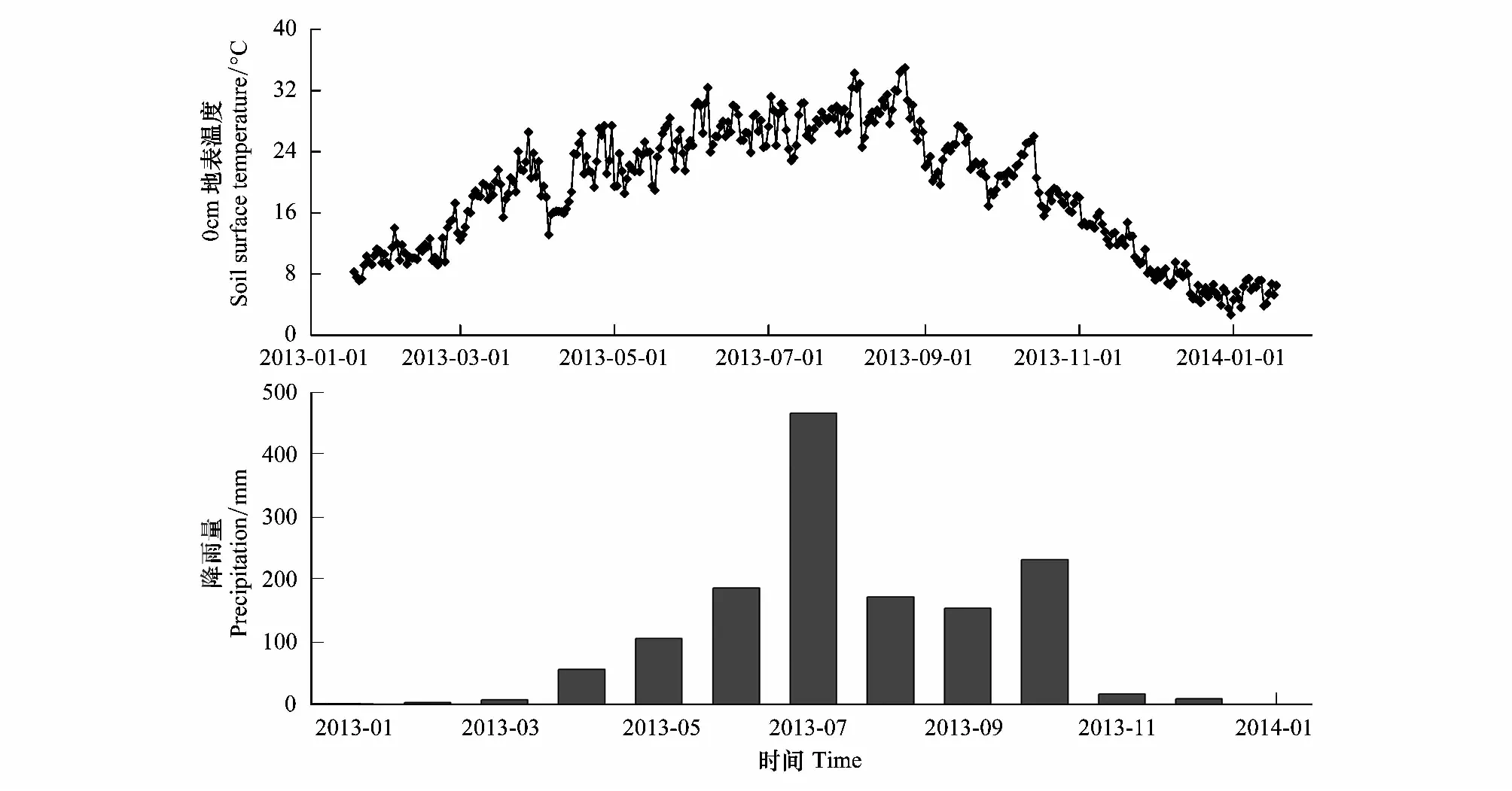
图1 试验期间日平均温度和月实际降水量Fig.1 The daily mean temperature and the month actual precipitation during the incubation experiment
2 结果与分析
2.1 凋落叶多酚类物质含量动态
麻栎凋落叶多酚类物质含量最高,香樟最低,且6种凋落叶初始多酚类物质含量之间差异显著(表1)。分解过程中6种凋落叶多酚类物质含量动态较为一致,均表现为自微量降雨期起至雨季前期止,多酚类物质含量均表现为迅速下降的趋势;雨季前期结束时,红椿凋落叶多酚类物质降解完毕,其余5种凋落叶多酚类物质含量均降低至5mg/g以下,此后均保持动态平衡(图2)。

表1 6种凋落叶分解前多酚类物质含量/(mg/g)
不同的小写字母表示不同树种之间差异显著(P<0.05)。数据为平均值±标准差,n=3
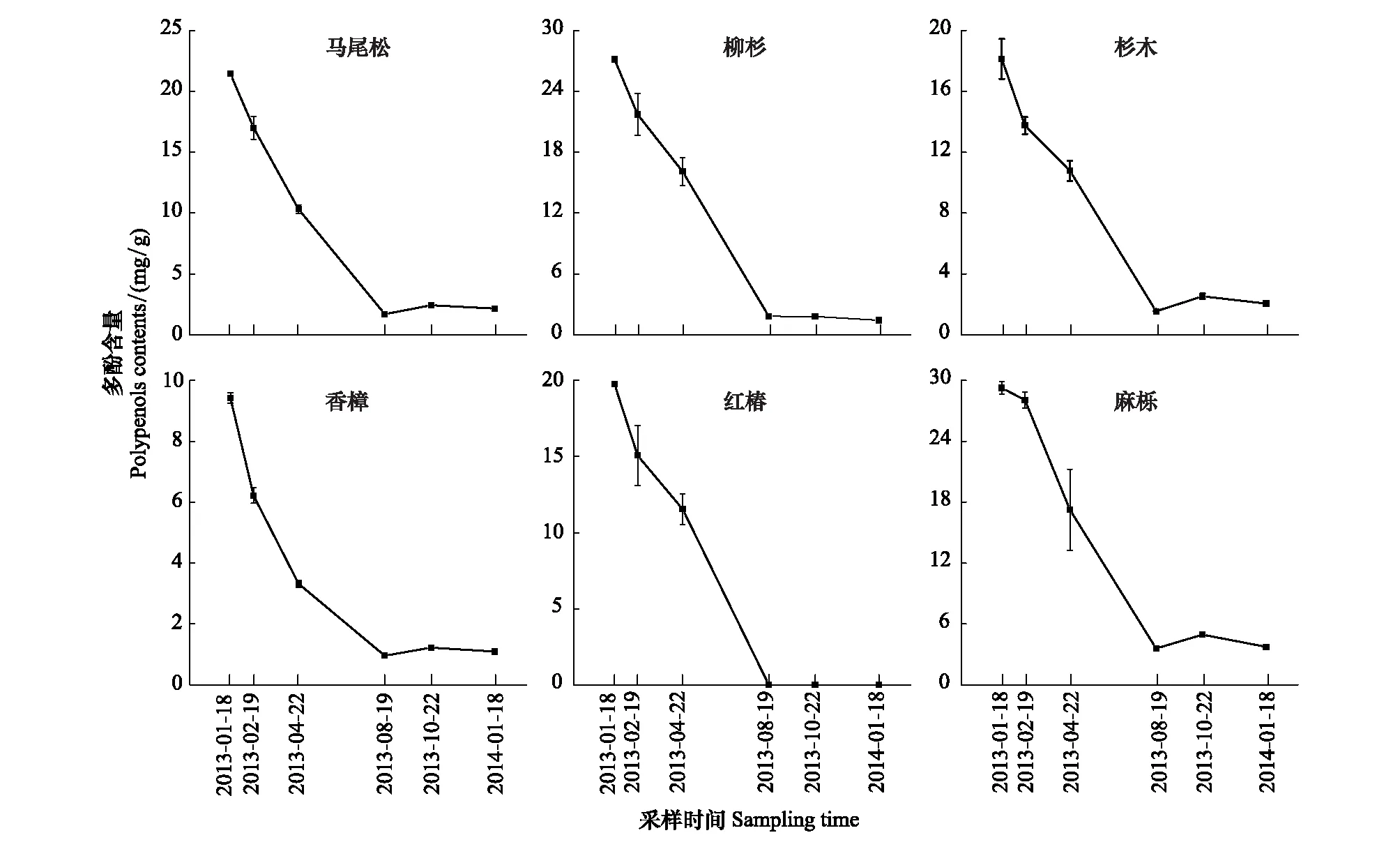
图2 常绿阔叶林6个树种凋落叶多酚类物质含量动态Fig.2 Dynamics of polyphenols contents of foliar litter of six tree species in the subtropical evergreen broadleaved forest
2.2 凋落叶多酚类物质降解动态
由图3可见,与凋落叶多酚类物质含量动态类似,6种凋落叶多酚类物质降解动态变化较为一致,均表现为自分解开始起至雨季前期止,随降雨量的增加,多酚类物质降解率呈现直线增加的趋势,之后处于稳定状态。分解1年后,6种凋落叶多酚类物质降解率大小顺序依次为:红椿(100%) > 柳杉(97.81%) > 杉木(94.45%) > 麻栎(93.67%) > 马尾松(93.06%) > 香樟(91.64%);并且除香樟(雨季前期降解率为28.78%)以外的5种凋落叶多酚类物质大量降解发生在雨季前期(ERS),占全年降解率的44.46%—55.72%;6种凋落叶多酚类物质在分解初期旱季两时期(MRS和SRS)均有较大的降解量,此时期多酚类物质降解率占全年降解率的42.16%—71.20%。由表2可以看出,凋落叶多酚类物质降解受物种和分解时期的调控,不同物种凋落叶多酚类物质在不同分解时期具有不同的降解特征,并且降解量具有显著差异。此外,凋落物初始多酚类物质含量对其最终降解率的大小具有决定作用。分解1年后,对凋落叶初始多酚类物质含量与其降解率进行函数拟合,发现二者之间呈显著地二次函数关系(图4)。
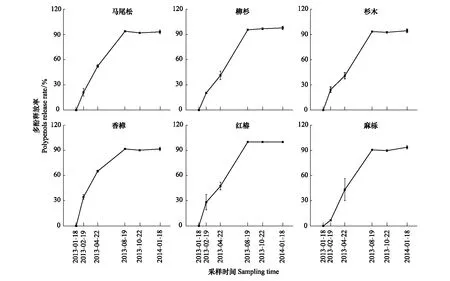
图3 常绿阔叶林6个树种凋落叶多酚类物质降解率动态Fig.3 Dynamics of polyphenols degradation rates of foliar litter of six tree species in the subtropical evergreen broadleaved forest
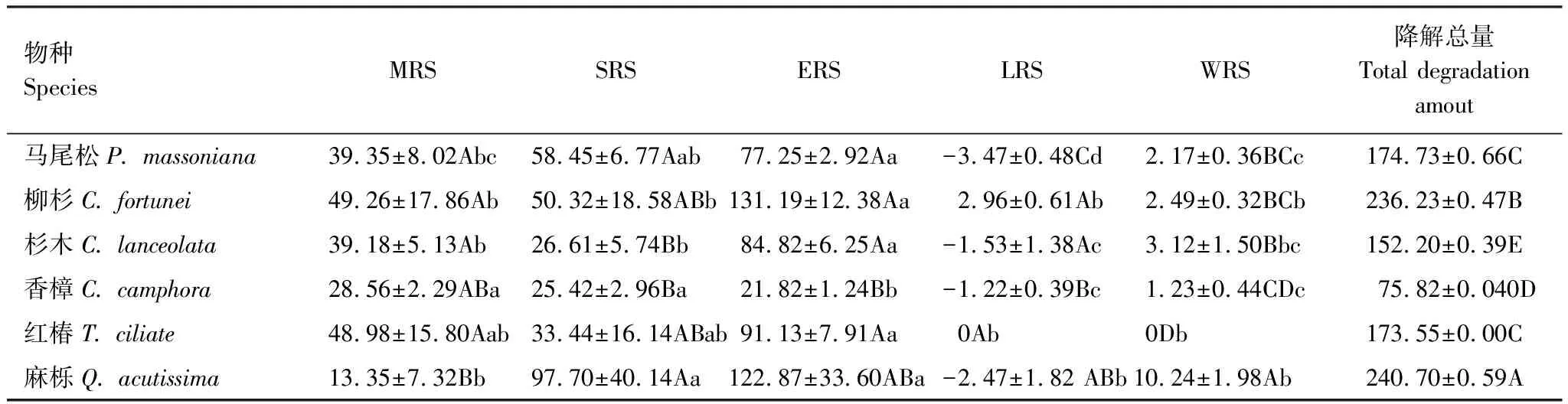
物种SpeciesMRSSRSERSLRSWRS降解总量Total degradation amout马尾松P. massoniana39.35±8.02Abc58.45±6.77Aab77.25±2.92Aa-3.47±0.48Cd2.17±0.36BCc174.73±0.66C柳杉C. fortunei49.26±17.86Ab50.32±18.58ABb131.19±12.38Aa2.96±0.61Ab2.49±0.32BCb236.23±0.47B杉木C. lanceolata39.18±5.13Ab26.61±5.74Bb84.82±6.25Aa-1.53±1.38Ac3.12±1.50Bbc152.20±0.39E香樟C. camphora28.56±2.29ABa25.42±2.96Ba21.82±1.24Bb-1.22±0.39Bc1.23±0.44CDc75.82±0.040D红椿T. ciliate48.98±15.80Aab33.44±16.14ABab91.13±7.91Aa0Ab0Db173.55±0.00C麻栎Q. acutissima13.35±7.32Bb97.70±40.14Aa122.87±33.60ABa-2.47±1.82 ABb10.24±1.98Ab240.70±0.59A
同列不同的大写字母表示同一分解时期不同物种多酚类物质降解量之间差异显著(P<0.05),同行不同的小写字母表示同一物种不同分解时期多酚类物质降解量之间差异显著(P<0.05)。MRS: 微量降雨期, Micro rainy stage;SRS: 春季少雨期, Spring rainy stage;ERS: 雨季前期, Early stage of rainy season;LRS: 雨季后期, Later stage of rainy season;WRS: 冬季少雨期, Winter brief rainy stage。数据为平均值±标准差,n=3
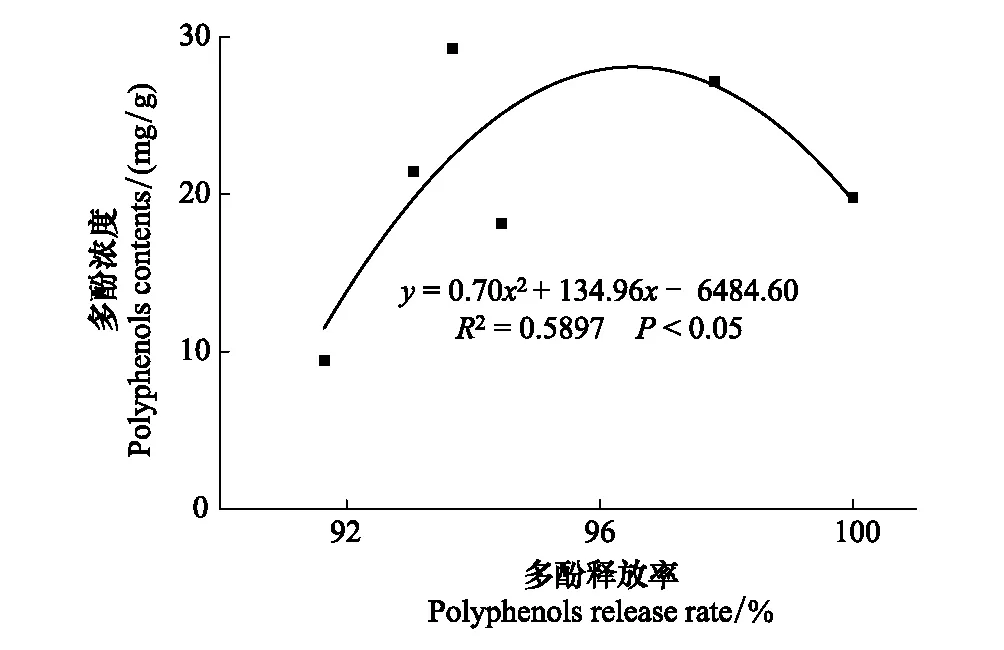
图4 常绿阔叶林6个树种凋落叶多酚类物质降解率与多酚类物质初始浓度的关系Fig.4 Relationships between polyphenols degradation rates and initial polyphenols contents of foliar litter of six tree species in the subtropical evergreen broadleaved forest
3 讨论
植物多酚类物质以凋落物和根系分泌物的形式进入到土壤后能改善土壤环境,提高微生物活性,有利于提高土壤中营养元素的有效性[24- 25],对植物-凋落物-土壤之间的相互作用产生重要影响。植物多酚类物质是凋落物的主要组分,它可通过化感作用或者形成蛋白-单宁复合体“屏障”,阻碍分解者活动,抑制凋落物分解过程,进而促进土壤腐殖质的形成,将更多的有机碳固定在土壤中[7]。亚热带常绿阔叶林凋落物分解过程由生物降解主导,凋落物的生物降解其实质是凋落物在分解酶系统作用下的生物化学过程[22, 26]。多酚氧化酶是凋落物多酚类物质降解的关键酶[6],它主要来源于土壤微生物与土壤动物释放的胞外酶,能将植物残体中多酚类物质转化为腐殖质组分,同时也参与木质素的降解[27- 28]。降水、温度等通过影响分解者群落结构与活性控制着整个分解过程。然而,本研究发现,6种凋落叶在分解初期(微量降雨期和春季少雨期)多酚类物质含量明显减少(图2),多酚类物质在这两个时期也呈现出明显的降解释放过程,占全年降解率的42.16%—71.20%(图3和表2)。凋落叶分解初期,降水量少,温度较低,这均不利于土壤微生物和动物的活动;此时期内多酚氧化酶的活性也较低,更加不利于多酚类物质的生物降解[29]。凋落物分解初期多酚类物质呈现大量降解释放的原因可能是由于低温和干旱导致的机械破碎所造成的物理损失。前期研究发现,此时期机械破碎导致凋落叶出现明显的质量损失[22],同时对凋落叶木质素和纤维素的降解也有一定的贡献[21]。故凋落叶分解初期强烈的机械破碎同时会导致这一时期多酚类物质的降解损失[30]。随着分解时间的进行,凋落叶分解进入水热条件较好的雨季,大量的土壤微生物和动物在凋落叶上聚集、生长、繁殖,加速凋落叶的分解进程[22]。与其他分解时期相比,雨季前期凋落叶多酚类物质的含量呈现出急剧减少的现象,凋落叶多酚类物质降解释放也大量发生于此时期(图2、图3和表2)。其原因可能有以下几点:(1) 分解初期,强烈的机械破碎会严重破坏凋落叶中蛋白-单宁复合体结构,多酚类物质失去“屏障”的保护,有利于多酚类物质在雨季时期的降解[7];(2) 季节性降雨期间,凋落物分解所处的水、热条件较好,土壤生物活动频繁加速多酚类物质的降解;(3) 土壤微生物大量生长,释放出更多的多酚氧化酶,同时多酚氧化酶在该时期内具有较高的活性[31],有利于其降解;(4) 凋落叶分解过程中产生的小分子量酚类物质随即被雨季前期较多的降水淋溶到土壤中[32]。至雨季前期结束时,凋落叶多酚类物质的含量降低至一个极低的水平(5mg/g),此后一直处于动态平衡状态,在雨季后期和冬季少雨期,6种凋落叶多酚类物质含量趋于稳定,均没有表现出明显的降解特征(图3),这可能是由于多酚类物质形成了稳定的腐殖质的缘故[33- 34]。
本研究发现,凋落叶多酚类物质降解过程受树种组成和分解时期的影响,不同树种凋落叶在不同分解时期降解量差异显著(表2)。这是因为不同树种凋落叶所含的多酚类物质种类及其相对比例明显不同,其结构存在很大差异[35],因此在不同的分解时期呈现出明显不同的降解释放特征。然而,本研究并未区分鉴定6种凋落叶多酚类物质的具体组分,以及水解单宁和缩合单宁的相对比例,以后应加强凋落物分解过程中多酚类物质不同组分对季节性降雨的响应等相关研究。树种组成影响着凋落物不同组分的初始含量,对凋落物初始基质质量具有决定作用,进而调节凋落物整个分解过程[20, 36]。本研究也发现凋落叶多酚类物质的初始浓度与其最终降解率呈现出显著的二次函数关系(图4)。而不同分解时期则是通过影响降雨、温度等环境因子调节土壤生物群落结构与活性以及胞外酶活性进而作用于凋落叶的分解过程[22]。
综上所述,四川盆地亚热带常绿阔叶林6个树种凋落叶多酚类物质降解在各个分解时期呈现出明显不同的动态变化特征。受季节性降雨和树种因素共同调控,凋落叶多酚类物质自微量降雨期起至雨季前期止,多酚类物质含量迅速下降;在降水量较多的雨季前期,凋落叶多酚类物质降解量较大。由此可见,降水量是湿润亚热带常绿阔叶林凋落物多酚类物质降解释放的关键驱动因子之一,树种组成是影响凋落叶多酚类物质降解动态的内部因子。以上结果可为更加清晰地认识亚热带常绿阔叶林凋落物分解过程提供一定的理论依据。
参考文献(References):
[1] 杨万勤, 邓仁菊, 张健. 森林凋落物分解及其对全球气候变化的响应. 应用生态学报, 2007, 18(12): 2889- 2895.
[2] Berg B, McClaugherty C. Plant Litter: Decomposition, Humus Formation, Carbon Sequestration. Berlin, Germany: Springer, 2003.
[3] 孙达旺. 植物单宁化学. 北京: 中国林业出版社, 1992.
[4] 张力平, 孙长霞, 李俊清, 刘艳红. 植物多酚的研究现状及发展前景. 林业科学, 2005, 41(6): 157- 162.
[5] 秦小玲. 北方干旱地区几种植物多酚含量动态研究[D]. 北京: 北京林业大学, 2006.
[6] 钟哲科, 王人潮, 江波. 森林土壤有机质层中多酚类物质的生态反馈意义. 应用生态学报, 2003, 14(3): 341- 344.
[7] Northup R R, Dahlgren R A, McColl J G. Polyphenols as regulators of plant-litter-soil interactions in northern California′s pygmy forest: a positive feedback? Biogeochemistry, 1998, 42(1/2): 189- 220.
[8] Kazakou E, Vile D, Shipley B, Gallet C, Garnier E. Co-variations in litter decomposition, leaf traits and plant growth in species from a Mediterranean old-field succession. Functional Ecology, 2006, 20(1): 21- 30.
[9] Aerts R, De Caluwe H, Beltman B. Plant community mediated vs. nutritional controls on litter decomposition rates in grasslands. Ecology, 2008, 84(12): 3198- 3208.
[10] Kalburtji K L, Mosjidis J A, Mamolos A P. Litter dynamics of low and high tannin sericea lespedeza plants under field conditions. Plant and Soil, 1999, 208(2): 271- 281.
[11] Driebe E M, Whitham T G. Cottonwood hybridization affects tannin and nitrogen content of leaf litter and alters decomposition. Oecologia, 2000, 123(1): 99- 107.
[12] Ndibe T O, Onwumere G B, Bulus T. Litter decomposition and release of nutrients formEucalyptuscamaldulensisleaf on Eucalypt plantation soils. World Scientific News, 2017, 62: 24- 45.
[13] Ibrahima A, Ntonga J C, Ze A D M. Litter decomposition and nutrient dynamics in tropical rainforests of Ebom, Southwestern Cameroon: effects of logging-disturbed. Global Journal of Botanical Science, 2016, 4(1): 24- 36.
[14] He W, Wu F Z, Yang W Q, Tan B, Zhao Y Y, Wu Q Q, He M. Lignin degradation in foliar litter of two shrub species from the gap center to the closed canopy in an alpine fir forest. Ecosystems, 2016, 19(1): 115- 128.
[15] Yue K, Wu F Z, Yang W Q, Zhang C, Peng Y, Tan B, Xu Z F, Huang C P. Cellulose dynamics during foliar litter decomposition in an alpine forest meta-ecosystem. Forests, 2016, 7(8): 176- 176.
[16] Mäkelä M R, Lundell T, Hatakka A, Hildén K. Effect of copper, nutrient nitrogen, and wood-supplement on the production of lignin-modifying enzymes by the white-rot fungusPhlebiaradiata. Fungal Biology, 2013, 117(1): 62- 70.
[17] 卜涛, 张水奎, 宋新章, 江洪. 几个环境因子对凋落物分解的影响. 浙江农林大学学报, 2013, 30(5): 740- 747.
[18] 钟章成. 常绿阔叶林生态系统研究. 重庆: 西南师范大学出版社, 1992.
[19] Torres I F, Bastida F, Hernández T, Bombach P, Richnow H H, García C. The role of lignin and cellulose in the carbon-cycling of degraded soils under semiarid climate and their relation to microbial biomass. Soil Biology and Biochemistry, 2014, 75: 152- 160.
[20] García-Palacios P, McKie B G, Handa I T, Frainer A, Hättenschwiler S. The importance of litter traits and decomposers for litter decomposition: a comparison of aquatic and terrestrial ecosystems within and across biomes. Functional Ecology, 2016, 30(5): 819- 829.
[21] 马志良, 高顺, 杨万勤, 吴福忠. 亚热带常绿阔叶林区凋落叶木质素和纤维素在不同雨热季节的降解特征. 生态学杂志, 2015, 34(1): 122- 129.
[22] 马志良, 高顺, 杨万勤, 吴福忠, 谭波, 张玺涛. 亚热带常绿阔叶林6个常见树种凋落叶在不同降雨期的分解特征. 生态学报, 2015, 35(22): 7553- 7561.
[23] 马志良, 高顺, 杨万勤, 吴福忠. 亚热带常绿阔叶林凋落叶分解过程中氮和磷在不同雨热季节的释放动态. 应用与环境生物学报, 2015, 21(2): 308- 315.
[24] 安树青. 湿地生态工程. 北京: 化学工业出版社, 2003.
[25] 付美云, 周立祥. 植物多酚在环境保护与农业生产中的应用. 应用生态学报, 2004, 15(9): 1673- 1677.
[26] García-Palacios P, Shaw E A, Wall D H, Hättenschwiler S. Temporal dynamics of biotic and abiotic drivers of litter decomposition. Ecology Letters, 2016, 19(5): 554- 563.
[27] 宋影, 辜夕容, 严海元, 毛文韬, 吴雪莲, 万宇轩. 中亚热带马尾松林凋落物分解过程中的微生物与酶活性动态. 环境科学, 2014, 35(3): 1151- 1158.
[28] 赵恒毅, 耿玉清, 杨英, 周红娟, 张海兰, 王玲, 赵广亮. 北京低山区油松林和元宝枫林凋落物酶活性研究. 中南林业科技大学学报, 2016, 36(6): 23- 28.
[29] Veres Z, Kotroczó Z, Fekete I, Tóth J A, Lajtha K, Townsend K, Tóthmérész B. Soil extracellular enzyme activities are sensitive indicators of detrital inputs and carbon availability. Applied Soil Ecology, 2015, 92: 18- 23.
[30] Martins R T, Melo A S, Gonçalves J F Jr, Hamada N. Leaf-litter breakdown in urban streams of Central Amazonia: direct and indirect effects of physical, chemical, and biological factors. Freshwater Science, 2015, 34(2): 716- 726.
[31] 郝建朝, 吴沿友, 连宾, 吴春笃. 土壤多酚氧化酶性质研究及意义. 土壤通报, 2006, 37(3): 470- 474.
[32] 陆丽芳. 珠芽蓼凋落物中酚类物质分解动态研究[D]. 兰州: 兰州大学, 2015.
[33] 高艳, 马红亮, 高人, 尹云锋, 陈仕东, 章伟, 朱祥妹, 杨玉盛. 模拟氮沉降对森林土壤酚类物质和可溶性糖含量的影响. 土壤, 2014, 46(1): 41- 46.
[34] Ni X Y, Yang W Q, Tan B, He J, Xu L Y, Li H, Wu F Z. Accelerated foliar litter humification in forest gaps: dual feedbacks of carbon sequestration during winter and the growing season in an alpine forest. Geoderma, 2015, 241- 242: 136- 144.
[35] Halvorson J J, Gonzalez J M, Hagerman A E, Smith J L. Sorption of tannin and related phenolic compounds and effects on soluble-N in soil. Soil Biology and Biochemistry, 2009, 41(9): 2002- 2010.
[36] Veen G F, Sundqvist M K, Wardle D A. Environmental factors and traits that drive plant litter decomposition do not determine home-field advantage effects. Functional Ecology, 2015, 29(7): 981- 991.
