BDNF对缺糖缺氧小鼠伏隔核中突触前膜蛋白Synapsin-1的影响
2018-06-22喻晓路傅慧
喻晓路 ,傅慧
1.徐州医科大学江苏省麻醉学重点实验室,江苏徐州 221004;2.淄博市第一医院神经内一科,山东淄博 255000
突触是神经元上不可或缺的一部分,它在维持神经元之间相互联系方面起到巨大作用[1]。正确的突触形成是神经系统结构和功能的基础,突触形成用突触前膜蛋白Synapsin-1进行表示[2]。BDNF(brain derived neurotropic factor,脑源性神经生长因子)是一种重要的神经因子,在生理环境下具有促进突触的形成、维持神经系统的功能[3-6]。伏隔核(nucleus accumbens,NAc)是中脑一边缘多巴胺系统环路的重要核团,NAc具有行为调控、镇痛作用、参与精神分裂症的产生、药物成瘾、学习记忆和调节心血管活动及调节运动活动等功能[7]。脑组织的缺糖缺氧是脑缺血患者的主要症状之一,其对脑组织中的神经元会产生损伤,尤其是对神经元突触有着很大的影响[8]。该次对比了脑片培养技术和细胞培养技术,认为脑片培养技术与细胞培养技术相比更多的保留了细胞和组织结构,能够更好的模拟生理状态,并且操作更简便,对实验设备的要求也不高[9-10]。该实验采用脑片培养的方法,目前此方法已经成熟,见图1,图中神经元形态清晰。该实验于2017年12月—2018年2月期间在徐州医科大学麻醉学重点实验室将18只小鼠中共随机分为3组,对小鼠NAc脑区的脑片进行缺糖缺氧处理和复灌,并与加入BDNF的处理组进行比较,对Synapsin-1蛋白的表达量进行测定,明确BDNF在缺糖缺氧条件下小鼠NAc脑区的作用,为脑缺血病患者所进行溶栓治疗的方法提供有力的实验依据。
图1 脑片培养伏隔核HE染色20X
1 资料与方法
1.1 一般资料
SPF级昆明小鼠18只,体重25~30 g,购自济南朋悦实验动物繁育有限公司,标准化饲养。
1.2 仪器和试剂
材料:BDNF(2837)购自 TOCRIS 公司,RIPA 裂解液(KGP702-100)购自凯基生物公司,低糖DMEM培养基(ABB210359)和 EBSS 培养基(AB10134597)均购自HyClone公司,青链霉素混合液(VC2003)购自 VICMED 公司,Synapsin-1 (5297)-抗购自 Cell Signaling Technology 公司,GAPDH (10494)-抗购自proteintech公司,辣根过氧化物酶标记的山羊抗兔IgG二抗 (A0208)和BCA蛋白浓度测定试剂盒(P0009)购自碧云天生物技术有限公司,ECL发光试剂盒(AC36131)购自 bioworld 公司,Transwell 24 孔板细胞培养小室(3413)购自Corning公司,PVDF膜(IPVH00010)购自Immobilon公司,自动震动切片机购自莱卡公司,化学发光仪购自BIO-RAD公司,其余自配液体试剂均购自sigma公司。自配溶液:高渗糖溶液Sucrose 254 mM,D-Glucose 10 mM,NaH2PO41.25 mM,NaHCO324 mM,MgSO4·7H2O2mM,KCl 3mM,CaCl2·2H2O 2 mM,用去离子水溶解。使用前通入95%O2+5%CO230 min。
1.3 实验方法
1.3.1 脑片制备实验动物经七氟烷诱导麻醉后,迅速断头,然后用剪刀剪开两耳间的皮肤直至两鼻间,然后翻转皮肤,暴露颅骨。用眼科剪去掉小鼠颅骨,暴露全脑。随后用眼科镊伸入脑前端下部的嗅球处,轻轻挑起脑的前端,剪断脑神经,翻转全脑,放入冰冷、预先通95%O2+5%CO2混合气 30 min的高渗糖溶液中,放置1~2 min。取出全脑,除去小脑和嗅球,用刀片切取鼠脑前中部,迅速用502胶水将脑组织块底部粘在自动震动切片机的缓冲槽中,用高渗糖溶液浸没组织块,设置自动震动切片机的切片速度、厚度和距离,切取含有NAc脑区的厚度为300 μm的脑片,大约可以取3~5片,用小刀切去多余组织,只保留NAc区域,整个过程在8 min内完成,高渗糖溶液温度维持在4℃。24孔培养板孔内加0.5 mL的脑片培养液,即低糖DMEM培养基,其中包括1%青链霉素混合液,将取好的脑片移入Transwell的小室中,尽量完全吸取高渗糖溶液,将小室放入培养板中,使培养基的液面刚好达到脑片的水平,但不漫过脑片,将培养皿置于37℃培养箱中的自制密闭容器中,自制密闭容器有输入和输出气体的导管。脑片培养基的组成:低糖DMEM+1%的青链霉素混合液。脑片的培养条件为:温度37℃,持续稳定通入95%O2+5%CO2混合气体,微生物培养箱中培养。要保证脑片的上表面充分暴露于气体环境中。
1.3.2 充N2法制备脑片缺氧缺糖模型 将缺氧缺糖组的脑片更换为EBSS培养基,并移进充入5%CO2+95%N2混合气体的密闭容器中,在37℃培养箱中是以0.5 L/min的流量充入混合气,于15 min后换成低糖培养基并复氧,通入95%O2+5%CO2混合气体,在37℃培养箱中复灌培养1 h。
1.3.3 分组 正常组:选取正常昆明小鼠6只,取NAc脑区,采用低糖DMEM培养基并通入95%O2+5%CO2混合气体进行培养。
缺糖缺氧复灌组(OGD/R):选取正常昆明小鼠6只,取NAc脑区,采用EBSS培养基并通入5%CO2+95%N2混合气体进行培养15 min,并进行复灌,即将带有脑片的小室置入加入DMEM培养基的培养皿中,并持续通入95%O2+5%CO2混合气体1 h。
缺糖缺氧复灌给药组(OGD/R+BDNF):选取正常昆明小鼠6只,取NAc脑区,采用在EBSS培养基中加入 BDNF(BDNF用量为 50 ng/μL)并通入 5%CO2+95%N2混合气体进行培养15 min,并进行复灌,即将带有脑片的小室置入加入DMEM培养基的培养皿中,并持续通入95%O2+5%CO2混合气体1 h。
1.3.4 对检测样品的制备和免疫印迹分析 在模型制作完成后,将脑片移入洁净的EP管中,加入蛋白裂解液,用电动匀浆器将组织打碎,充分裂解组织,4℃10 000转离心30 min,弃去沉淀,将上清液移入新EP管中,并做好标记。用BCA试剂盒进行蛋白定量,测定蛋白浓度,将样品配平,按照每孔20 ng的蛋白量进行上样跑电泳,采用半干转的方式将胶中的蛋白转到 PVDF膜上,5%的脱脂奶粉封闭 1 h,移入Synapsin-1(1:1 000)一抗和 GAPDH(1:5 000)一抗中4℃过夜,室温复温30 min,washing buffer清洗3次,5 min/次,转入HPR标记的兔二抗中孵育 40 min,washing buffer清洗3次,15 min/次。用化学发光仪进行曝光记录。用ImageJ软件进行定量分析。
1.4 统计方法
采用SPSS 13.0统计学软件进行数据处理,采用单因素方差分析,(one-way ANOVE)进行组间比较,P<0.05为差异有统计学意义。
2 结果
正常组Synapsin-1蛋白的相对表达量为(1.191 02±0.068 371),缺糖缺氧复灌组Synapsin-1蛋白的相对表达量为(0.7919 35±0.093 63),缺糖缺氧复灌给药组Synapsin-1蛋白的相对表达量为 (1.065 35±0.075 595)。通过对正常组、缺糖缺氧复灌组和缺糖缺氧复灌给药组的小鼠NAc脑区的Synapsin-1蛋白的相对表达量进行比较,通过蛋白免疫印迹的检测结果显示,缺糖缺氧复灌组与正常组相比Synapsin-1蛋白的相对表达量降低,差异有统计学意义(P<0.01),缺糖缺氧复灌给药组与缺糖缺氧复灌组相比Synapsin-1的蛋白相对表达量升高,差异有统计学意义(P<0.05)。缺糖缺氧复灌给药组与正常组相比Synapsin-1的蛋白相对表达量差异无统计学意义(P>0.05)。见图2。
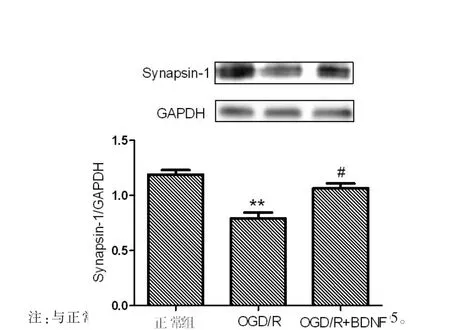
图2 Synapsin-1表达水平比较
3 讨论
脑部缺糖缺氧是脑缺血病患的主要症状,它可以导致人类残疾或者死亡,众多的研究表明脑组织的缺糖缺氧会诱发一系列的病理变化,甚至短暂性的缺糖缺氧也会对神经元造成一定的损伤[8]。由于神经元在接收和发送信号时必须要形成突触结构,所以对于突触的影响是最关键的[1]。有报道称BDNF具有神经保护和神经营养的作用,可以帮助神经损伤后传导功能的恢复[3-6]。缺糖缺氧对脑组织的损伤尤其表现在突触形成上,在与行为、疼痛、精神分裂症、药物成瘾、学习记忆和心血管活动及运动活动等功能密切相关的NAc脑区其代表突触形成的突触前膜蛋白Synapsin-1的表达量就有明显的降低。在缺糖缺氧的条件下加入BDNF,能有效减缓Synapsin-1蛋白表达量的降低。实验结果显示正常组Synapsin-1蛋白的相对表达量为 (1.191 02±0.068 371),缺糖缺氧复灌组Synapsin-1蛋白的相对表达量为 (0.791 935±0.093 63),缺糖缺氧复灌给药组Synapsin-1蛋白的相对表达量为(1.065 35±0.075 595)。缺糖缺氧复灌组与正常组相比Synapsin-1蛋白的相对表达量降低,差异有统计学意义(P<0.01),缺糖缺氧复灌给药组与缺糖缺氧复灌组相比Synapsin-1的蛋白相对表达量升高,差异有统计学意义(P<0.05)。缺糖缺氧复灌给药组与正常组相比Synapsin-1的蛋白相对表达量差异无统计学意义(P>0.05)。采用建立NAc脑区脑片缺糖缺氧的模型,很好的模仿了短暂性脑缺血的症状,同时加入BDNF的实验,验证了BDNF在短暂性缺糖缺氧对NAc脑区突触前膜蛋白有保护作用,以此说明在脑缺血患者的治疗上如果使用BDNF会有效缓解由于缺糖缺氧造成的神经元的损伤,对于BDNF未来运用于临床治疗上具有参考价值。
现有的报道称BDNF作为一种重要的脑源性神经生长因子对于脑神经元都起到很好的保护和营养作用,其中也包括NAc脑区,将 BDNF注入老年大鼠伏隔核可以改善认知和结构突触可塑性[11]。 而对Sy napsin-1蛋白在伏隔核的研究仅限于抑郁症等精神类疾病的研究上,文献报道中提到的使用VGF在伏隔核中的Synapsin-1蛋白的表达会有变化[12]。对于由于脑缺血所造成的缺糖缺氧症状而引起对于神经元的损伤方面却没有研究,该的研究正好填补了这一空白。
综上所述,BDNF在小鼠伏隔核缺糖缺氧条件下,Synapsin-1蛋白的表达量比未使用BDNF的蛋白表达量升高,说明BDNF可以有效的提高神经元突触前膜蛋白的表达,从而说明可以保护神经元,给BDNF的临床应用提供了实验依据,若对BDNF的作用机制和作用效果进行更进一步的研究,将会改善由于脑缺血造成的神经系统疾病的治疗方法。此研究前景非常广阔。
[1]白江涛,龚理,赵淑敏,等.黄芩茎叶总黄酮对缺血再灌注大脑皮质神经元和突触超微结构的保护作用[J].中华老年心脑血管病杂志,2015,17(10):1091-1093.
[2]杨国帅,周小艳,周治平,等.亚低温对全脑缺血性癫痫大鼠认知功能和海马synapsinⅠ表达及突触超微结构的影响[J].实用医学杂志,2015,31(14):2261-2264.
[3]刘志娟.脑源性神经营养因子在突触可塑性中的作用[J].国际神经病学神经外科学杂志,2015,42(2):185-188.
[4]Koyama Y,Tsujikawa K,Matsuda T,et al.Intracerebr oventricular administration of an endothelin ETB receptor agonist increases expressions of GDNF and BDNF in rat brain[J].European Journal of Neuroscience,2015,18(4):887-894.
[5]Luo L,Liu X L,Li J,et al.Macranthol promotes hippocampal neuronal proliferation in mice via BDNF-TrkB-PI3K/Akt signaling pathway[J].European Journal of Pharmacology,2015(762):357-363.
[6]Sasi M,Vignoli B,Canossa M,et al.Neurobiology of local and intercellular BDNF signaling:[J].Pflügers Archiv-European Journal of Physiology,2017,469(5):1-18.
[7]刘荣国,林星武,方向宇,等.背根神经节脉冲射频对神经病理性痛大鼠脊髓IRF8和伏隔核BDNF表达的影响[J].中华麻醉学杂志,2017,37(5):540-543.
[8]杜成昊,万海同,周惠芬,等.谷红注射液对新生乳鼠海马神经元缺氧缺糖损伤的保护作用 [J].中华中医药杂志,2017(1):289-293.
[9]董梅,程树彬,郭彦芳,等.器官型脑片培养 OGD复氧复糖模型中丁苯酞对于 bcl-2/bax、及 bim蛋白的调节作用[J].中风与神经疾病,2017,34(1):16-20.
[10]李钊,程树彬,郭彦芳,等.器官型脑片糖氧剥夺模型的建立[J].脑与神经疾病杂志,2017,25(11):707-710.
[11]Li M,Dai F R,Du X P,et al.Infusion of BDNF into the nucleus accumbens of aged rats improves cognition and structural synaptic plasticity through PI3K-ILK-Akt signaling[J].Behavioural Brain Research,2012,231(1):146.
[12]Jiang C,Lin W J,Sadahiro M,et al.VGF function in depression and antidepressant efficacy[J].Mol Psychiatry,2017.
