原发性高血压患者血清同型半胱氨酸、脂蛋白相关磷脂酶A2、脂联素及尿酸水平变化及与颈动脉粥样硬化的关系
2018-06-21刘军利
刘军利
(安阳市人民医院心血管内科,河南 安阳 455000)
原发性高血压是临床最常见的慢性病之一,长时间存在易引起心、脑、肾等多器官功能损害,不仅具有较高的致残率和致死率,而且还会给家庭和社会带来沉重负担。高血压诱发的动脉粥样硬化是造成各种器官功能损害等并发症的主要原因,如何对原发性高血压患者动脉粥样硬化进行有效预测,以采取积极有效的治疗,是改善患者预后的关键。临床上目前多采用血管彩色超声,检测IMT来反映颈动脉粥样硬化程度,但超声检测需要特殊仪器,并且结果重复性不高,因此限制了其进一步应用[1]。因此,发现寻找其它有效指标来反映原发性高血压患者动脉粥样硬化逐渐成为临床医师关注的焦点。
同型半胱氨酸(homocysteine,HCY)为含硫氨基酸,是人体蛋氨酸循环代谢中间产物,近年来被用于心脑血管疾病危险分层及预后评估,认为其与动脉粥样硬化的发生密切相关[2]。脂蛋白相关磷脂酶 A2 (lipoprotein-associated phospholipase A2,Lp-PLA2),又称血小板活化因子乙酰水解酶,是近年来新发现的一种炎性指标,能够灵敏的反映体内的炎症状态,参与了动脉粥样硬化过程[3]。脂联素(adiponectin,APN)是一种脂肪组织分泌的保护性脂肪因子,近年来国外研究显示,低脂联素血症成为心血管疾病发生的重要危险因素[4]。尿酸(uric acid,UA)水平升高可诱发高血压,进而影响心血管系统,高尿酸血症也被认为是心血管疾病发生的危险因素[5]。为此,本研究对我院2015年3月至2017年3月期间162例原发性高血压患者血清HCY、Lp-PLA2、APN、hs-CRP、UA 水平进行检测,分析其与高血压程度以及动脉粥样硬化程度的相关性,现报告如下。
1 资料与方法
1.1 一般资料 2015年3月至2017年3月期间我院收治的原发性高血压患者162例,收缩压≥140mmHg、舒张压≥90mmHg,诊断均符合《中国高血压防治指南》中的相关诊断标准,排除继发性高血压,合并严重肝、心、肾等脏器疾病、肿瘤、免疫缺陷疾病、风湿性疾病、血液系统疾病,以及服用影响指标检测的药物者。根据指南进一步将收缩压140~159mmHg或舒张压90~99mmHg患者归为1级高血压组,共58例,收缩压160~179mmHg或舒张压100~109mmHg归为2级高血压,共65例,收缩压≥180mmHg或舒张压≥110mmH归为3级高血压组,共39例。根据颈总动脉彩色超声检查的颈动脉内膜中层厚度 (intima-media thickness,IMT),将 IMT<0.9mm 患者归为 IMT 正常组,共 72例,IMT 0.9-1.2mm 患者归为 IMT 增厚组, 共 61例,IMT>1.2mm且向管腔突起患者归为斑块形成组,共29例。另选择同期在我院进行健康查体的109例体检者作为对照组,与原发性高血压患者一般资料比较见表1。
1.2 检测方法 HCY采用循环酶法,UA采用尿酸氧化酶法,试剂由四川迈克生物科技有限公司提供,采用美国贝克曼库尔特AU2700型全自动生化分析仪进行检测。Lp-PLA2、APN采用酶联免疫吸附法,试剂由天津康尔克生物技术有限公司提供,在科华ST-360酶标仪上进行检测。
1.3 统计学方法 经 Kolmogorov-Smirnov分析,各组水平数据呈正态分布,用平均值±标准差(±s)表示,组间比较采用方差分析,组间两两比较采用LSD-t检验,P<0.05为差异有统计学意义, 采用统计学分析软件SPSS 19.0进行分析。
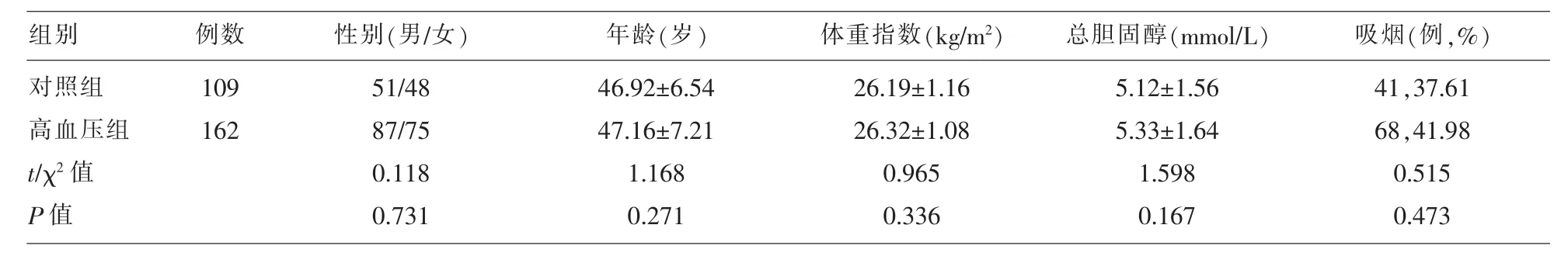
表1 两组的一般资料比较
2 结果
2.1 原发性高血压患者血清 HCY、Lp-PLA2、APN、UA水平表达 原发性高血压组血清 HCY、Lp-PLA2、UA 水平高于对照组(P<0.05),血清 APN 水平低于对照组,两组比较差异具有统计学意义(P<0.05)。 见表 2。
2.2 不同级别原发性高血压患者血清HCY、Lp-PLA2、APN、UA水平表达 方差分析显示,1级高血压组、2级高血压组、3级高血压组血清HCY、Lp-PLA2、APN、UA 水平存在统计学差异 (P<0.05)。进一步t检验分析,显示随着高血压级别的增加,血清 HCY、Lp-PLA2、UA 水平不断升高(P<0.05),血清 APN 水平不断下降(P<0.05)。 见表 3。
2.3 不同颈动脉粥样硬化程度原发性高血压患者血清 HCY、Lp-PLA2、APN、UA 水平表达 方差分析显示,IMT正常组、IMT增厚组、斑块形成组血清HCY、Lp-PLA2、APN、UA 水平存在统计学差异(P<0.05)。进一步t检验分析,显示随着颈动脉粥样硬化程度的增加,血清 HCY、Lp-PLA2、UA 水平不断升高(P<0.05),血清 APN 水平不断下降(P<0.05)。见表4。
3 讨论
原发性高血压是动脉粥样硬化重要危险因素之一,而动脉粥样硬化又是心脑血管疾病的病理学基础,两者可互为因果关系,成为严重心脑血管疾病的重要病因[6]。Hcy能够氧化修饰低密度脂蛋白为氧化型低密度脂蛋白,促进泡沫细胞的形成,能够破坏内皮细胞,减少内皮细胞一氧化氮合酶的生成,降低一氧化氮水平,导致内皮细胞的抗氧化能力下降,引发血管收缩和血液减慢,导致内皮细胞功能紊乱[7]。血Hcy水平升高还可增加血清氧自由基和过氧化氢的生成,激活炎症反应,还可增加血栓素A2水平,促进血小板聚集与载体脂蛋白B形成致密的复合物,改变凝血因子功能,激活体内凝血系统,参与动脉粥样硬化的形成[8]。还有研究显示[9],Hcy可导致内皮细胞基因表达的改变,诱导内皮细胞凋亡,从而启动动脉粥样硬化过程。曹立平等[10]探讨原发性高血压患者血Hcy水平与左心室肥厚的关系,发现随高血压严重程度的加重,血Hcy水平出现升高,同时左心室肥厚的高血压患者血浆Hcy水平高于无左心室肥厚的高血压患者,Hcy与原发性高血压的发病及进展关系密切,血浆Hcy的水平可反映原发性高血压患者左心室肥厚病情的严重程度。凌聪等[11]探讨血清Hcy在原发性高血压患者颈动脉粥样硬化早期诊断中的作用,发现原发性高血压患者颈动脉粥样硬化组血清Hcy高于非颈动脉粥样硬化组,其用于诊断颈动脉粥样硬化的敏感性和特异性分别达87.1%和76.3%,提示Hcy可用于原发性高血压患者颈动脉粥样硬化早期诊断。本研究结果显示,随着颈动脉硬化程度的加重,原发性高血压患者血清Hcy水平不断升高。
表 2 两组血清 HCY、Lp-PLA2、APN、UA水平比较(±s)

表 2 两组血清 HCY、Lp-PLA2、APN、UA水平比较(±s)
注:与对照组比较,aP<0.05。
组别 例数对照组高血压组109 162 t值 P值HCY(mmol/L) Lp-PLA2(μg/L) APN(mg/L) UA(μmol/L)12.13±3.26 26.15±7.28a 8.825<0.001 77.62±12.32 154.37±46.52a 11.156<0.001 29.31±9.23 16.39±6.28a 9.114<0.001 302.12±18.96 396.15±33.16a 6.521<0.001
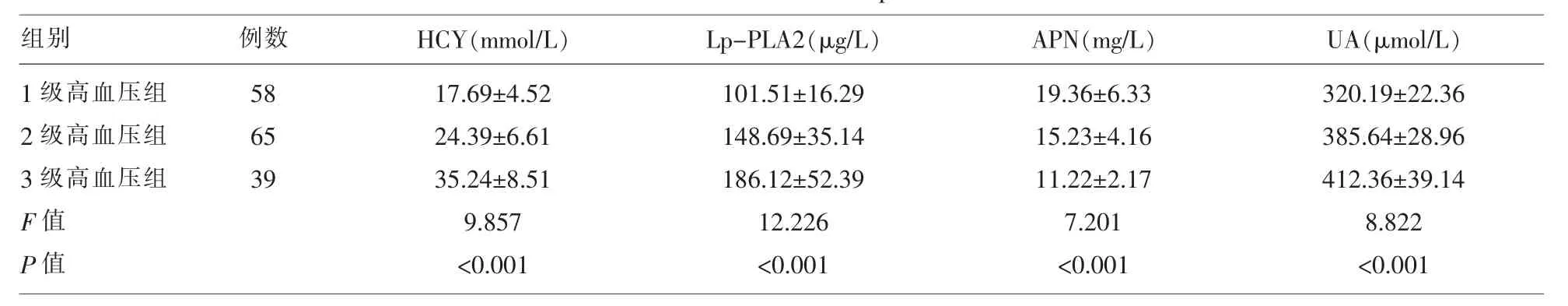
表3 不同级别原发性高血压患者血清HCY、Lp-PLA2、APN、UA水平表达

表4 不同颈动脉粥样硬化程度原发性高血压患者血清HCY、Lp-PLA2、APN、UA水平表达
Lp-PLA2是一种非钙依赖的丝氨酸脂酶,体内成熟的单核/巨噬细胞、肥大细胞及T淋巴细胞合成和分泌,能够结合并使其水解灭活血小板活化因子,受炎性介质的调节。循环中只有10%的Lp-PLA2与高密度脂蛋白结合,发挥抗动脉粥样硬化作用,而80%的Lp-PLA2与低密度脂蛋白结合,并随低密度脂蛋白运送到血管壁易受损伤的区域,将氧化的LDL水解成大量的溶血卵磷脂等有生物活性的促炎物质,增加斑块内炎症反应。同时斑块中的炎症细胞又可分泌更多的Lp-PLA2,促进斑块的持续增长,变脆弱、破裂和脱落,导致动脉粥样硬化的发生[12]。周祖勇等[13]发现发生心血管事件的原发性高血压患者Lp-PLA2水平要高于未发生心血管事件的原发性高血压患者,Lp-PLA2含量与心血管事件危险程度有关,其值越高,其发生心血管事件危险度越高。陈世豪等[14]探讨原发性高血压患者伴发颈动脉粥样硬化病变与Lp-PLA2的相关性,研究显示原发性高血压伴动脉粥样硬化患者Lp-PLA2水平高于单纯高血压患者,Lp-PLA2诊断原发性高血压伴发颈动脉粥样硬化的ROC曲线AUC达0.971,其诊断的敏感度、特异性、阳性预测值、阴性预测值和准确性分别为85.3%、97.1%、95.5%、90.3%、92.2%。 本 研 究 中 ,Lp-PLA2水平随高血压级别的增加以及动脉粥样硬化程度的增加,水平不断上升。
APN为胶原蛋白超家族成员之一,可与巨噬细胞上的补体C1q受体结合,激活腺嘌呤单核苷酸磷酸激酶等信号通路,参与机体糖和脂肪代谢。APN还可降低巨噬细胞对脂质的吸收,隔断单核细胞和内皮细胞的粘附,降低粘附分子释放,发挥抗动脉粥样硬化作用[15]。高凌俊等[16]研究显示,原发性高血压1、2、3级组APN的水平均低于健康对照组,并且与Lp-PLA2水平呈显著负相关性。冯奕习等[17]探讨原发性高血压患者血清APN对高血压急症的预测价值,发现原发性高血压患者血清APN水平明显低于健康体检者,并且原发性高血压合并高血压急症发作的患者血清APN水平明显低于普通原发性高血压患者,APN预测高血压急症的敏感度、 特异度分别达 88.89%、84.44%,ROC曲线下面积为0.75。本研究结果显示,原发性高血压组血清APN水平低于对照组,并且随着高血压级别的增加,血清APN水平不断下降,可用于高血压程度的一项判断指标。同时,血清APN水平在IMT正常组、IMT增厚组、斑块形成组存在统计学差异(P<0.05),还可用于动脉粥样硬化的判断。
UA能够刺激肾素血管紧张素系统,增加血管紧张素Ⅱ,同时在血UA的形成过程中,有大量氧自由基、过氧化氢等生成,能够促进脂质的过氧化和低密度脂蛋白的氧化,损伤内皮,参与高血压病情发展和动脉粥样硬化的形成[18]。王彦斌等[19]探讨原发性高血压与血UA水平的相关性,发现高血压组血UA水平明显高于对照组,3级高血压病人与2级高血压病人及1级高血压病人相比,血UA值明显增高,非条件Logistic回归分析示,血UA水平为高血压疾病的危险因素,与本研究发现相一致。刘傲亚等[20]探究原发性高血压患者血UA水平与左心室肥厚的相关性,经多因素Logistic回归分析显示,校正了年龄、性别、高血压病程等心血管危险因素,血UA仍是高血压患者左心室肥厚的独立危险因素。本研究中,血清UA水平随着IMT的增加水平不断升高,提示其与动脉粥样硬化的发生发展密切相关。
综上所述, 血清 HCY、Lp-PLA2、APN、UA 水平在原发性高血压患者中发生明显变化,可用于高血压病情及动脉粥样硬化程度判断的指标,对原发性高血压的有效防控具有重要意义。
[1]Wu D,Li C,Chen Y,et al.Influence of blood pressure variability on early carotid atherosclerosis in hypertension with and without diabetes[J].Medicine(Baltimore),2016,95(24):e3864.
[2]Spence JD.Rational Medical Therapy Is the Key to Effective Cardiovascular Disease Prevention[J].Can J Cardiol,201,33(5):626-634.
[3]Yang L,Liu Y,Wang S,et al.Association between Lp-PLA2 and coronary heart disease in Chinese patients[J].J Int Med Res,2017,45(1):159-169.
[4]Juarez-Rojas JG,Posadas-Sanchez R,Martinez-Alvarado MDR,et al.Association of Adiponectin with Subclinical Atherosclerosis in a Mexican-Mestizo Population[J].Arch Med Res,2017,48(1):73-78.
[5]汤俊峰,余喜然,朱虹,等.血清尿酸检验在老年冠心病患者诊断中的临床价值[J].实验与检验医学,2016,34(1):74-76.
[6]银孟卓.原发性高血压患者踝臂指数、同型半胱氨酸水平与颈动脉粥样硬化相关性分析[J].中国医学工程,2017,25(1):51-53.
[7]Klobu?níková K,?iarnik P,Siváková M,et al.Carotid intima-media thickness is not associated with homocysteine and vitamin D levels in obstructive sleep apnea[J].Scand J Clin Lab Invest,2017,77(4):263-266.
[8]Sun K,Song J,Liu K,et al.Associations between homocysteine metabolism related SNPs and carotid intima-media thickness:a Chinese sib pair study[J].J Thromb Thrombolysis,2017,43(3):401-410.
[9]Spence JD.Homocysteine lowering for stroke prevention:Unravelling the complexity of the evidence[J].Int J Stroke,2016,11(7):744-747.
[10]贾二娟.血清 Hcy、hs-CRP、IL-6 和 TNF-α 水平与急性脑梗死严重程度的关系[J].实验与检验医学,2017,35(3):382-384.
[11]凌聪,薛亮,李小悦.血清胱抑素C和同型半胱氨酸在原发性高血压患者颈动脉粥样硬化早期诊断中的应用 [J].中国医学创新,2016,13(26):108-111.
[12]Younus A,Humayun C,Ahmad R,et al.Lipoprotein -associated phospholipase A2 and its relationship with markers of subclinical cardiovascular disease:A systematic review [J].J Clin Lipidol,2017,11(2):328-337.
[13]周祖勇,梁金花,周红辉,等.超敏C反应蛋白和血尿酸及脂蛋白相关的磷脂酶A2与原发性高血压患者发生心血管事件的关系研究[J].中国实用医药,2015,10(21):1-2.
[14]陈世豪,谭柏松,张伟坚.原发性高血压伴颈动脉粥样硬化与脂蛋白相关磷脂酶A2活性水平相关性研究 [J].海南医学,2015,26(3):380-382.
[15]Sun L,Yang X,Li Q,et al.Activation of Adiponectin Receptor Regulates Proprotein Convertase Subtilisin/Kexin Type 9 Expression and Inhibits Lesions in ApoE-Deficient Mice[J].Arterioscler Thromb Vasc Biol,2017,37(7):1290-1300.
[16]高凌俊,谢祥妹,何凤屏,等.原发性高血压与脂联素、脂蛋白相关磷脂酶 A2的相关性 [J].国际检验医学杂志,2015,36(8):1026-1028.
[17]冯奕习,郑碧英,彭伟如.原发性高血压患者血清salusin-β和脂联素水平联合预测其高血压急症的价值 [J].中国医药科学,2016,6(15):143-145.
[18]Sharaf El Din UAA,Salem MM,Abdulazim DO.Uric acid in the pathogenesis of metabolic,renal,and cardiovascular diseases:A review[J].J Adv Res,2017,8(5):537-548.
[19]王彦斌,董星辉,任素芳.原发性高血压与血尿酸水平的相关性分析[J].中西医结合心脑血管病杂志,2016,14(16):1889-1891.
[20]刘傲亚,朱永芳,王宁,等.原发性高血压患者血尿酸水平与左心室肥厚的相关性[J].心肺血管病杂志,2016,35(5):362-365.
