重症急性胰腺炎患者外周血NK细胞上Tim-3的表达研究
2018-06-21刘文平谢勇诸葛雅丽
刘文平 ,谢勇 ,诸葛雅丽
(1、南昌大学第一附属医院检验科,江西 南昌330006;2、南昌大学基础医学院免疫学教研室,江西 南昌330006;3、南昌大学第一附属医院消化研究所,江西 南昌330006)
重症急性胰腺炎 (severe acute pancreatitis,SAP)是消化系统危重症疾病,病程进展快,患者早期即可出现全身炎症反应综合症(systemtic inflammatory response syndrome,SIRS),继而发展为多器官功能障碍综合症 (multiple organ dysfunction syndrome,MODS),病死率高达 20%~30%[1]。目前越来越多的学者认为抗炎-抑炎平衡紊乱致使机体不足以拮抗过度的炎症是重症急性胰腺炎发生的核心问题[2]。 自然杀伤(natural killer,NK)细胞作为机体免疫系统的重要组成部分,在抗感染、抗肿瘤及移植排斥中起着十分重要的作用,其中NK细胞在SAP发生发展过程中的作用也逐渐引起了人们的关注。
T细胞免疫球蛋白黏蛋白结构域相关分子3(T cell immunoglobulin-and mucin-domain-containing molecule-3,Tim-3)是 Tim 基因家族中的一个重要成员,是一个具有多种生物学功能的免疫调节分子[3]。Tim-3可通过与其配体Galectin-9结合可特异性诱导Th1细胞凋亡,从而负向调控Th1反应,是一种在T细胞耐受、自身免疫、慢性感染中有重要作用的负性共刺激分子[4]。近年研究证实,Tim-3可调控NK细胞的功能,参与机体免疫应答过程[5]。目前,尚未见有关SAP患者外周血NK细胞上Tim-3表达的报道。本研究应用流式细胞术检测SAP患者和健康志愿者外周血NK细胞表面Tim-3分子表达情况,初步探讨NK细胞上的Tim-3在SAP发生发展中的免疫学作用。
1 资料与方法
1.1 临床资料 选取南昌大学第一附属医院2016年6月至2017年6月收治的62例初诊SAP为研究对象,其中男38例,女24例,年龄22~80岁,中位年龄53岁。SAP患者均未进行过抗炎治疗、放疗、化疗、中西医结合治疗及生物治疗,且无合并其他肿瘤、自身免疫性疾病及感染性疾病等。健康对照组为同期南昌大学第一附属医院对照中心性别、年龄匹配的25例健康体检者,其中男17例,女8例,年龄25~76岁,中位年龄51岁,所有健康对照者既往体检,无感染性疾病及自身免疫性疾病等。所有研究对象均知情同意并签署知情同意书。
1.2 试剂和设备 抗人 Tim-3-PE、CD-56-PECy5、CD3-FITC、IgG1-PE 抗体均购自美国 eBioscience公司,人外周血溶血素购自美国Beckman Coulter公司,人淋巴细胞分离液购自美国Sigma公司,Cytomics FC 500型流式细胞仪购自美国Beckman Coulter公司。
1.3 实验方法
1.3.1 标本的收集 SAP患者入院第2d清晨空腹抽取抗凝静脉血,健康对照者对照当天清晨空腹抽取抗凝静脉血。抗凝静脉血标本完成临床检测后当天进行流式细胞检测。
1.3.2 流式细胞仪检测NK细胞上Tim-3的表达抗凝静脉血用密度梯度离心法获得外周血单个核细胞 (peripheral blood mononuclear cells,PBMC),PBMC采用200μl PBS重悬备用,每个流式管加入50μl细胞悬液,对照管加入 CD3-FITC、CD56-PECy5、IgGl-PE 各 5μl;测定管依次加入 CD3-FITC、CD56-PE-Cy5、Tim 3-PE 各 5μl, 室温避光温育15min, 加 PBS 2ml混匀,1500r/min 离心 5min,重复洗2次后弃上清液,加入PBS 500μl重悬细胞。将重悬的细胞避光上机检测。检测结束后采用Cytomics FC 500流式细胞仪软件对 NK (CD3-CD56+)细胞进行数据分析。
1.4 统计学处理 采用SPSS 17.0软件进行统计学处理。以 Kolmogorov-Smirnov检验(K-S 检验)对数据进行正态分布检验,符合正态分布计量资料以(±s)表示,两样本均数比较采用t检验;非正态分布的计量资料以中位数 (上四分位数,下四分位数)表示,两组间资料数据比较采用Mann-Whitney U检验。P<0.05表示差异有统计学意义。
2 结果
2.1 SAP患者外周血NK细胞检测结果 SAP患者与健康对照者外周血NK细胞占PBMC比例分别为(6.01±3.75)%和(12.51±3.41)%,SAP 患者外周血NK细胞占PBMC比例较健康对照者显著下降,差异有统计学意义(t=7.50,P<0.01),见图 1。

2.2 SAP患者外周血NK细胞上Tim-3的表达情况 SAP患者与健康对照者外周血NK细胞上Tim-3 表达水平分别为 [23.25 (9.63,44.33)]%和[9.60 (5.05,11.25)]%,SAP 患者外周血 NK 细胞上Tim-3表达水平较健康对照者显著升高,差异具有统计学意义(U=362.50,P<0.01),见图 2。
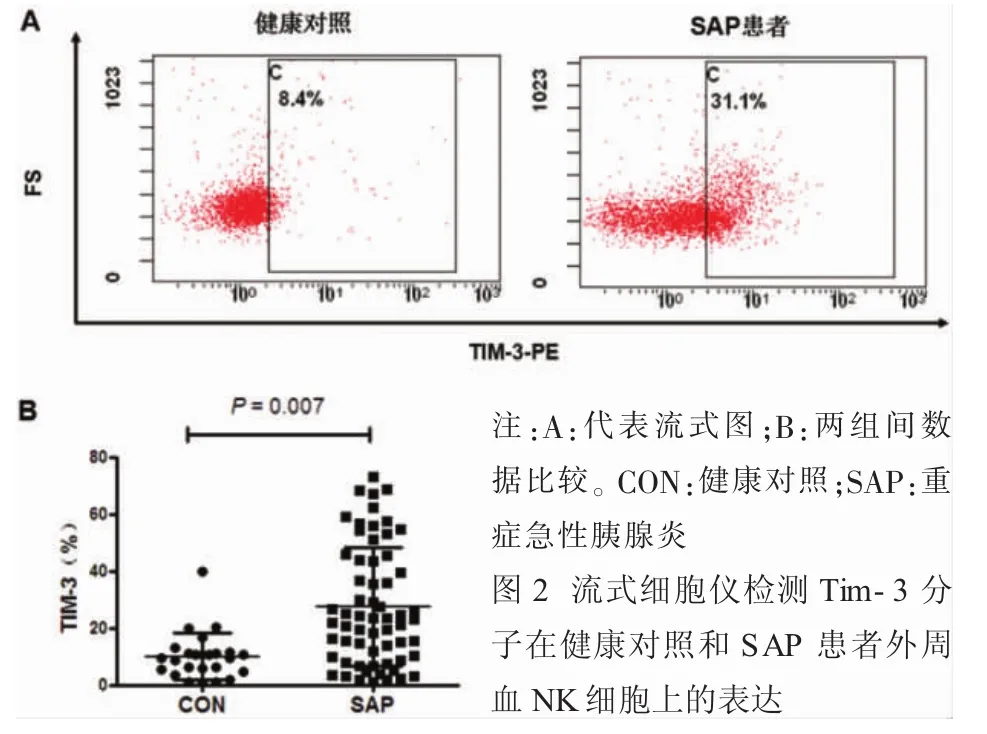
3 讨论
NK细胞是抵抗病原体的固有免疫反应的第一道防线,具有多种生物学功能,除分泌IFN-γ、TNF-α等细胞因子发挥直接抗感染外,NK细胞可与靶细胞密切接触,通过多种途径发挥杀伤效应。此外,NK细胞还通过杀伤未成熟DCs、活化CD4+T细胞及超活化巨噬细胞等,进行负反馈调节,降低发生免疫紊乱风险[6]。因此,NK细胞不仅对机体感染微生物有很好防御作用,也可防止由于微生物感染导致的过度免疫应答[7]。目前,关于SAP患者外周血NK细胞的比例研究较少,本研究表明SAP患者外周血NK细胞比例与健康者相比显著降低,低数量的NK细胞可能对机体的免疫防御功能有影响,使其不能有效发挥抗感染作用。
NK细胞的杀伤功能主要依赖于活化性受体与抑制性受体之间的相互平衡[8]。近年研究证实,NK细胞表面不仅表达活化性受体和抑制性受体,也表达着共刺激分子,其中负性共刺激分子是现今NK细胞功能研究的热点[9]。Tim-3是机体中重要的负性共刺激分子,在T淋巴细胞、巨噬细胞等均有表达[10]。随着研究的深入,研究者发现Tim-3在NK细胞也有表达,可调控NK细胞的功能,在感染性疾病及肿瘤的发生发展过程中均发挥重要作用[11]。如,在慢性乙肝感染过程中,NK细胞表面Tim-3表达显著升高,且Tim-3负性调控患者NK细胞的活性,导致NK细胞功能抑制,阻断Tim-3通路后可恢复NK功能[12]。Huang等[13]研究发现,在结核病患者中,外周血NK细胞Tim-3表达升高,阻断Tim-3通路后可增强NK细胞对结核菌的杀菌能力和抗原提呈功能。在肿瘤研究领域,Wang等[14]研究发现,胃癌患者Tim-3的表达水平显著高于健康对照,在发生转移或临床分期晚的胃癌患者,NK细胞上Tim-3的表达水平则更高,提示Tim-3在胃癌发生发展中发挥着一定作用。
本研究采用流式细胞术对62例初诊SAP患者及25例健康对照者外周血NK细胞表面Tim-3的表达进行了检测,结果发现SAP患者NK细胞表面Tim-3表达的阳性率显著高于健康对照者,提示,Tim-3可能参与了SAP患者NK细胞功能的调控。由于本研究样本数较少,今后我们将进一步扩大样本量,深入探讨SAP患者Tim-3对NK细胞的功能影响。
综上所述,本研究发现Tim-3在SAP患者外周血NK细胞上表达显著升高。进一步探究Tim-3在SAP中的生物学功能及其分子机制,或将为SAP的诊治提供新的靶点。
[1]Portelli M,Jones CD.Severe acute pancreatitis:pathogenesis,diagnosis and surgical management[J].Hepatobiliary Pancreat Dis Int,2017,16(2):155-159.
[2]方欢欢,熊姿,王文娟,等.外周血CD64、CD11b/CD18指数对急性胰腺炎并感染的早期诊断价值[J].实验与检验医学,2016,34(3):304-307.
[3]Hu XH,Tang MX,Mor G,et al.Tim-3:Expression on immune cells and roles at the maternal-fetal interface[J].J Reprod Immunol,2016,118:92-99.
[4]Das M,Zhu C,Kuchroo VK.Tim-3 and its role in regulating antitumor immunity[J].Immunol Rev,2017,276(1):97-111.
[5]Liu Y,Gao LF,Liang XH,et al.Role of Tim-3 in hepatitis B virus infection:An overview [J].World J Gastroenterol,2016,22(7):2294-2303.
[6]Peng H,Tian Z.Natural Killer Cell Memory:Progress and Implications[J].Front Immunol,2017,8:1143.
[7]Bi J,Tian Z.NK Cell Exhaustion[J].Front Immunol,2017,8:760.
[8]Chiossone L,Vienne M,Kerdiles YM,et al.Natural killer cell immunotherapies against cancer:checkpoint inhibitors and more[J].Semin Immunol,2017,31:55-63.
[9]Malmberg KJ,Carlsten M,Bj?rklund A,et al.Natural killer cellmediated immunosurveillance of human cancer[J].Semin Immunol,2017,31:20-29.
[10]Yu A,Zhang X,Li M,et al.Tim-3 enhances brain inflammation by promoting M1 macrophage polarization following intracerebral hemorrhage in mice[J].Int Immunopharmacol,2017,53:143-148.
[11]Das M,Zhu C,Kuchroo VK.Tim-3 and its role in regulating anti-tumor immunity[J].Immunol Rev,2017,276(1):97-111.
[12]Liu Y,Gao LF,Liang XH,et al.Role of Tim-3 in hepatitis B virus infection:An overview[J].World J Gastroenterol,2016,22(7):2294-2303.
[13]Huang Z,Yao F,Deng Z,et al.Elevated expression of Tim-3 on CD56dimCD16+NK cells correlates with disease severity of pulmonary tuberculosis[J].Int J Clin Exp Pathol,2017,10(5):5031-5038.
[14]Wang Z,Zhu J,Gu H,et al.The Clinical Significance of Abnormal Tim-3 Expression on NK Cells from Patients with Gastric Cancer[J].Immunol Invest,2015,44(6):578-589.
