桃花中绿原酸抗氧化活性的研究△
2018-06-21梁萱李嘉会梁永锋
梁萱,李嘉会,梁永锋*
(1.兰州军区兰州总医院 药剂科,甘肃 兰州 730000;2.宁夏师范学院 化学化工学院,宁夏 固原 756000)
桃花Prunuspersica是蔷薇科落叶乔木桃树的花,是一种民间常用中药。主治水肿,痰饮,脚气,便秘,利水通便,癫狂,闭经,疮疹等[1]。研究表明桃花中含有山奈酚、多糖、黄酮、绿原酸、维生素、蛋白质等多种对人体有益的活性成分[2-3]。绿原酸具有抗菌、抗氧化、清除自由基、抗衰老、抑制癌细胞突变、抗肿瘤、保护心血管、降低血压等药理作用[4-5]。自由基是人体代谢的产物,主要以超氧阴离子、羟基自由基和过氧化氢自由基等形式存在于人体内,人体中过多的自由基会破坏细胞膜,使血清抗蛋白酶失去活性,损伤基因导致细胞变异的出现和蓄积。大量资料已经证明,炎症,肿瘤、衰老、血液病、以及心、肝、肺、皮肤等100多种疾病的发生机理与体内自由基产生过多或清除自由基能力下降有着密切的关系[6-7]。用人工合成的抗氧化剂来消除体内的自由基和治疗疾病,往往效果不佳,且产生毒副作用,因此,近年来关于中草药的抗氧化活性研究越来越引起自由基医学的重视[8-9]。但目前关于桃花提取物抗氧化活性的报道比较少,本实验通过近年来普遍采用的中药抗氧化活性评价方法DPPH自由基法, D-脱氧核糖-铁体系法和邻苯三酚自氧化法[10]对桃花提取物的抗氧化活性与其绿原酸含量的相关研究,为进一步研究桃花的药理作用提供理论支撑。
1 实验仪器与药品
1.1 主要实验仪器
FW-177中草药粉碎机;LC-20AD型高效液相色谱仪(日本岛津);UV-1750型紫外分光光度计(日本岛津);XH300A微波催化合成/萃取仪(北京祥鹄科技发展有限公司);ME2358电子分析天平(德国塞多利斯公司);RE-52A旋转蒸发仪(上海亚荣升华仪器厂)。
1.2 实验药品
绿原酸对照品(中国食品药品检定研究院,批号110753-200413,质量分数99%);桃花(采自于宁夏固原市原州区宁夏师范学院后山古雁岭),将新鲜的桃花用蒸馏水清洗后,沥干,放入恒温箱中,在60 ℃烘干至恒重,自然凉干,粉碎,过80目筛,作为实验用样品,备用。乙腈(色谱纯)、DPPH(1,1-二苯基-2-三硝基苯肼,Sigme公司)、磷酸、磷酸二氢钾、磷酸氢二钠、盐酸、邻苯三酚、三氯乙酸、氢氧化钾、无水乙醇、水杨酸、抗坏血酸、硫代巴比妥酸(TBA)、EDTA、乙酸乙酯、正己烷、FeCl3、H2O2、FeSO4等均为国内产分析纯。
2 实验方法
2.1 桃花中绿原酸的提取及含量测定
2.1.1 色谱条件 色谱柱为Phenomenex(250 mm×4.6 mm,5 μm);以乙腈-0.3%H3PO4水溶液(8∶92)为流动相;流速1.0 mL·min-1,保持30 ℃柱温,进样量10 μL,检测波长331 nm。
2.1.2 标准曲线的建立 准确称取经过干燥的绿原酸标准品2.0 mg,乙醇溶解并定容至100 mL,配制成20 μg·mL-1的绿原酸标准品储备液。分别取1、2、5、10、15 μL标准品储备液,在上述色谱条件下进行测定,以峰值面积值(Y)对绿原酸浓度(X)进行限行回归,回归方程为:Y=11 367.62X-374.93,r=0.999 4,表明绿原酸标准品在20~300 μg·mL-1范围内具有良好的线性关系。
2.1.3 桃花中绿原酸的提取及纯化 根据单因素试验和正交试验的结果,称取10 g经过预处理的桃花样品于500 mL锥形瓶中,用200 mL 70%的乙醇浸润30 min,在功率为70 W下超声辐射75 min,过滤,将滤液收集,相同条件下再提取1次,将2次滤液合并。将滤液在60 ℃下减压浓缩干燥,得到绿原酸粗提物0.499 6 g。将绿原酸粗品用蒸馏水完全溶解,用盐酸调至pH值为3,用等体积的乙酸乙酯错流萃取,每次萃取10 min,连续萃取3次,合并萃取液上层,减压浓缩至一定体积,按体积的40%加入正己烷,反复震荡,将经过分相析出的绿原酸在0~4 ℃结晶24 h,并将其在95 Kpa,50 ℃进行真空干燥30 min,得到白色晶体绿原酸[11],备用。
2.1.4 桃花提取的绿原酸含量的测定 准确称取0.1 g桃花提取物绿原酸纯化品,用70%的乙醇溶解并容至100 mL,配置成桃花提去物样品溶液。取其样品溶液1.00 mL,用乙醇稀释定容至100 mL,按2.1.2方法测定。依据绿原酸标准曲线方程计算其浓度,按公式:绿原酸的含量(%)=桃花提取物样品溶液的体积(mL)×根据标准曲线计算的浓度(μg·mL-1)×稀释的倍数/桃花提取物质量(g)×100%,计算得到桃花提取物中绿原酸含量为89.37%。
2.2 桃花提取物还原能力的测定
采用普鲁士兰法。取2.5 mL的不同浓度桃花提取物样品(空白用蒸馏水代替,其他试剂下同)溶液,加入2.5 mL的磷酸盐缓冲液(0.2 mol·L-1,pH=6.6)及1%的K3Fe(CN)6溶液2.5 mL,于50 ℃水浴反应20 min后急速冷却,加入10%的三氯乙酸溶液2.5 mL,取反应液5 mL。加入5 mL的H2O和0.10%的FeCl3溶液1 mL,混合均匀,10 min后于700 nm处测定其吸光度值[12],以水为空白,吸光度值越大,还原能力越强。以相同浓度的绿原酸标准品和抗坏血酸作阳性对照实验。
2.3 桃花提取物清除羟基自由基(·OH)的活性研究
采用D-脱氧核糖-铁体系法。向干燥洁净的试管中依次加入0.4 mL 50 mmol·L-1的KH2PO4-KOH缓冲液,一定浓度的桃花提取物样品溶液,0.1 mL 1.04 mmol·L-1的EDTA溶液,0.1 mL 20 mmol·L-1的FeCl3溶液,0.1 mL10 mmol·L-1的H2O2, 0.1 mL 60 mmol·L-1的DR(其中对照不加),0.1 mL 20 mmol·L-1的抗坏血酸,使反应体系最终体积为1 mL, 37 ℃下保温1 h,取出迅速加入25%的盐酸1 mL终止反应,再加入1 mL 1%的TBA,沸水煮沸15 min,立即冷却,若有混浊加人3 mL正丁醇萃取,在532 nm下测其吸光度[13-14],以相同浓度的绿原酸标准品和抗坏血酸作阳性对照实验。清除率按以下公式计算:
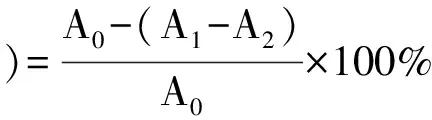
(1)
其中A0:空白吸光度;A1:加入清除剂和DR 后吸光度;A2:样品本身吸光度(不加DR)。
2.4 桃花提取物清除DPPH·自由基的活性研究
取不同浓度的桃花粗提物样品溶液1 mL,向其中加入2 mL 0.2 mmol·L-1DPPH自由基无水乙醇溶液,常温下黑暗处放置30 min,在517 nm下测得吸光值;以2 mL 95%的乙醇溶液代替DPPH溶液为空白组;2 mL 0.2 mmol·L-1DPPH乙醇溶液与2 mL蒸馏水为对照组;同时以等体积蒸馏水和95%的乙醇混合液作为空白调零[15]。每个浓度重复实验3次,取吸光度的平均值,用相同浓度的绿原酸标准品和抗坏血酸作阳性对照实验。按下式计算DPPH自由基清除率:
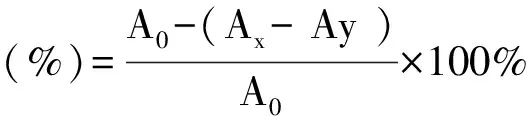
(2)
式中A0:为对照组吸光度,Ay:为空白组吸光度,Ax:为加入桃花多糖后溶液的吸光度。
2.5 桃花提取物清除超氧阴离子的活性研究


(3)
3 实验结果
3.1 桃花提取物的还原能力
称取桃花提取物样品20 mg,用乙醇溶解并定容至10 mL,桃花提取物样品的浓度为2 mg·mL-1,准确移去该溶液1 mL,分别稀释10、25、40、100、200、400倍,使桃花提取物样品的浓度分别为200、100、50、20、10、5 μg·mL-1。按2.2方法分别测定桃花提取物、绿原酸标准品和抗坏血酸的吸光度。用吸光度值的大小评价其还原能力,吸光度值越大还原能力越强。实验结果如图1所示。

图1 Vc、绿原酸和桃花提取物还原能力
实验结果表明,在实验选取的浓度范围内,Vc、桃花提取物和绿原酸对Fe3+具有还原能力,浓度小于20 μg·mL-1时还原能力均比较弱,但随着浓度的增大其还原能力都迅速逐渐增强。且在浓度较低范围内Vc的还原能力明显大于桃花提取物和绿原酸标准品,当浓度大于100 μg·mL-1时,随着还原能力都在增强的同时三者的还原能力逐渐接近。
3.2 桃花提取物对羟基(·OH)自由基抗氧化活性
按2.3方法分别测定浓度为5、10、20、50、100、200 μg·mL-1桃花提取物、绿原酸标准品和Vc对D-脱氧核糖-铁体系产生羟基自由基(·OH)的消除率,实验结果如图3所示。图3表明,在5~200 μg·mL-1范围内,桃花提取物、绿原酸和Vc对D-脱氧核糖-铁体系产生的羟基(·OH)均有一定的抗氧化活性,相同浓度其抗氧化活性桃花提取物>绿原酸标准品>抗坏血酸。而且随着浓度的增大,抗氧化活性增大,当浓度大于100 μg·mL-1抗氧化活性基本稳定,浓度为200 μg·mL-1桃花提取物、绿原酸标准品和Vc的抗氧化活性分别为66.42%,49.92%和19.68%。同时发现桃花提取物和绿原酸标准品对羟基自由基(·OH)抗氧化活性变化趋势一致。

图3 Vc、绿原酸和桃花提取物对·OH自由基抗氧化活性
3.3 桃花提取物对DPPH·自由基抗氧化活性
按2.4方法分别测定浓度为5、10、20、50、100、200 μg·mL-1桃花提取物、绿原酸标准品和Vc对1,1-二苯基-2-三硝基苯肼(DPPH)产生的自由基抗氧化活性,实验结果如图4所示。由图4表明,在5~200 μg·mL-1范围内,桃花提取物、绿原酸标准品和Vc三种物质对DPPH·自由基均具有强的抗氧化活性,随着浓度的增大,其抗氧化活性增强。相同浓度下,桃花提取物、绿原酸标准品对DPPH·自由基的抗氧化活性均大于Vc,浓度为200 μg·mL-1时其抗氧化活性分别为82.12%、78.42%和74.65%,且桃花提取物对DPPH·自由基的抗氧化活性具有良好的效量关系。

图4 Vc、绿原酸和桃花提取物对DPPH·自由基
3.4 桃花提取物对超氧阴离子的抗氧化活性

图5 Vc、绿原酸和桃花提取物对自由基抗氧化活性
4 结论
本实验采用体外化学模拟法对桃花绿原酸粗提物的抗氧化活性进行了探讨,并以绿原酸标准品和抗坏血酸为对照,实验表明桃花提取物对羟基自由基、DPPH自由基和超氧阴离子自由基具有较强的抗氧化活性,并且与其浓度具有良好的效量关系,说明桃花中的抗氧化活性物质主要来源于绿源酸。
由于植物成分的复杂性,往往含有多种抗氧化活性成分,因此,不同的提取方法、溶剂和条件将使成分、含量不同,导致评价效果产生差异。
体外化学模拟法与人体的抗氧化环境有所差异,关于桃花绿原酸能否作为人体抗氧化活性物质还需要进一步的探讨和进行大量的动物实验及临床试验研究。
关于桃花绿原酸抗氧化机理、抗氧化活性的稳定性及桃花中其它抗氧化活性成分的协同作用需要继续进行探索和研究。
本实验只是对桃花提取物绿原酸的抗氧化活性进行了初步探索,若要提高其药用价值和经济价值还需要进行大量深入的研究,可以预见桃花在医疗和美容领域有着广阔的应用前景。
[1] 马建忠,张有成,徐小东,等.桃花的药用价值[J].中医学报,2013,28(7):1020-1022.
[2] 梁永锋.桃花中黄酮含量的测定及超声波辅助下提取工艺优化[J].江苏农业科学,2016,44(9):329-331.
[3] Takagi S,Yamaki M,Masuda K,et al.Studies on the purgative drugs.Ⅲ.On the constituents of the flowers ofPrunuspersicaBatsch.Yakugaku Zasshi,1977,97(1):109-110.
[4] 王辉,田呈瑞,马守磊.绿原酸的研究进展[J].食品工业科技,2009,30(5):341-345.
[5] 吴江涛.绿原酸的生物活性及其应用[J].现代农业科技,2009(19):349-350.
[6] 卢敏.SOD和Env的靶向给药研究[D].杭州:浙江大学,2008.
[7] 李惠云,贾清秀.浅谈氧自由基与人体健康的关系[J].安阳师范学院学报,2003,(2):74,86.
[8] 叶汉侠,王莆材.18种中草药抗氧化活性的比较研究[J].浙江万里学院学报,2004,17(5):111-113.
[9] 刘方,武子斌,牛淑敏,等.中药材抗氧化及自由基消除活性的研究[J].中国药学杂志,2001,36(7):442-445.
[10] 李秋红,李廷利,黄莉莉,等.中药抗氧化的作用机理及评价方法研究进展[J].时珍国医国药,2008,19(5):1257-1258.
[11] 胡居吾,李雄辉,熊伟,等分相萃取法制备高纯度绿原酸的工艺研究[J],食品科学,2010,31(4):37-41.
[12] 关炳峰,谭军,周志娣.金银花提取物的抗氧化作用与其绿原酸含量的相关性研究[J],食品工业科技,2007,28(10):127-129.
[13] Barry Halliwell,et al.The deoxcyribose method:a simple“test-tube”assay for determination of rate constants for reactions of hydroxyi radials[J].Analytical biochemistry,1987,165:215-219.
[14] 刘彬,黄文,张洁,等.家蝇幼虫提取物清除氧自由基 的作用[J].昆虫知识,2006,43(1):85-88.
[15] 金杰,李志雨,张锋,等.桑葚醋提取物对二苯代苦味酰基自由基(DPPH·)的清除作用[J].西北农林科技大学学报,2006,34(3);135-137.

