甘蔗糖蜜预处理对乙醇发酵的影响
2018-06-21徐海东伍时华黄翠姬赵东玲
徐海东 ,伍时华 ,易 弋 ,黄翠姬 ,赵东玲
(1.广西科技大学生物与化学工程学院,广西柳州545006;2.广西科技大学广西糖资源绿色加工重点实验室,广西柳州545006;3.广西科技大学广西高校糖资源加工重点实验室,广西柳州545006)
从20世纪70年代石油危机爆发以后,石油、天然气等不可再生能源的日益耗竭,使得燃料乙醇这一清洁能源成为了可再生资源的发展重点。乙醇不仅能作为一种优良的燃料,还可以作为一种优良的燃油品改善剂,使得汽油燃烧更加充分,能有效地降低一氧化碳等有害气体的排放,从而达到节能、环保的目的。因乙醇具有清洁、环保、安全、可再生等较多优点,已在欧美和巴西等发达国家得到广泛的应用[1]。但乙醇的发酵过程的生产成本高依旧是阻碍乙醇作为一种清洁燃料广泛使用的障碍之一,因此,利用廉价的甘蔗糖蜜生产燃料乙醇有着重要意义[2]。
甘蔗糖蜜又称糖浆,是制糖工业将压榨出的甘蔗汁液,经加热、中和、沉淀、过滤、浓缩、结晶等工序制糖后所剩下的浓稠液体,是糖厂的副产品之一。甘蔗糖蜜成分复杂,包括蛋白质、维生素、有机酸和一些金属离子,且含糖量很高,一般占到30%~50%,是发酵、饲料、食品和建筑行业中常见原料,但其中还混有大量的非糖成分和杂质[3],如含有5%~10%的胶体物质(主要由果胶质、焦糖和黑色素等组成),这是乙醇发酵过程中产生大量泡沫的主要原因,会降低发酵效率[4-5],色素、重金属和糠醛等物质也会对酵母的生长繁殖产生不利的影响,这对于酵母利用甘蔗糖蜜发酵生产乙醇是非常不利的。目前,我国甘蔗糖蜜乙醇发酵的醪液乙醇含量仍然较低,一般为7%vol~8%vol[6-7],所以,采取有效的方法对甘蔗糖蜜进行预处理,对提高甘蔗糖蜜乙醇发酵的醪液乙醇含量是很有必要的。
1 材料与方法
1.1 材料、试剂及仪器
菌株:酿酒酵母(Saccharomyces cerevisiae)GJ2008,广西科技大学发酵工程研究所保藏。
甘蔗糖蜜:取自广西露塘糖厂。
斜面活化培养基:酵母浸膏10 g/L,葡萄糖20 g/L,蛋白胨20 g/L,琼脂20 g/L,自然pH值,115℃高压蒸汽灭菌30 min。
一级种子培养基:酵母浸膏10 g/L,葡萄糖20 g/L,蛋白胨20 g/L,自然pH值,115℃高压蒸汽灭菌30 min。
二级种子培养基:酵母浸膏10 g/L,葡萄糖100 g/L,蛋白胨20 g/L,自然pH值,115℃高压蒸汽灭菌30 min。
发酵培养基:糖蜜经过预处理后,稀释至总糖浓度为260 g/L,115℃高压蒸汽灭菌30 min后每100 mL发酵培养基加入过滤除菌的1 mL尿素溶液(400 g/L)。
仪器设备:ZWYD-2402叠式恒温培养振荡器,上海智诚分析仪器制造有限公司;LS-B35L-I立式压力蒸汽灭菌器,江阴滨江医疗设备有限公司;SBA-40X三通道生物传感仪和SGD-IV全自动还原糖测定仪,山东科学院生物研究所;Mikro220R台式冷冻离心机,天津奥特赛恩斯仪器有限公司;高效液相色谱仪,株式会社日立制作所。
1.2 试验方法
1.2.1 种子培养方法
将菌种GJ2008经30℃斜面活化1 d后,分别接种至一级种子培养基中,以32℃、160 r/min摇床培养12 h,以10%的接种量转接至二级种子培养基中,以32℃、160 r/min摇床培养10 h后,4000 r/min离心10 min,弃上清液得酵母泥,加入无菌水振荡混合制得10倍浓缩种子悬液。
1.2.2 甘蔗糖蜜的预处理
(1)无处理(对照组)。甘蔗糖蜜1∶1用蒸馏水稀释后,离心,收集上清液待用。
(2)煮沸处理。甘蔗糖蜜1∶1用蒸馏水稀释后,加热煮沸30 min,离心,收集上清液待用。
(3)活性炭处理。甘蔗糖蜜1∶1用蒸馏水稀释后,加入1%活性炭粉末吸附处理,离心,收集上清液待用。
(4)磷酸钙处理。甘蔗糖蜜1∶1用蒸馏水稀释后,按照8 g/100 mL加入磷酸钙在20℃不断搅拌4 h,离心,收集上清液待用。
(5)亚铁氰化钾处理。甘蔗糖蜜1∶1用蒸馏水稀释后,加入0.1%亚铁氰化钾,调节至pH5.5,煮沸30 min,同时加入1%活性炭,离心,收集上清液待用。
(6)硫酸处理。甘蔗糖蜜1∶1用蒸馏水稀释后,加热煮沸,冷却后加浓硫酸至pH1.0~2.0,静置过夜,离心,上清液调至pH5.5左右,90℃保温30 min,加入1%活性炭,离心,收集上清液待用。
(7)联合处理。甘蔗糖蜜1∶1用蒸馏水稀释后,加热煮沸,冷却后加浓硫酸至pH1.0~2.0,90℃保温30 min后静置过夜,离心,上清液调至pH5.5左右,加入1%活性炭,离心,上清液加入1%亚铁氰化钾,调节至pH5.5,同时按照8 g/100 mL浓度加入磷酸钙后在20℃下不断搅拌4 h,离心,上清液供试验。
1.2.3 酒精发酵方法
将2 mL的10倍浓缩种子液分别接种至装液量200 mL和500 mL的发酵培养基中,以32℃、160 r/min摇床培养,透气膜封口后用牛皮纸包扎封口进行微通氧发酵,每组3个平行试验,发酵开始0 h、3 h、6 h以后每隔6 h取样并测CO2失重,失重小于0.2 g时发酵结束。
1.2.4 分析测定方法
1.2.4.1 乙醇测定
采用生物传感分析仪测定,标准乙醇为400mg/L。
1.2.4.2 残总糖的测定
稀硫酸酸解后,稀释合适倍数,用全自动还原糖测定仪测定。
1.2.4.3 葡萄糖、果糖、蔗糖测定
采用高效液相色谱仪测定。氨基柱规格:250×4.6 mm,5 μm;流动相为乙腈:二次水(v/v)=80∶20,流速1.0 mL/min,柱温35℃;蒸发光散射检测器(ELSD)参数:漂移管温度80℃,空气流速2.0 L/min。
1.2.5 计算方法

2 结果与讨论
2.1 不同预处理的甘蔗糖蜜乙醇发酵过程糖代谢分析(图1、图2、图3、图4、图5)
用不同预处理的甘蔗糖蜜进行乙醇发酵,结果见图1。在初总糖浓度相同时,残糖量越高则说明糖消耗越慢,残糖量越低说明糖消耗越快[8]。发酵结束时,联合处理组的残总糖量最低(30 g/L),远低于残糖量最高的无处理(63.14 g/L),且其他预处理方式的最终残糖均小于对照组,结果表明,经过处理后的甘蔗糖蜜在不同程度上均有利于酵母细胞对糖的消耗。

图1 不同预处理甘蔗糖蜜乙醇发酵残总糖代谢曲线
如图2、图3、图4所示,由于硫酸酸化使得硫酸处理组与联合处理组蔗糖发生水解,0 h蔗糖浓度明显低于其他各组,而葡萄糖和果糖的浓度高于其他组。发酵开始后,各组的蔗糖在转化酶的作用下浓度一直降低,葡萄糖和果糖浓度先升高,然后由于酵母的代谢使糖浓度迅速下降。在发酵结束时(66 h),葡萄糖和蔗糖基本上被完全耗尽,其残糖主要为果糖,因为对于酵母细胞而言,果糖的利用速率远小于葡萄糖[14]。无处理、煮沸处理、活性炭处理、磷酸钙处理、亚铁氰化钾处理、硫酸处理、联合处理的果糖浓度分别是57.8 g/L、50.2 g/L、49.1 g/L、46.4 g/L、44.8 g/L、36.5 g/L、29.7 g/L;对照组的果糖浓度明显高于其他组。

图2 不同预处理甘蔗糖蜜乙醇发酵过程蔗糖代谢曲线
糖消耗速率可以定量地表示单位时间内糖消耗的快慢[9]。由图5所示,总糖消耗速率呈现了先增大后减小的趋势,且在12~18 h时,各组的总糖消耗速率均达到最大值,无处理、煮沸处理、活性炭处理、磷酸钙处理、亚铁氰化钾处理、硫酸处理、联合处理的总糖消耗速率分别为7.01 g/L·h、7.42 g/L·h、7.57 g/L·h、7.72 g/L·h、7.43 g/L·h、7.78 g/L·h、8.03 g/L·h;且大多数时间段内各实验组的总糖消耗速率均大于对照组。结果表明,经以上方法对蔗糖糖蜜预处理后,加快了酵母对糖的消耗速率。
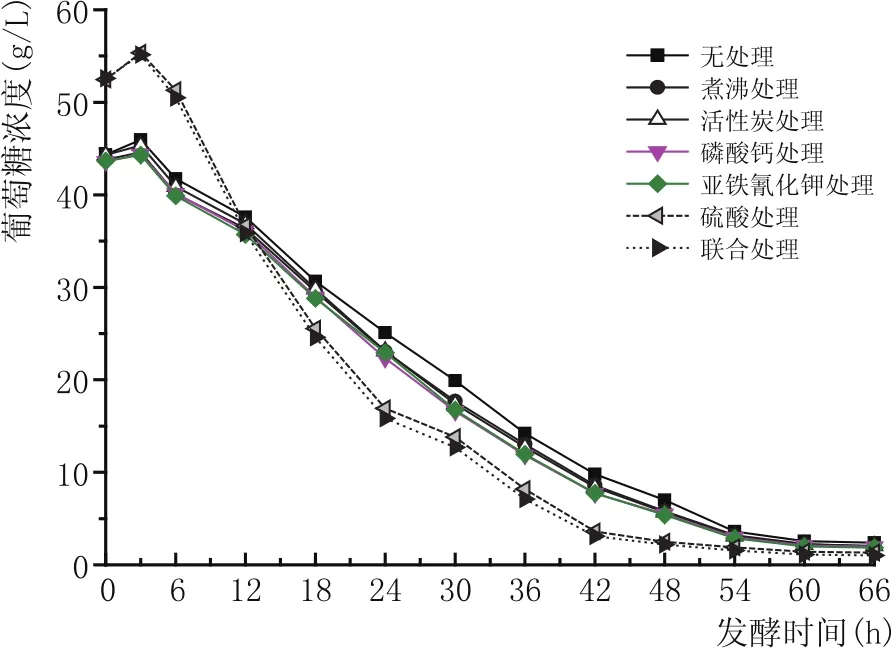
图3 不同预处理甘蔗糖蜜乙醇发酵过程葡萄糖代谢曲线

图4 不同预处理甘蔗糖蜜乙醇发酵过程果糖代谢曲线
2.2 不同预处理的甘蔗糖蜜乙醇发酵过程乙醇生成分析(图6、图7)
如图6所示,不同预处理方法的甘蔗糖蜜发酵过程中,酵母细胞的乙醇生成趋势基本是一致的。与对照组(82.45 g/L)相比,试验组的乙醇浓度均高于对照组,其中联合处理的最终乙醇浓度最高,达到100.99 g/L。乙醇的生成与酵母利用糖的多少有着密切的关系[9],比较图5和图7可知,总糖消耗速率与乙醇生成速率的总体趋势基本一致,3~48 h乙醇生成速率较大,最大值出现在12~18 h,无处理、煮沸处理、活性炭处理、磷酸钙处理、亚铁氰化钾处理、硫酸处理、联合处理的乙醇浓度分别为3.25 g/L·h、3.33 g/L·h、3.52 g/L·h、3.42 g/L·h、3.42 g/L·h、3.62 g/L·h、3.77 g/L·h;在3~48 h发酵阶段,各试验组的乙醇生成速率均大于对照组。结果表明,甘蔗糖蜜预处理后,酵母生成乙醇的速率加快,最终乙醇浓度升高。

图5 不同预处理的甘蔗糖蜜乙醇发酵过程总糖消耗速率

图6 不同预处理的甘蔗糖蜜乙醇发酵过程乙醇生成曲线
2.3 不同预处理的甘蔗糖蜜乙醇发酵参数分析
甘蔗糖蜜在不同预处理的条件下,酵母的乙醇发酵参数见表1。在初总糖基本相同的情况下,发酵结束时,无处理、煮沸处理、活性炭处理、磷酸钙处理、亚铁氰化钾处理、硫酸处理、联合处理的总糖浓度分别为63.14 g/L、54.95 g/L、53.8 g/L、50.9 g/L、49.1 g/L、39.18 g/L、30 g/L,与对照组相比,发酵结束时各实验组的残总糖均有所降低,其中残总糖最低的联合处理组残总糖下降了52.48%。而预处理对酵母细胞的发酵时间并无明显影响。与对照组相比,各试验组的最终乙醇浓度均有所提高,最高的联合处理组的乙醇浓度提高了22.48%,总糖发酵效率和耗糖发酵效率均有所增大。

表1 不同预处理条件下酵母GJ2008甘蔗糖蜜乙醇发酵参数

图7 不同预处理的甘蔗糖蜜乙醇发酵过程乙醇生成速率
3 结论
甘蔗糖蜜中糖类物质及其他营养物质是酵母乙醇发酵的主要原料[10]。但其中也含有一些抑制酵母生长的不利因素。如果胶质、焦糖、黑色素组成的胶体物质,会吸附在酵母细胞上从而抑制细胞的生长,同时还会在乙醇发酵时产生大量气泡,影响发酵效率[11]。金属离子对乙醇生成的影响比较复杂,根据Chotineeranat等[12]的研究,当钙离子浓度为2.16%(w/v),蔗糖乙醇发酵机制被完全抑制。所以说甘蔗糖蜜需要经过预处理,去除影响酵母生长发酵的物质,才能更好地生成乙醇。
本实验利用煮沸、磷酸钙、亚铁氰化钾、联合处理等方法对甘蔗糖蜜进行预处理后进行乙醇发酵,以糖消耗速率、乙醇生成速率和总糖发酵效率等指标进行对比,发现联合处理是一种比较适宜的预处理方法,硫酸能在有效除去甘蔗糖蜜中影响酵母细胞生长发酵的胶体物质同时,也能酸解一定的蔗糖转化为葡萄糖和果糖,亚铁氰化钾可以去除甘蔗糖蜜中的铁离子等金属离子。最终发酵结束时,残总糖浓度、乙醇浓度、乙醇生成速率分别为30 g/L、100.99 g/L和1.68 g/L·h。与无处理相比,残总糖降低了52.48%,最终乙醇浓度提高了22.48%,乙醇生成速率提高了22.62%。虽然本实验得到的乙醇浓度并不是最高的,但与其他发酵原料相比,甘蔗糖蜜具有成本低、来源广等优点,有较好的发展前景。
[1]CARVALHO L C C.The prospects for ethanol production in Brazil:future remains promising despite current difficulties[J].International sugar journal(cane sugar edition),1996,98(1170):289-294.
[2]CAZETTA M L,CELLIGOI M,BUZATO J B,et al.Fermentation of molasses byZymomonas mobilis:effects of temperature and sugar concentration on ethanol production[J].Bioresource technology,2007,98(15):2824-2828.
[3]王强,李秀霞,林常旭,等.甘蔗糖蜜净化处理工艺探究[J].广西民族师范学院学报,2014,31(3):4-6.
[4]李永成,钟秋平.甘蔗糖蜜预处理对产L-苹果酸的影响与培养基N源添加[J].食品工业科技,2011,32(1):178-180.
[5]CURTIN L V.Molasses-general considerations[J].Molasses in animal nutrition,1983:1-10.
[6]熊子书.甘蔗糖蜜酒精酵母菌的筛选与应用[J].酿酒科技,1996(1):11-13.
[7]熊子书.中国酿酒酵母菌的研究——不同酒类酵母筛选与应用纪实:上册[J].酿酒科技,2002(4):23-27.
[8] 武文强.高浓度酒精发酵过程酿酒酵母GGSF16发酵能力的研究[D].南宁:广西科技大学,2015.
[9] 蒋凯,伍时华,赵东玲,等.通气量对酿酒酵母GGSF16高浓度乙醇发酵的影响[J].食品与发酵工业,2015(5):35-40.
[10]CHEN J C P,CHOU C C.Cane sugar handbook:a manual for cane sugar manufacturers and their chemists[M].12th ed.New York:John Wiley and Sons,1993.
[11]王成韬,钟秋平,李永成.海南粗榧外植体灭菌方法研究[J].热带作物学报,2014,35(1):110-114.
[12]CHOTINEERANAT S,WANSUKSRI R,PIYACHOMKWAN K,et al.Effect of calcium ions on ethanol production from molasses bySaccharomyces cerevisiae[J].Sugar Tech,2010,12(2):120-124.
[13]桓琼莎,伍时华,赵东玲,等.混合酵母菌株酒精发酵过程对葡萄糖和果糖利用的差异性研究[J].广西科技大学学报,2017,28(3):9-15.
