不同麦汁浓度对Lager啤酒酵母氨基酸代谢及发酵性能的影响
2018-06-21赵伯辰雷宏杰徐怀德
赵伯辰,张 柯,雷宏杰,徐怀德
(西北农林科技大学食品科学与工程学院,陕西杨凌712100)
啤酒高浓酿造不仅会产生很大的经济效益,在一定程度上还可提高啤酒的质量[1]。18°P麦汁发酵的高级醇生成量显著高于12°P麦汁发酵的高级醇生成量,醇酯比增大[2]。这样,将高浓发酵后的啤酒稀释至常浓时,依然可保证啤酒丰满圆润,口感柔和协调。但是,高浓酿造在生产中也存在许多问题,如:高浓形成的高渗透压和高乙醇毒性抑制酵母的生长,使得发酵缓慢[3-6],增加了酵母压力;降低了原料的利用率(酒花的利用率下降)和啤酒泡沫稳定性[7];造成啤酒风味差异,不协调[8-9];影响了酵母的发酵性状和絮凝性等[10],并降低了酵母回收再利用率。产生这些不良效果的根本原因在于发酵过程中可同化氮源的不足。
氮源作为酵母细胞生长和代谢所必需的元素之一,在酵母生长、繁殖过程中扮演着重要的角色。酵母的生长伴随着氮源的消耗,酵母停止繁殖,氮源的利用就会相应降低甚至停滞。高浓麦汁中α-氨基氮的含量不仅对酵母适应高渗透压有影响,还会对乙醇生产速率和乙醇耐受性有一定的影响,高浓度的α-氨基氮可增加酵母对高渗透压的适应能力和乙醇的耐受性。酵母细胞的氮代谢活动主要有胞内氨基酸的生物合成和结构蛋白及各种酶类的合成等[11]。在发酵初期,麦汁中大量的含氮物质被快速利用,24 h之后利用变缓,直至酵母细胞停止生长[12]。常浓酿造麦汁中总FAN水平与酵母生长成正比,即麦汁中高的FAN水平可导致酵母细胞的快速增长,并影响啤酒的成熟[13],初始FAN水平与最终乙醇产量之间也存在显著相关性[14]。因此,确保麦汁中丰富的FAN对于良好及快速的发酵具有非常重要的意义。氨基酸作为重要的可同化氮源不仅参与细胞内各物质的代谢[15]并提高啤酒非生物稳定性,而且部分氨基酸还可调控啤酒酵母细胞适应高渗透压和高乙醇毒性,从而提高酵母的发酵性能。
本试验研究不同浓度全麦芽麦汁,即不同氮源水平对啤酒酵母生理特性和发酵性能的影响,探究啤酒高浓酿造中丰富的氮源与酵母生长、细胞活性、乙醇产量、发酵度及其与啤酒风味物质等的关系,确定在高浓酿造中能够调控酵母细胞适应高渗透压环境胁迫的关键氨基酸。
1 材料与方法
1.1 材料、试剂及仪器
菌种:Lager啤酒酵母Saccharomyces pastorianus,由西北农林科技大学食品工程实验室提供。该菌种经UV照射和甲基磺酸乙酯复合诱变后在含有高浓度麦芽糖和乙醇的培养基上进行驯化培养获得。
麦汁制备:称取一定量的麦芽(澳麦芽,购买于厦门市老啤匠贸易有限公司),经粉碎机粉碎后装入糖化锅内,按照麦芽与水的质量比为1∶4加入45℃酿造水,搅拌均匀,用乳酸调至pH5.5。设置升温程序依次为:45 ℃,30 min;63 ℃,60 min;72℃,10 min;78℃,10 min。以1℃/min的速度升温,开始糖化,糖化结束后迅速冷却至45℃进行滤布过滤,再将滤液煮沸90 min,煮沸过程中分3次添加酒花颗粒(由西安雪花啤酒有限公司提供),添加量为麦芽质量的0.1%。煮沸结束后再次用纱布过滤,将滤液用酿造水分别定型至8 °P、12 °P、16 °P、20°P、24°P,得到不同浓度的全麦芽麦汁。发酵前进行高压蒸汽灭菌(121℃,15 min)。
试剂:果糖、琼脂、麦芽糖浆,厚朴生物科技(苏州)有限公司;高级醇酯标准品、甘氨酸,美国Gen-Probe公司;亚甲基蓝、茚三酮,南京化学试剂股份有限公司;无水乙醇、氯化钠、KH2PO4、Na2HPO4·12H2O,国药集团化学试剂有限公司。
仪器设备:ISQ&TRACE ISQ气相质谱联用仪,美国赛默飞科技有限公司;Waters UPLCI-Class型高效液相色谱仪,美国沃特斯公司;DYJX-80℃冰箱,鼎耀机械有限公司;UV1780紫外可见分光光度计,日本岛津公司;TS-1102C小型立式恒温振荡箱,上海天呈实验仪器制有限公司;XP6电子天平,瑞士梅特勒-托利多仪器有限公司;SW-CJ-1FD超净工作台,苏州安泰空气技术有限公司;860型粉碎机,南京威利朗是食品机械有限公司;E100LED MV生物显微镜,日本尼康公司;BSD-150摇床培养箱,上海博讯实业有限公司;ATAGO(爱拓)糖度计,厦门森态仪器仪表有限公司;YX-280高压灭菌锅,江阴滨江医疗设备厂;CM-5色差计,科电贸易(上海)有限公司。
1.2 试验方法
1.2.1 酵母种子扩培和啤酒发酵
在无菌条件下,用接种环从试管斜面上刮取1环酵母,接种于10 mL 12°P全麦芽麦汁种子培养液中,摇床培养24 h(25 ℃,180 r/min),之后转入200 mL种子液(12°P全麦芽麦汁)中,摇床培养48 h(20℃,120 r/min),最后,转入1 L种子液中,15℃静置培养72 h。离心取酵母泥(8000 g,10 min,4 ℃)。接种量5× 106cells/mL/°P。
采用2 L锥形瓶进行啤酒发酵,装无菌麦汁量为1.0 L。发酵温度为15℃。每天定时取样,发酵液和酵母菌体经离心分离(8000 g,15 min,4℃),将上清液置于-20℃冰箱保存。
1.2.2 酵母细胞计数和活细胞率
采用血球计数板计数法测定悬浮酵母细胞数量和活细胞率(亚甲基蓝染色)。将从锥形瓶中取出的样液稀释10倍后测定其悬浮细胞数和活细胞率。在0.1 mL细胞悬浮液中加入0.9 mL磷酸盐亚甲基蓝溶液(pH4.6),振荡混匀,10 min后在电子显微镜下通过血球计数板对活细胞和死细胞(死亡的细胞被染成了蓝色)进行计数。
1.2.3 麦汁浓度和酒精度测定
将发酵后的麦汁离心取上清液(8000 g,15 min,4℃)30 mL,倒入25 mL的附温比重瓶中,将附温比重瓶置于20℃水浴中,待温度升到20℃,快速取出,称其重量,测定其在20℃条件下的浸出物含量。麦汁浓度用“°P”表示,即100 mL麦汁中含有浸出物的固形物的量(g)。
将发酵后的麦汁离心取上清液50 mL,倒入500 mL蒸馏瓶中,再加入50 mL去离子水,加热蒸馏。用50 mL的容量瓶收集馏出液,当馏出液体积接近50 mL时,停止蒸馏,用蒸馏水定容至50 mL。用附温比重瓶测定其在20℃条件下的乙醇浓度。
1.2.4 麦汁FAN测定
麦汁的FAN水平测定采用茚三酮显色法[16]。制备甘氨酸标准溶液(0、80µmol/L、100µmol/L、120µmol/L、140µmol/L、160µmol/L),绘制标准曲线。麦汁样品稀释100倍,首先在具塞玻璃试管中加入2.0 mL的稀释样品,然后加入1.0 mL的显色剂(0.5 g茚三酮、10.0 g Na2HPO4·12H2O、6.0 g KH2PO4和0.3 g果糖溶于100 mL去离子水,pH 6.7);再将试管放进100℃沸水浴中,反应时间为16 min,然后20℃恒温水浴下冷却20 min,待冷却完成后加入5.0 mL的稀释剂(2.0 g KIO3溶于1 L的40%乙醇水溶液),用旋涡振荡器混匀,静置15 min;最后在波长570 nm条件下检测样品吸光值。计算公式如下:
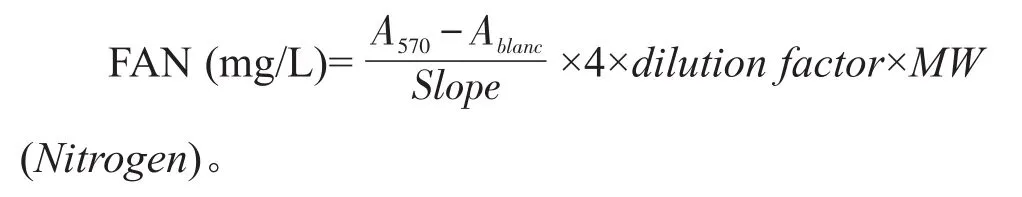
1.2.5 麦汁游离氨基酸测定
首先要将样品进行前处理:啤酒样品超声脱气后,0.45 μm滤膜过滤。
衍生剂的配制:吸取1 mL AccQ·Fluor稀释剂(2B瓶)放入装有AccQ·Fluor衍生剂粉末的2A瓶中,加盖密封,旋涡振荡10 s;在加热装置上加热2A瓶,直至AccQ·Fluor衍生剂粉末全部溶解,加热时间不超过10 min,温度不超过55℃。
氨基酸的衍生方法:取20 μL的18种标准氨基酸(AA)混合液放入6×50 mm样品管中,再加入60 μL硼酸缓冲液(1瓶)到样品管中,涡旋混合;待混合均匀,在上述样品管中加入20 μL配制好的AccQ·Fluor衍生试剂,立即涡旋混合数秒钟,放置1 min。然后将样品管中的反应物转移到一只微量样品瓶中,加盖密封,在55℃的加热装置中加热10 min。
色谱条件:色谱柱为Waters公司的C18氨基酸专用分析色谱柱;柱温:37℃;DAD检测波长为248 nm;流速:1 mL/min;进样量:10 μL;流动相A:醋酸盐-磷酸盐缓冲液;流动相B:乙腈;流动相C:超纯水。外标法定量。
1.2.6 啤酒风味物质测定
在测定前将样品放置在4℃条件下保存,主要是为了防止残留酵母细胞的生长和挥发性风味物质的挥发。在气质萃取瓶中加入12 mL样品和3 g NaCl,接着用PTFE-silicone瓶盖密封后进行HSSPME-GC-MS分析。色谱条件:采用60µm CARPDMS萃取头,将装有样品的萃取瓶在45℃下平衡15 min,顶空萃取30 min。柱型采用DB-Wax毛细管柱(60 m×0.25 mm×0.25µm),载气:氦气,流速:1.0 mL/min,分流比:20∶1。升温程序:40 ℃,保持2 min,然后以6℃/min的速度升温至230℃,保温3 min。进样口温度为230℃。质谱条件:离子源温度为240℃,电离方式EI,电离电压70 eV,质量扫描范围m/z 40~450 u。化合物鉴定采用计算机谱库(NIST2011谱库)检验分析,进行定性,用内标正辛醇定量,所得风味物质为相对于内标的含量。
1.2.7 麦汁发酵度的计算
麦汁发酵度是啤酒发酵过程中麦汁固形物被酵母消耗的百分数。计算公式如下:
1.3 数据分析
每个数据均为3次测定的平均值,采用Minitab 16进行数据分析,SPSS 20进行相关性分析,结果以均值±标准差表示,多重比较采用Tukey法,显著水平P<0.05。
2 结果与分析
2.1 不同麦汁浓度对酵母生长和活细胞率的影响
酵母细胞数反映的是酵母生长的状况,酵母活细胞率则表示了环境中酵母新陈代谢的整体能力。由图1A可知,不同氮源水平的麦汁中,悬浮酵母细胞数在发酵初期快速增加,高浓20°P和24°P在发酵第1天中,增加速度均低于其他浓度麦汁,这可能是高渗透压导致酵母细胞生长在发酵初始阶段产生一个短暂的延滞期。在发酵第2天悬浮细胞数最多,酵母净生长量随着麦汁浓度的增大而减小,这是因为高渗透压抑制了酵母生长。在第2天后,因为酵母细胞的絮凝导致悬浮酵母细胞数逐渐下降。酵母絮凝性是啤酒酵母的一个重要特性,在生产过程中絮凝性的强弱不仅可控制啤酒的发酵周期、过滤性能等,而且会对啤酒的风味产生影响,这在生产上具有特殊意义,酵母絮凝性也是区别酵母菌株的一项重要指标[17-18]。主发酵温度一定时,原麦汁浓度对酵母絮凝性影响较大,原麦汁浓度越高,酵母絮凝性越低[19]。发酵2 d后,16°P、20°P、24°P高浓麦汁中的悬浮酵母数总是多于8°P低浓和12°P常浓中的悬浮酵母数,这是由环境中丰富的氮源对细胞生长的促进作用所导致。可见,丰富的FAN增强了酵母细胞活性、促进了酵母后期的生长,从而缓解了高渗透压对酵母细胞的胁迫作用[20]。
酵母活细胞率的变化如图1B,同悬浮酵母细胞数变化规律相似,呈现了先上升后下降的趋势。在发酵第2天活细胞率最大,且麦汁浓度增大,活细胞率显著降低;在发酵第2天后,8°P和12°P麦汁中活细胞率均大于高浓麦汁;在发酵进入末期之前,所有试验组的酵母活细胞率均保持在较高水平(≥95%),发酵后期有所降低;当麦汁浓度≤16°P时,发酵结束后活细胞率仍保持在90%以上,20°P和24°P麦汁中的活细胞率在发酵末期显著下降,尤其是24°P麦汁,最后的活细胞率低于80%,这是因为累积的高乙醇对酵母细胞产生了毒害作用[21]。
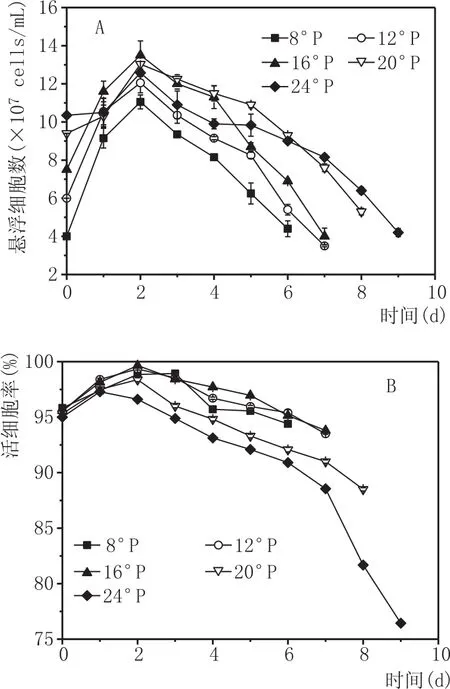
图1 发酵过程中悬浮酵母细胞个数(A)和活细胞率(B)的变化
2.2 不同浓度麦汁发酵过程中FAN的消耗情况
FAN含量的高低作为一个重要的指标,反映了酵母在生长繁殖、新陈代谢等过程中对环境中氮源的需求。有报道指出,FAN消耗主要集中在酵母细胞的生长对数期,而在稳定期和衰亡期消耗很低[22]。发酵过程中游离氨基氮水平的变化情况见图2。由图2可知,在不同浓度麦汁发酵过程中,FAN水平的变化趋势一致,酵母对FAN的快速吸收主要集中在接种后的24 h内。在发酵2 d时,FAN水平逐渐升高,之后依次呈现降低、升高的波动趋势,产生这种现象的原因是:营养物质缺乏时,酵母细胞在缓慢吸收氮源的同时也在代谢产氮,在发酵24 h前处于酵母细胞生长的对数期,大量的FAN被酵母细胞吸收用于自身的生长繁殖,在约24 h时进入稳定期,活细胞数最大,酵母细胞对FAN的消耗趋于平稳降低,酵母细胞代谢产物中的氮源与酵母吸收利用的可同化氮源几乎相等,使环境中的FAN水平趋于不变,此时的FAN水平最低,在24 h后,随着发酵的继续进行,环境中可利用的氮源缺乏及酵母生长进入稳定期和衰亡期,使酵母细胞代谢释放到环境中的氮源水平高于吸收的氮源水平,故发酵环境中的FAN水平呈现上升趋势。在发酵末期,8°P和12°P麦汁中的FAN水平不再有明显的变化,而16°P、20°P、24°P高浓麦汁中FAN水平持续上升,是因为发酵后期乙醇的大量积累对酵母细胞产生了毒害作用,致使酵母细胞生理和结构形态发生变化,导致细胞内大量的氮源被释放出来;并且麦汁浓度越高,FAN水平升高幅度越大,说明发酵末期乙醇累积量越大,对酵母细胞产生的毒害作用和细胞被损坏的程度也就越大,释放到环境中的FAN就会越多。由图2也可看出,高浓麦汁发酵不仅延长了发酵时间,而且也增加了FAN的消耗量(8°P麦汁中FAN的消耗量为386.84 mg/L,12°P的为507.74 mg/L,16°P的为599.28 mg/L,20°P的为638.78 mg/L,24°P的为623.11 mg/L)。
2.3 不同麦汁浓度对酵母发酵度的影响

图2 发酵过程中游离氨基氮水平的变化
麦汁发酵度反映了酵母对糖的利用情况,麦汁发酵度越高,表明酵母对糖的利用越充分,则环境中残留的糖就会越少。糖的不完全利用会导致腐败微生物的生长从而增大了啤酒受污染的风险[23]。在本研究中,常浓12°P麦汁的发酵度最大,为86%(图3),8°P麦汁的发酵度有所降低(84.29%),这可能是由于较低的氮源水平导致细胞生长速度缓慢,降低了细胞对糖的转化率[23]。16 °P、20 °P、24 °P麦汁的发酵度分别为85.83%、82.5%和81.98%,在高浓条件下,麦汁浓度越高,发酵度越低,这可能是因为高渗透压引起酵母活性发生改变、降低了发酵速率[24],另一个原因是发酵后期的高乙醇浓度影响了酵母细胞活性、降低了细胞对糖的转化速率[25]。然而12°P常浓麦汁与16°P高浓麦汁的发酵度之间没有显著性差异(P>0.05),这是因为高的FAN水平改善了酵母细胞生长率和发酵度[14],丰富的FAN调控酵母细胞适应了高渗透压和其他环境胁迫,使得发酵初期高的糖浓度所形成的高渗透压未能对酵母细胞产生很大的影响,从而未能明显地抑制发酵。24°P超高浓麦汁和12°P常浓麦汁的发酵度之间存在显著性差异(P<0.05),这是发酵后期高乙醇浓度所致[26]。

图3 不同麦汁浓度对发酵度的影响
2.4 不同麦汁浓度对乙醇产量的影响
乙醇产量是基于发酵过程中酵母所转化的糖的总量(主要是葡萄糖、麦芽糖和麦芽三糖),它和发酵度、酵母细胞数、麦汁营养成分(主要是氮源和碳源)之间都是相互联系的,发酵环境中丰富的营养成分促进酵母细胞生长,提高发酵度,高的糖含量和大量的酵母导致高的乙醇产量。酵母对乙醇的耐受性一定程度上依赖于菌种,啤酒酵母对乙醇的耐受性较低,通常情况下,乙醇浓度超过10%vol会严重抑制酵母菌的生长[27]。不同浓度麦汁中酵母的产乙醇量如图4,随着麦汁浓度增大,酵母的最终的乙醇产量依次增加,并且有显著性差异(P<0.05)。24°P超高浓麦汁中的酵母产乙醇量最大,为11.48%vol;16°P和20°P高浓麦汁中酵母的乙醇产量分别是7%vol和10.59%vol,均高于常浓麦汁(5.32%vol),而低浓麦汁中乙醇产量仅为3.1%vol,这是因为低浓麦汁中营养物质的缺乏影响了酵母的发酵,而常浓及高浓麦汁中丰富的营养组成满足了酵母对糖的降解。

图4 不同麦汁浓度下的乙醇产量
2.5 不同麦汁浓度对啤酒风味的影响
不同麦汁浓度对啤酒高级醇、酯产量的影响见表1。麦汁浓度从8°P升高至24°P,总高级醇的含量增加,总酯的含量减少。主要的高级醇有:异戊醇和苯乙醇,随着麦汁浓度增大异戊醇的含量显著增加,16 °P、20 °P、24 °P高浓麦汁中的异戊醇含量分别约为常浓麦汁(16 °P)的1.26、1.44、1.86倍,而苯乙醇的含量快速降低,但总高级醇的含量是呈增加趋势,这是因为麦汁中α-氨基氮含量对啤酒发酵时高级醇生成量有明显影响,α-氨基氮含量过高或过低都会使高级醇生成量增加[28]。说明高浓麦汁中丰富的氮源水平促进了啤酒高级醇的生成。此外,乙酸乙酯产量在24°P超高浓麦汁发酵中最大,为13.52 mg/L;随着麦汁浓度的增大,辛酸乙酯、癸酸乙酯含量在减少,丁酸乙酯、庚酸乙酯、壬酸乙酯在高浓发酵后麦汁中含量很少,甚至未检测到,说明高渗透压环境改变了酵母细胞对酯的代谢[29]。

表1 不同麦汁浓度发酵下啤酒的风味物质组成 (mg/L)
啤酒中高级醇和酯的比例是衡量啤酒感官的一个重要指标,优质啤酒的醇酯比一般在4~5∶1的水平[30]。本研究中随着麦汁浓度增大,醇酯比呈升高趋势,8 °P、12 °P、16 °P、20 °P、24 °P麦汁发酵结束后,高级醇酯比分别约为0.87∶1、1.62∶1、3.06∶1、4.06∶1、4.07∶1,可见,高浓麦汁发酵增加了啤酒的柔和性,使啤酒口感更加协调,这对生产是非常有利的。
2.6 不同浓度麦汁发酵过程中氨基酸的同化
发酵过程中麦汁游离氨基酸的浓度和种类是酵母细胞对其吸收和分泌的综合结果。本研究分别在麦汁发酵开始和结束时对麦汁中的游离氨基酸组成和含量进行了测定,通过氨基酸同化量来确定不同麦汁浓度条件下酵母对氨基酸的吸收规律和适应高浓条件的关键氨基酸,见表2。结果发现,当麦汁浓度从8°P升高到20°P时,总的游离氨基酸同化量显著增加(提高了60%),这说明在啤酒高浓酿造中酵母需要更多的额外可同化氮源适应环境胁迫[20]。然而,超高浓24°P的总氨基酸同化量最低,这是因为高渗透压抑制了酵母的生长,影响了酵母对营养物质的消耗。此外,在不同的渗透压条件下,Asp、Ser、Arg、Met、Lys和Trp的同化量都保持在较高水平,Phe和Trp的同化量随麦汁浓度的增大逐渐升高,这与不同浓度麦汁改变了酵母对氨基酸的同化模式有关系。试验中麦汁浓度的升高增加了发酵环境中总的游离氨基酸水平,但是,麦汁中氨基酸含量的升高并不一定能促进酵母对氨基酸的同化,这是氮代谢物阻遏效应的结果[31]。

表2 不同麦汁浓度发酵下酵母对游离氨基酸的同化 (mg/L)
2.7 高渗透压环境胁迫下关键氨基酸的确定
根据不同浓度麦汁发酵过程中氨基酸的同化量与麦汁发酵度、乙醇产量和酵母活细胞率的相关性分析得到(表3):在不同麦汁浓度条件下Ser、Met、Phe、Trp与酵母活细胞率呈显著正相关性,His与发酵度呈显著正相关,Phe与乙醇产量也呈显著正相关,说明这几种氨基酸对酵母适应高渗透压环境胁迫作用有显著的影响。

表3 游离氨基酸同化量与发酵性能各指标之间的相关性分析a
3 结论
随着麦汁浓度升高,乙醇产量显著增加,FAN的消耗升高,酵母生长减缓,发酵后期活细胞率降低,高级醇产量显著增加,酯产量减少,有效增大了高级醇酯比,有利于改善啤酒风味,使得啤酒口感更加柔和、协调。此外,高浓麦汁产生的高渗透压可导致酵母在生长初期出现短暂的延滞期,但丰富的氮源能很快消除高渗透压的抑制作用,提高酵母的发酵性能。在不同麦汁浓度下,酵母对各氨基酸的同化量不尽相同,并经高渗透压环境胁迫下酵母对游离氨基酸的同化量与发酵结束时麦汁的发酵度、乙醇产量、酵母活细胞率的相关性分析得到:Ser、Met、Phe、Trp、His的同化量与发酵性能呈显著正相关性,说明这些氨基酸有助于酵母适应高渗透压的环境胁迫。
[1]CASEY G P,MAGNUS C A,INGLEDEW W M.High-gravity brewing:effects of nutrition on yeast composition,fermentative ability,and alcohol production[J].Applied&environmental microbiology,1984,48(3):639.
[2]周波,张翠英,陈叶福,等.高浓高温对啤酒酵母发酵性能的影响[J].中国酿造,2016,35(2):9-12.
[3]孙向军,姚晓敏.啤酒高浓酿造的研究[J].食品与发酵工业,2001,27(7):19-21.
[4]THOMAS K C,INGLEDEW W M.Fuel alcohol production:effects of free amino nitrogen on fermentation of very-high-gravity wheat mashes[J].Applied&environmental microbiology,1990,56(7):2046-2050.
[5]O'CONNOR-COX E S C,LODOLO E J,AXCELL B C.Role of oxygen in high-gravity fermentations in the absence of unsaturated lipid biosynthesis[J].Journal of the American Society of Brewing Chemists,1993,51:97.
[6]赵伯辰,雷宏杰.高浓麦汁改良提高啤酒酵母发酵性能的研究进展[J].酿酒科技,2016(10):94-98.
[7]刘春凤,李崎.接种量对高浓发酵及风味物质的影响[J].啤酒科技,2007(9):59-61.
[8]刘春凤,郑飞云,李永仙.高浓酿造与啤酒风味协调柔和性[J].啤酒科技,2006(10):15-17.
[9]刘明丽,常宗明,尹花,等.高浓啤酒醇酯调控技术的研究与应用[J].食品工业科技,2015,36(19):190-194.
[10]周波,张翠英,陈叶福,等.高浓高温对啤酒酵母发酵性能的影响[J].中国酿造,2016,35(2):9-12.
[11]LEKKAS C,STEWART G G,HILLA E,et al.The importance of free amino nitrogen in wort and beer[J].Technical quarterly-Master Brewers Association of the Americas,2005,42(2):113.
[12]PATEL G B,INGLEDEW W M.The relationship of acid-soluble glycogen to yeast flocculation[J].Canadian journal of microbiology,1975,21(10):1608.
[13]PUGH TA,MAURER J M,PRINGLE A T.Impact of wort nitrogen limitation on yeast fermentation performance and diacetyl[J].Technical quarterly,1997.
[14]PEREZ-CARRILLO E,SERNA-SALDIVAR S O,CHUCK-HERNANDEZ C,et al.Addition of protease during starch liquefaction affects free amino nitrogen,fusel alcohols and ethanol production of fermented maize and whole and decorticated sorghum mashes[J].Biochemical engineering journal,2012,67(1):1-9.
[15]杨瑞娟,吴雪昌.酿酒酵母体内氮的代谢作用[J].农机化研究,2008(1):35-39.
[16]雷宏杰.高浓麦汁氮源组成对酵母氨基酸同化及发酵调控影响的研究[D].广州:华南理工大学,2014.
[17]郭立芸.18°P高浓酿造抗葡萄糖阻遏效应啤酒酵母的选育[J].食品与发酵工业,2015,41(4):91-96.
[18]MARGARET J,PIERCE J S.Absorption of amino acids from wort by yeasts[J].Journal of the Institute of Brewing,1964,70(4):307-315.
[19]熊丹.麦芽对啤酒酵母絮凝性的影响和测定方法探讨[J].啤酒科技,2013(9):15-19.
[20]PIDDOCKE M P,FAZIO A,VONGSANGNAK W,et al.Revealing the beneficial effect of protease supplementation to high gravity beer fermentations using"-omics"techniques[J].Microbial cell factories,2011,10(1):27.
[21]张强,郭元,韩德明.酿酒酵母乙醇耐受性的研究进展[J].化工进展,2014,33(1):187-192.
[22]ARIFEEN N,KOOKOS I K,WANG R,et al.Development of novel wheat biorefining:effect of gluten extraction from wheat on bioethanol production[J].Biochemical engineering journal,2009,43(2):113-121.
[23]PIDDOCKE M P,KREISZ S,HELDTHANSEN H P,et al.Physiological characterization of brewer's yeast in high-gravity beer fermentations with glucose or maltose syrups as adjuncts[J].Applied microbiology and biotechnology,2009,84(3):453-464.
[24]PEREIRA F B,GUIMARÃES P M R,TEIXEIRA J A,et al.Optimization of low-cost medium for very high gravity ethanol fermentations bySaccharomyces cerevisiaeusing statistical experimental designs[J].Bioresource technology,2010,101(20):7856-7863.
[25]BRIGGS D E,BROOKES PA,STEVENS R,et al.Brewing:science and practice[M].Elsevier,2004.
[26]PRATT P L,BRYCE J H,STEWART G G.The Effects of osmotic pressure and ethanol on yeast viability and morphology[J].Journal of the Institute of Brewing,2003,109(3):218-228.
[27]PRATT P L,BRYCE J H,STEWART G G,等.渗透压和乙醇对酵母活力和形态的影响[J].啤酒科技,2004(9):61-65.
[28]杨小兰,罗正明,胡仕屏,等.降低高浓啤酒发酵中高级醇含量的研究[J].食品科学,2011,32(9):188-192.
[29]刘华,高飞,陆健.不同发酵和营养条件下爱尔啤酒所产生的芳香活性酯[J].啤酒科技,2016(7):50-56.
[30]王殿忠,王江,魏洪仁.调整醇酯比、改善啤酒饮后感[J].啤酒科技,2007(7):39-40.
[31]BELTRAN G,NOVO M,ROZÈS N,et al.Nitrogen catabolite repression inSaccharomyces cerevisiaeduring wine fermentations[J].FEMS yeast research,2004,4(6):625.
