测定白酒中挥发性风味成分方法的研究
2018-06-21吴卫宇苏占元杨晓军张宿义赵金松
吴卫宇 ,苏占元 ,杨晓军 ,张宿义 ,秦 辉 ,赵金松 ,3,4
(1.国家酒类及加工食品质量监督检验中心泸州实验室,四川泸州646000;2.泸州老窖股份有限公司,四川泸州646000;3.国家固态酿造工程技术研究中心,四川泸州646000;4.四川理工学院,四川自贡643000)
白酒的主要成分是酒精和水,占总量的98%~99%,但决定白酒质量和风格的却是微量(占总量的1%~2%)的呈香呈味有机化合物及其量比关系[1]。白酒中呈香呈味有机化合物主要包括多元醇、有机酸、酯类、高级醇、醛类、芳香族化合物及杂环类化合物[2-4]。据报道,江淮流域单粮型酒中重要风味化合物有22种,从剑南春酒中检测出重要风味化合物21种,从五粮液酒中检测出重要风味化合物25种,这些重要风味物质相辅相成,使浓香型白酒的“香、味、格、体”协调统一[5]。
目前富集浓缩白酒中挥发性风味成分的前处理方法有直接进样、液液萃取、固相萃取、顶空固相微萃取及搅拌棒吸附萃取[6-9]等方法,用于分析检测白酒中挥发性风味成分的仪器主要有GC、GC-O、GC-MS及GC×GC-TOFMS[10-13]。
气相色谱串联四级杆飞行时间质谱仪(GC/Q-TOFMS)是在飞行管和检测器之前使用六级杆碰撞池执行MS/MS,被色谱柱分离的样品首先通过电子轰击EI离子源进行电离,电离之后,离子将通过四级杆质量分析器,质量分析器包括4根平行双曲面杆,通过这4根平行双曲面杆,可以根据选定离子的质荷比(m/z)来过滤这些离子。通过四级杆的离子随后被引导至碰撞池,该碰撞池设置为选择和碎裂前级离子以形成产物离子,这些离子通过切片器传送,到达飞行管末端时,它们将从反射器或双极离子镜弹开,朝相反的路径向下回到飞行管底部。模数检测器位于飞行管的底部,它将计算离子的数量并将信号发送到特定软件以进行数据收集和分析。故而,气相色谱串联四级杆飞行时间质谱仪(GC/Q-TOFMS)具有高的分离能力、质量准确度、扫描速度、灵敏度及4~5个数量级的动态范围,可满足白酒中痕量级挥发性风味成分的检测[14]。本实验采用直接进样结合气相色谱串联四级杆飞行时间质谱仪(GC/Q-TOFMS)建立了一种测定白酒中79种主要挥发性风味成分的方法,该方法具有较高的准确度和灵敏度,能够满足白酒中主要挥发性风味成分的测定。
1 材料与方法
1.1 材料、试剂及仪器
酒样:市售白酒样品。
仪器设备:7890B/7200Q-TOF气相色谱串联四级杆飞行时间质谱仪,美国安捷伦科技公司;超纯水处理系统,美国密理博公司;电子天平(220 g,0.1 mg),赛多利斯科学仪器有限公司;移液枪(0~100 μL及100~1000 μL),大龙医疗设备(上海)有限公司。
标准品(色谱纯,纯度≥99.9%):甲酸乙酯、乙酸乙酯、丙酸乙酯、异丁酸乙酯、乙酸丙酯、乙酸异丁酯、丁酸乙酯、异戊酸乙酯、乙酸异戊酯、戊酸乙酯、己酸乙酯、庚酸乙酯、乳酸乙酯、辛酸乙酯、苯甲酸乙酯、丁二酸二乙酯、肉豆蔻酸乙酯、亚油酸乙酯、月桂酸乙酯、棕榈酸乙酯、油酸乙酯、乙酸、丙酸、异丁酸、丁酸、异戊酸、戊酸、己酸、庚酸、辛酸、壬酸、月桂酸、苯甲酸、苯丙酸、肉豆蔻酸、棕榈酸、硬脂酸、油酸、亚油酸、乙醛、正丙醛、异丁醛、乙缩醛、异戊醛、己醛、糠醛、苯甲醛、2-丁酮、2-戊酮、2-己酮、3-羟基-2-丁酮、2,3-丁二酮、甲醇、2-丁醇、正丙醇、异丁醇、正丁醇、异戊醇、正戊醇、己醇、庚醇、2,3-丁二醇、1,2-丙二醇、糠醇、β-苯乙醇、吡啶、2-甲基吡嗪、2,5-二甲基吡嗪、三甲基吡嗪、3-乙基-2,5-二甲基吡嗪、2,3-二乙基吡嗪、四甲基吡嗪、愈创木酚、2-甲基苯酚、苯酚、4-乙基愈创木酚、对甲酚、3-甲基苯酚、4-乙基苯酚:西格玛奥德里奇(上海)贸易有限公司。
内标物(色谱纯,纯度≥99.9%):叔戊醇、乙酸正戊酯、2-乙基丁酸,天津市津科精细化工研究所。
水:符合GB/T 6682—2008规定的一级水,本实验室自制。
溶剂:无水乙醇(色谱纯)及加水配制为60%vol的乙醇溶液。
1.2 试验方法
1.2.1 GC-MS条件
色谱柱:VF-WAXms(60 m×0.25 mm×0.25 μm);载气:高纯He(99.999%);流速1 mL/min;进样模式:分流进样,分流比 20∶1;进样量:1 μL;载气:20.0 mL/min;进样口温度:250℃;程序升温:初始温度35℃保持10 min,以2℃/min升温至120℃,再以5℃/min升温至200℃,再以10℃/min升温至245℃,保持40 min;GC/Q-TOFMS接口温度:280℃;EI离子源;电离能量:70 eV;离子源温度:230℃,四级杆温度:150℃;质量扫描范围m/z:29~500。
1.2.2 内标溶液的制备
准确称量叔戊醇、乙酸正戊酯、2-乙基丁酸置于200 mL容量瓶中,用体积分数为60%的乙醇溶液稀释至刻度,摇匀,作为内标溶液,3种内标的浓度分别为15.19 g/L、15.10 g/L、15.09 g/L。
1.2.3 标准溶液的制备
混标1#:准确称取甲酸乙酯、乙酸乙酯、乙酸丙酯、乙酸异丁酯、乙酸异戊酯、丙酸乙酯、丁酸乙酯、异丁酸乙酯、戊酸乙酯、异戊酸乙酯、己酸乙酯、庚酸乙酯、乳酸乙酯、辛酸乙酯、丁二酸二乙酯、苯甲酸乙酯置于100 mL容量瓶中,用体积分数为60%的乙醇稀释至刻度,摇匀,作为标准储备液。该标准储备液中各组分的浓度分别为78.1 mg/L、1612.5 mg/L、70.1mg/L、878mg/L、614mg/L、80.9mg/L、1136.5mg/L、64.8 mg/L、711 mg/L、608 mg/L、4610 mg/L、710 mg/L、2427.5 mg/L、639 mg/L、715 mg/L、79.3 mg/L。
混标2#:准确称取月桂酸乙酯、肉豆蔻酸乙酯、棕榈酸乙酯、油酸乙酯、亚油酸乙酯置于50 mL容量瓶中,用无水乙醇稀释至刻度,摇匀,作为标准储备液。该标准储备液中各组分的浓度分别为88.4 mg/L、612 mg/L、310 mg/L、75.2 mg/L、736 mg/L。
混标3#:准确称取乙酸、丙酸、异丁酸、丁酸、异戊酸、戊酸、己酸、庚酸、辛酸、壬酸置于100 mL容量瓶中,用体积分数为60%的乙醇稀释至刻度,摇匀,作为标准储备液。该标准储备液中各组分的浓度分别为2272 mg/L、432 mg/L、589 mg/L、597 mg/L、930 mg/L、579 mg/L、1443 mg/L、686 mg/L、658 mg/L、623 mg/L。
混标4#:准确称取月桂酸、肉豆蔻酸、棕榈酸、硬脂酸、油酸、苯甲酸、苯丙酸、亚油酸置于100 mL容量瓶中,用无水乙醇稀释至刻度,摇匀,作为标准储备液。该标准储备液中各组分的浓度分别为286 mg/L、134 mg/L、365 mg/L、184 mg/L、189 mg/L、137 mg/L、64.3 mg/L、376 mg/L。
混标5#:准确称取乙醛、正丙醛、异丁醛、异戊醛、己醛、糠醛、苯甲醛、乙缩醛置于100 mL容量瓶中,用体积分数为60%的乙醇稀释至刻度,摇匀,作为标准储备液。该标准储备液中各组分的浓度分别为761 mg/L、313 mg/L、78.2 mg/L、385 mg/L、378 mg/L、761 mg/L、260 mg/L、1069 mg/L。
混标6#:准确称取2-丁酮、2-戊酮、2-己酮、2,3-丁二酮、3-羟基-2-丁酮置于100 mL容量瓶中,用体积分数为60%的乙醇稀释至刻度,摇匀,作为标准储备液。该标准储备液中各组分的浓度分别为426 mg/L、53.8mg/L、438 mg/L、280 mg/L、129 mg/L。
混标7#:准确称取甲醇、正丙醇、2-丁醇、异丁醇、正丁醇、异戊醇、正戊醇、正己醇、正庚醇、2,3-丁二醇、1,2-丙二醇、糠醇、β-苯乙醇置于100 mL容量瓶中,用体积分数为60%的乙醇稀释至刻度,摇匀,作为标准储备液。该标准储备液中各组分的浓度分别为860 mg/L、997 mg/L、283 mg/L、334 mg/L、292 mg/L、412 mg/L、308 mg/L、309 mg/L、285 mg/L、332 mg/L、347 mg/L、298 mg/L、416 mg/L。
混标8#:准确称取2-甲基吡嗪、2,5-二甲基吡嗪、三甲基吡嗪、2,3-二乙基吡嗪、3-乙基-2,5-二甲基吡嗪、四甲基吡嗪、吡啶置于100 mL容量瓶中,用体积分数为60%的乙醇稀释至刻度,摇匀,作为标准储备液。该标准储备液中各组分的浓度分别为232 mg/L、314 mg/L、298 mg/L、302 mg/L、399 mg/L、82 mg/L、387 mg/L。
混标9#:准确称取苯酚、3-甲基苯酚、2-甲基苯酚、4-乙基苯酚、对甲酚、愈创木酚、4-乙基愈创木酚置于100 mL容量瓶中,用体积分数为60%的乙醇稀释至刻度,摇匀,作为标准储备液。该标准储备液中各组分的浓度分别为141.2 mg/L、379 mg/L、404mg/L、110.7mg/L、584mg/L、500mg/L、419mg/L。
2 结果与讨论
2.1 样品前处理方法的选择
液液萃取方法操作简单、回收率高,但有机溶剂用量大,萃取浓缩过程中也会损失一部分易挥发性成分[15]。固相微萃取技术是在固相萃取技术基础上发展起来的一种集采样、萃取、浓缩和进样于一体的无溶剂样品萃取技术,该技术与固相萃取技术相比操作更简单、携带更方便并且克服了固相萃取回收率低、易堵塞孔道的缺点,但该技术需要配套的固相微萃取操作平台及萃取头,价格昂贵,不利于大批量处理样品[16]。搅拌棒吸附萃取技术是一种新型的固相微萃取样品前处理技术,具有固定相体积大、萃取容量高、无需外加搅拌子、可避免竞争性吸附、能在自身搅拌的同时实现萃取富集等优点,但同样具有价格昂贵不利于大批量处理样品的缺点[15]。本实验是针对大批量用于指导酿酒生产、酒体设计等工作的样品,故而选择直接进样法,该方法操作简单,无需有机溶剂,避免样品处理中微量成分的损失,具有简单快速、重现性好、检测准确度高并且成本消耗低等优点。
2.2 色谱柱的选择[10]
白酒色谱分析所用的毛细管柱通常都是极性柱,常见的有 DB-WAX、HP-INNOWAX、HPFFAP、DB-WAXFF及近几年刚刚上市的VFWAXms柱。本实验通过测试发现HP-FFAP柱无法将乙酸乙酯及乙缩醛分离开;HP-INNOWAX柱乙酸乙酯和乙缩醛、丁酸乙酯和正丙醇分离度不好;DB-WAX柱基本能把白酒中的挥发性风味成分分离开,但是酸类成分的峰形不佳;VF-WAXms柱能把白酒中的挥发性风味成分分离,并且峰形尖锐便于准确定量,故本实验优选色谱柱VF-WAXms(60 m×0.25 mm×0.25 μm)测定白酒中79种挥发性风味成分。
2.3 进样量和分流比的选择
进样量过大,容易造成柱子过载损害柱子的固定相液膜;进样量过小,使检测器响应信号降低不易检测出挥发性风味成分。因此,进样量和分流比对于组分的分离、仪器的响应有很大影响,进而影响定量的准确性[17]。本实验通过测试发现,当选用进样量1 μL、分流比20∶1时,79种组分得到了较好的分离,检测器响应较好,定量各种物质的线性关系较好。
2.4 升温程序的选择
对于含有多种微量成分的白酒样品,常常需要用程序升温分离,因为在恒温条件下,如果柱温较低,则低沸点组分分离较好,而高沸点组分的流出时间会太长,造成峰展宽,甚至滞留在色谱柱中造成柱污染;反之,当柱温太高时,低沸点组分又难以分离[18]。故而,本实验采用程序升温并且是多阶程序升温,升温速率较慢,可以较好的分离79种挥发性风味成分。
2.5 质谱定性定量
分别取混标1#、2#、3#、4#、5#、6#、7#、8#、9# 稀释液加内标,按照1.2.1条件进行全扫描,得到混标1#、2#、3#、4#、5#、6#、7#、8#、9#的总离子流色谱图分别见图1、图2、图3、图4、图5、图6、图7、图8、图9。并利用NIST2012标准图谱库进行检索,确定每种物质的保留时间和特征离子碎片,选择丰度相对较高的离子作为定性离子,把丰度较高并且与相邻峰之间无干扰的离子作为定量离子,质谱条件见表1。在相同条件下进行标样测定,采用峰面积比与质量浓度比的内标法结合标准曲线法定量分析。
2.6 方法线性范围
分别取混标 1#、2#、3#、4#、5#、6#、7#、8#、9#,用体积分数为60%的乙醇溶液稀释成5个梯度混合标样,分别移取5 mL到比色管中,并加入0.1 mL的内标溶液,摇匀,上机测定。以混标中各组分对应内标的峰面积比值为纵坐标,以混标中各组分与对应内标含量比值为横坐标,计算得到79种物质的回归线性方程和相关系数R2,结果见表2。
从表2可以看出,79种成分在上述条件下分析检测时,在各自浓度范围内具有很好的线性关系,相关系数R2≥0.99,能够满足白酒中主要挥发性风味物质的检测。
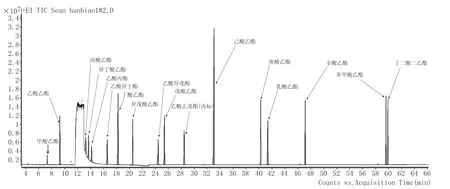
图1 混标1#总离子流色谱图

图2 混标2#总离子流色谱图

图3 混标3#总离子流色谱图

图4 混标4#总离子流色谱图

图5 混标5#总离子流色谱图

图6 混标6#总离子流色谱图
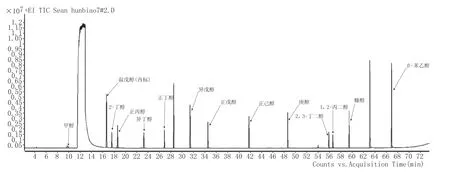
图7 混标7#总离子流色谱图

图8 混标8#总离子流色谱图

图9 混标9#总离子流色谱图
2.7 方法检出限、精密度和回收率
检出限和定量限主要是考察方法的灵敏度;而回收率主要是考察所建方法的准确度。本实验利用无水乙醇和水配制成不含这79种挥发性风味成分的60%vol白酒代用样,量取5 mL,分别添加3个浓度梯度D1(5 mL标准储备液)、D2(10 mL标准储备液)、D3(15 mL标准储备液),用60%vol的无水乙醇定容至25 mL,分别移取5 mL到比色管中,并加入0.1 mL的内标溶液,摇匀,每个浓度水平平行测试6次。利用上述水平进行添加回收率试验,平均回收率和相对标准偏差(RSD,n=6)结果见表3。并利用添加D1(5 mL标准储备液)的浓度水平为依据,3倍信噪比计算检出限,10信噪比计算定量限,计算结果见表3。
由表3可知,各成分平均回收率为95.67%~106.32%,RSD为1.20%~4.21%,方法检出限为0.027~1.69 mg/L,定量限为0.081~5.07 mg/L。能够满足白酒中主要挥发性风味物质的检测,用于指导酒厂生产实践及酒体设计工作。
3 结论
采用直接进样技术结合气相色谱串联四级杆飞行时间质谱仪(GC/Q-TOFMS)建立了一种测定白酒中79种主要挥发性风味成分的方法。在选定的色谱条件下,79种物质得到了较好的分离,在各自浓度范围内具有很好的线性关系,相关系数R2≥0.99,方法回收率在95.67%~106.32%,方法检出限和定量限分别为0.027~1.69 mg/L和0.081~5.07 mg/L。该方法具有较高的准确度和灵敏度,能够满足白酒中主要挥发性风味物质的测定。

表1 79种挥发性风味成分保留时间、定性和定量离子

续表1 79种挥发性风味成分保留时间、定性和定量离子

表2 79种挥发性风味成分工作标准曲线

续表2 79种挥发性风味成分工作标准曲线

续表3 79种挥发性风味成分方法检出限、精密度和回收率(n=6)
[1] 沈怡方.白酒生产技术全书[M].北京:中国轻工业出版社,1998:762-779.
[2]张卫卫,刘建学,韩四海,等.白酒基酒典型风味物质含量的测定方法与差异性研究[J].食品科学,2015(24):122-126.
[3]康文怀,徐岩.中国白酒风味分析及其影响机制的研究[J].北京工商大学学报:自然科学版,2012,30(3):53-58.
[4]傅国城.中国白酒香型划定背景与主流发展趋势的探讨[J].酿酒,2010,37(1):97-99.
[5]徐岩,范文来,王海燕,等.风味分析定向中国白酒技术研究的进展[J].酿酒科技,2010(11):73-78.
[6]蔡心尧,尹建军,胡国栋.毛细管柱直接进样法测定白酒香味组分的研究[J].色谱,1997,15(5):367-371.
[7]张五九,何松贵,韩兴林,等.豉香型白酒风味成分分析研究[J].酿酒科技,2010(12):58-64.
[8]冯俊旗.河南六种白酒香气成分的分析与构成规律研究[D].新乡:河南科技学院,2013.
[9]徐占成,陈勇,王双.利用全二维气质联用技术和吸附搅拌萃取技术对中国名酒剑南春酒体风味质量特色的研究[J].酿酒,2012,39(5):6-8.
[10]吴卫宇.毛细管色谱法测定白酒中多种微量成分[J].酿酒科技,2011(5):108-109.
[11] 徐占成,王双,徐姿静,等.色谱闻香技术GC/O在蒸馏酒中的应用[J].酿酒科技,2011(6):42-44.
[12] 李俊刚,郭文宇,罗英,等.利用GC-MS法对不同窖龄下浓香型白酒风味物质的研究[J].中国酿造,2015,34(9):141-144.
[13]季克良,郭坤亮,朱书奎,等.全二维气相色谱/飞行时间质谱用于白酒微量成分的分析[J].酿酒科技,2007(3):100-102.
[14]Agilent Technologies.Agilent7200精确质量四级杆飞行时间GC/MS系统概念指南大图景[M].Santa Clara:Agilent Technologies,2009.
[15]张琪,徐勇,沈才洪,等.浓香型白酒挥发性风味成分分析研究进展[J].酿酒科技,2017(12):98-104.
[16]谢建春.现代香味分析技术及应用[M].北京:中国标准出版社,2008:96.
[17]刘坤.气相色谱法测定白酒中的主要成分[J].河北化工,2012,35(3):58-60.
[18]王宇成.最新色谱分析检测方法及应用技术实用手册[M].吉林:吉林省出版发行集团,2004(11):693-701.
