扶正化瘀胶囊对心肌梗死大鼠心肌纤维化及TGF-β1/Smads信号通路的影响
2018-06-20,,,,,,,,
,,,,,, , ,
心肌纤维化是多种心血管疾病发展到一定阶段的共同病理改变,是心肌重构的主要表现之一,可致心肌僵硬度增加、心室舒张功能减退、心律失常,甚至猝死,是影响心血管疾病预后极为重要的因素。预防和逆转心肌纤维化已成为防治心血管系统疾病的焦点之一。转化生长因子-β1(TGF-β1)是最重要的致纤维化生长因子之一[1-2],可促进细胞的增殖、分化和胶原的合成、结缔组织增生,同时对胶原的降解具有抑制作用[3-4],Smads蛋白是TGF-β的下游信号分子之一,介导TGF-β1的细胞内信号转导。TGFβ/Smads信号通路与心肌纤维化密切相关,对心肌梗死后纤维化的发生具有促进作用[5- 6]。扶正化瘀胶囊主要由丹参、桃仁、松花粉、五味子、绞股蓝、虫草菌丝等药物组成。前期研究证实,扶正化瘀胶囊对心肌纤维化具有改善作用[7],但其具体作用机制尚不明确。本研究拟制作心肌梗死后心肌纤维化大鼠模型,观察扶正化瘀胶囊对模型大鼠TGF-β1/Smads通路中主要因子TGF-β1、smad3、smad4、smad7的影响,探讨其抗心肌纤维化的可能作用机制。
1 材料与方法
1.1 实验动物 雄性SD大鼠,清洁级,体重220 g~250 g,由北京维通利华实验动物技术有限公司提供,许可证编号:SCXK(京)2002-0003,饲养于北京中医药大学东直门医院屏障动物室。
1.2 药物及试剂 扶正化瘀胶囊(上海黄海制药有限责任公司生产,批号151040);卡托普利片(中美上海施贵宝制药有限公司生产,批号AAD7212);Trizol试剂(批号:15596026,Ambion公司);反转录试剂盒(批号:K1662,Thermo Fisher Scientific);SYBR Select Master Mix (批号:4472908,Applied Biosystems);目的基因引物由北京赛诺基因组研究所中心有限公司合成;兔源单克隆抗体β-actin(ab8227),兔源多克隆抗体TGF-β1(ab92486),兔源单克隆抗体smad 3(ab40854)、兔源单克隆抗体smad4(ab40759)、兔源多克隆抗体smad7(ab190987)、兔源单克隆抗体GAPDH(ab181602)均购自英国abcam公司,RIPA裂解缓冲液(批号:C1053)、蛋白酶抑制剂混合物(型号:P1265)、蛋白质定量试剂盒(型号:P1511)、5%脱脂奶粉(型号:P1622)、柯达胶片(型号:E1122)均来源于北京普利莱基因技术有限公司。超敏ECL化学发光检测试剂盒(编号:B500022,proteintch科技有限公司);兔二步法免疫试剂盒(型号:PV-9001)、进口山羊血清(型号:ZLI-9022)、抗体稀释剂(型号:ZLI-9030)、DAB显色试剂盒(型号:ZLI-9018)均由北京中杉金桥生物技术有限公司提供。
1.3 主要仪器 动物呼吸机(上海奥尔科特生物科技有限公司,ALC-V8型),心电图仪(CardiMax FX-7202),Vevo高分辨率小动物超声影像系统(加拿大VisualSonics Inc公司, TM2100型),超薄切片机LEIA RM2135(Feica公司),高倍显微镜 BX60(OLYMPUS公司),图像采集系统SPOT FLEX(美国 Diagnostic Instrument公司),千分之一电子天平(中国上海精密科学仪器有限公司JA1003N型),4℃离心机(上海沪粤明科学仪器有限公司,lolTGL-16G型),基因扩增仪(美国AB公司,GeneAmp PCRsystem9700型),安捷伦实时荧光定量PCR仪(美国安捷伦科技公司,Mx3000P型),DYY-6C型电泳仪(北京市六一仪器厂),电热恒温水浴锅(北京市长风仪器仪表公司,HW.SY11-K型)。
1.4 模型制备 参照文献[8]制备模型,大鼠经1%戊巴比妥钠(50 mg/kg)腹腔麻醉后,背位固定,经喉行气管插管术,连接呼吸机,以80次/min、潮气量0.7 mL~0.8 mL行人工呼吸。于左胸第三、四肋间打开1.5 cm开口,撕开心包膜后,用眼科弯镊轻提左心耳,在动脉圆锥与左心耳之间下1 mm处用5/0手术线结扎左冠状动脉前降支,迅速关胸,逐层缝合。心电图Ⅱ导联显示ST段显著抬高表示结扎成功。假手术只穿线不结扎。
1.5 分组与给药方法 模型成功后,随机分为模型组、扶正化瘀组、卡托普利组,每组6只。按体表面积折算大鼠的等效剂量[9],即扶正化瘀胶囊0.4 g/(kg·d),卡托普利2.25 mg/(kg·d)灌胃,模型组和假手术组给予等量去离子水,每日1次,连续8周。
1.6 指标检测
1.6.1 超声心动图评价急性心肌梗死(AMI)大鼠心脏结构和功能 8周后,采用超声心动图检查各组大鼠心脏结构和功能指标:室间隔收缩末期厚度(IVSTs)、室间隔舒张末期厚度(IVSTd)、左心室舒张末期内径(LVDd)、左心室收缩末期内径(LVDs)、左室射血分数(LVEF)、左室短轴缩短分数(LVFS)。
1.6.2 免疫组化法检测大鼠心肌组织TGF-β1蛋白的表达 取梗死边缘区心肌组织,4%多聚甲醛固定,石蜡包埋,切片。梯度乙醇脱蜡,3%H2O2室温孵育15 min,微波修复后0.01%PBS漂洗5 min×3次,山羊血清封闭30 min,滴加TGF-β1(1∶100)一抗,置湿盒中4℃孵育过夜。加辣根过氧化物酶标记的二抗湿盒中室温孵育20 min,DAB显色,光学显微镜下观察显色情况,自来水终止反应。梯度酒精和二甲苯脱水透明,中性树脂封片。阴性对照除用PBS代替一抗进行孵育外,其余步骤相同,图像经image Pro plus6.0分析软件采集数据,每组6张切片,每张切片随机选择5个视野,计算阳性区域所占总面积。
1.6.3 Western blot法检测大鼠心肌组织中的Smads蛋白的表达情况 按蛋白抽提试剂盒说明书提取总蛋白,BCA法定量。取50 μg蛋白,经十二烷基磺酸钠聚丙烯酰胺凝胶(SDS-PAGE)电泳进行分离,冰水混合物中恒流250 mA 2 h转至硝酸纤维素膜膜上。5%脱脂奶粉室温封闭1 h,加入兔源单克隆或多克隆抗体smad3(1∶5000)、smad4(1∶5000)、smad7(1∶4 000)4 ℃摇动孵育过夜。室温洗膜后,加入辣根过氧化物酶偶联的IgG抗体。洗去未结合的二抗,滴加化学发光剂ECL进行发光显影。以β-actin(1∶10 000)为内参照。灰度扫描后用Image J软件分析条带的灰度值,结果以目的蛋白/内参的比值表示。
1.6.4 实时荧光定量PCR法检测各组大鼠心肌组织TGFβ/smads mRNA的表达 采用Trizol试剂提取总RNA,紫外分光光度计测定吸光度A260/A280,计算其浓度及纯度。采用二步法进行mRNA表达的检测。反转录按试剂盒说明书操作,取2 μg总RNA,在反转录酶M-MuLV和引物olig(dT)15条件下进行反转录,得到cDNA链。以cDNA为模板进行实时荧光定量PCR反应,反应体系为25 μL,含1 μL cDNA,10 μmol/L上下游引物各1 μL,2×SYBER Green PCR mix 12.5 μL,不足的体积以无RNA酶的水补齐。以GAPDH作为内参照。每个样本设3个复孔。循环参数:预变性95 ℃×10 min,变性95 ℃×1 min,退火55 ℃×30 s,延伸72 ℃×20 s,共40个循环。TGF-β1引物:sense 5’-AGGGCTACCATGCCAACTTC-3’,antisense 5’-CCACGTAGTAGACGATGGGC-3’;smad3引物:sense 5’-ATACGGATGTTCAAGTTCG-3’,antisense 5’-ACTGGGTCCTCTTTGGTTTT-3’;smad4引物:sense 5’-CTTGGGGCAAGACTGCAAAC-3’,antisense 5’-GGTACAGTCAATGCGTCCCA-3’;smad7引物:sense 5’-GAAGTCAAGAGGCTGTGTTGC-3’,antisense 5’-CAGGCTCCAGAAGAAGTTGG-3’;GAPDH引物:sense 5’-AGTTCAACGGCACAGTCAAG-3’,antisense 5’-TACTCAGCACCAGCATCACC-3’。所得Ct值按照2-△△Ct法均一化处理后进行统计。

2 结 果
2.1 各组大鼠超声心动图指标结果 与假手术组相比,模型组左心室室壁收缩运动减弱乃至消失,左心室腔明显增大;IVSTd、IVSTs变薄,LVDs、LVDd增大,LVEF、LVFS明显降低(P<0.05)。与模型组相比,扶正化瘀组和卡托普利组室壁收缩情况有所增强,左心室腔扩张程度减弱,LVEF、LVFS明显增高(P<0.05);扶正化瘀组IVSTs变厚,LVDs变小(P<0.05),IVSTd变厚,LVDd减小,但无统计学意义;卡托普利组IVSTd、IVSTs变厚,LVDs减小(P<0.05)。详见表1。

表1 各组大鼠心脏超声心动图指标比较(±s)
2.2 各组大鼠心肌梗死边缘区TGF-β1表达的影响 与假手术组相比,模型组大鼠梗死边缘区TGF-β1蛋白表达明显增加(P<0.01);扶正化瘀方组、卡托普利组TGF-β1蛋白表达较模型组减少(P<0.01)。详见图1、表2。

图1各组大鼠梗死边缘区TGF-β1蛋白表达(×40)

表2 各组大鼠心肌梗死边缘区TGF-β1的表达(±s) μm2
2.3 各组大鼠心肌梗死边缘区smad3、smad4和smad7蛋白表达的影响 与假手术组相比,模型组smad3、smad4蛋白表达呈增多趋势,smad7蛋白表达则呈减少趋势;与模型组比较,扶正化瘀组、卡托普利组smad3、smad4蛋白的表达呈下降趋势,smad7蛋白的表达呈增高趋势,仅卡托普利组与模型组比较,有统计学意义(P<0.05)。详见图2、表3。
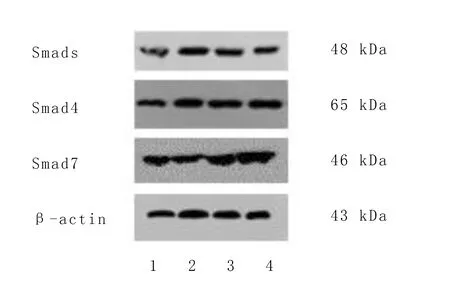
1为假手术组; 2为模型组 ; 3为扶正化瘀方组; 4为卡托普利组。

表3 各组大鼠梗死边缘区smad3、smad4、smad7蛋白表达比较(±s)
2.4 各组大鼠心肌梗死边缘区TGF-β1、smad3、smad4和smad7mRNA水平的影响 与假手术组相比,模型组大鼠心肌梗死边缘区TGF-β1、smad3、smad4 mRNA表达水平升高(P<0.05 或P<0.01),smad7 mRNA表达水平下降(P<0.05)。与模型组相比,扶正化瘀组和卡托普利组TGF-β1、smad3、smad4的mRNA水平降低 (P<0.05 或 P<0.01),smad7的mRNA水平增加(P<0.05或P<0.01)。详见表4。

表4 各组大鼠TGF-β1、smad3、smad4和smad7 mRNA表达水平(±s,2-△△Ct)
3 讨 论
超声心动图是评估心血管局部纤维化及心肌功能的一项重要无创性诊断技术[10],可从回声增强及运动能力减弱来定性评价心肌瘢痕的形成[11]。实验结果显示,模型大鼠左心室室壁收缩运动减弱乃至消失,室间隔变薄,左心室腔明显增大,而代表左室收缩功能的LVEF和LVFS显著下降,提示急性心肌梗死后,模型大鼠有心肌纤维化发生,出现了离心性左室重构和左心室功能障碍。与模型组相比,扶正化瘀胶囊和卡托普利可明显改善心脏结构和功能,提示二者对大鼠急性心肌梗死后的心肌纤维化心室重构、心功能降低都有较好的改善作用。
心肌纤维化是心肌细胞外基质过度沉积导致的心脏病理性改变。有研究发现,心肌纤维化与各种生长因子如TGF-β1产生和分泌密切相关。TGF-β1超家族是一类重要的生长因子,不仅介导细胞的生长、增殖、分化,而且在创伤愈合、细胞外基质的形成等方面具有重要作用。TGF-β1信号通路被认为是组织修复和纤维化的重要通路[12]。TGF-β1作为心血管系统最重要的异构体,参与了心肌纤维化的发生发展。外伤、AngⅡ、醛固酮、炎症刺激等病理情况下,TGF-β1被活化,促使心脏成纤维细胞向肌成纤维细胞转化,加速细胞外基质的合成与分泌,并抑制胶原的降解从而导致心肌纤维化进行性加重[13]。Smads是TGF-β1信号通路中下游主要效应分子,包括受体激活型Smads(R-smads)如smad1、smad2、smad3、smad5、smad8,共同通路型smads(Co-smads)如smad4,抑制型smads(I-smads)如smad6、smad7。其中smad2、smad3、smad4、smad7主要参与纤维化的过程。在TGF-β1信号通路中信号转导通过Smad2、Smad3蛋白介导,活化的TGF-β1与细胞膜上的TβR受体结合形成二聚体复合物,该二聚体复合物C末端发生磷酸化后,与R-Smads蛋白的MH2端结构结合磷酸化Smad2、Smad3蛋白,磷酸化的Smads蛋白与Co-Smads形成多聚体复合物共同进入核内参与调控相关基因的表达[14]。Smad4是TGF-β1必要的信号中转分子,在信号转导中起承接作用,Smad4不会直接与受体发生相互作用,但是能直接与DNA结合来调控有关基因的表达;Smad7作为负性调控因子,可竞争性的与TGFβ受体(TβR)结合形成受体复合物,阻止R-Smads的磷酸化,阻断TGF-β1的细胞内效应,从而抑制纤维化的发生[15]。
本实验结果显示,模型大鼠梗死边缘区TGF-β1、smad3、smad4及其mRNA表达增加,而smad7及其mRNA表达减少,提示冠脉结扎8周后,TGF-β1/smads信号通路中促纤维化因子表达增强、抑制纤维化形成的因子减少。给予扶正化瘀胶囊或卡托普利治疗后,可提高模型大鼠梗死边缘区smad7及其mRNA的表达,降低TGF-β1、smad3、smad4及其mRNA表达。
扶正化瘀胶囊或卡托普利抑制心肌纤维化的作用与其调控TGF-β1/smads信号通路,增强抑制纤维化的作用密切相关。但扶正化瘀胶囊是否以TGF-β1/smads信号通路作为抑制胶原产生的中间环节以及是否存在其他的靶基因尚待进一步研究。
参考文献:
[1] Bomb R,Heckle MR,Sun Y,et al.Myofibroblast secretome and its auto-/paracrine signaling[J].Expert Rev Cardiovasc Ther,2016,14(5):591-598.
[2] Akiyama-Uchida Y,Ashizawa N,Ohtsuru A,et al.Norepinephrine enhances fibrosis mediated by TGF-beta in cardiac fibroblasts[J].Hypertension,2002,40(2):148-154.
[3] Gabbiani G.The myofibroblast in wound healing and fibrocontractive diseases[J].J Pathol,2003,200(4):500-503.
[4] Eckes B,Zigrino P,Kessler D,et al.Fibroblast-matrix interactions in wound healing and fibrosis[J].Matrix Biol,2000,19(4):325-332.
[5] Hao J,Ju H,Zhao S,et al.Elevation of expression of Smads 2,3,and 4,decorin and TGF-beta in the chronic phase of myocardial infarct scar healing[J].J Mol Cell Cardiol,1999,31(3):667-678.
[6] Brooks WW,Conrad CH.Myocardial fibrosis in transforming growth factor beta(1)heterozygous mice[J].J Mol Cell Cardiol,2000,32(2):187-195.
[7] 吴爱明,翟建英,张冬梅,等.扶正化瘀胶囊对心肌梗死大鼠心肌纤维化的影响[J].现代生物医学进展,2013,13(14):2618-2621.
[8] 刘振,刘玲玲,杨廷桐.两种大鼠心肌梗死模型的比较研究[J].动物医学进展,2010,31(4):19-25.
[9] 徐淑云,卞如濂,陈修.药理实验方法学[M].北京:人民卫生出版社,2002:203.
[10] 周秘,尹立雪.心肌纤维化的超声心动图可视化观测研究进展[J].四川医学,2016,37(1):16-20.
[11] 郭应坤,李真林,郜发宝.心肌纤维化的分子影像学评价[J].中华核医学与分子影像杂志,2013,33(5):398-400.
[12] Leask A.Potential therapeutic targets for cardiac fibrosis TGFβ,angiotensin,endothelin,CCN2,and PDGF,partners in fibroblast activation[J].Circ Res,2010,106(11):1675-1680.
[13] Terrell TG,Working PK,Chow CP,et al.Pathology of recombinant human transforming growth factor-beta 1 in rats and rabbits[J].Int Rev Exp Pathol,1993,34(Pt B):43-67.
[14] Tandon A,Tovey JC,Sharma A,et al.Role of transforming growth factor Beta in corneal function,biology and pathology[J].Curr Mol Med,2010,10(6):565-578.
[15] Wang B,Omar A,Angelovska T,et al.Regulationu of collagen synthesis by inhibitory Smad7 in cardiac myofbroblasts[J].Am Physiol Heart Circ Physiol,2007,293(2):1282-1290.
