溶菌酶脂质体对冷藏金鲳鱼保鲜效果的影响
2018-06-19关荣发刘振峰肖朝耿张小军
王 者,关荣发,*,刘振峰,王 伟,肖朝耿,张小军,吕 飞
(1.中国计量大学生命科学学院,浙江 杭州 310018;2.正大青春宝药业有限公司健康产品所,浙江 杭州 310023;3.浙江省农业科学院农产品质量标准研究所,浙江 杭州 310016;4.浙江省农业科学院食品科学研究所,浙江 杭州 310022;5.浙江海洋大学海洋渔业研究所,浙江 舟山 316022;6.浙江工业大学海洋学院,食品工程与质量控制研究所,浙江 杭州 310014)
金鲳鱼,学名卵形鲳鯵,富含多种必需氨基酸、不饱和脂肪酸等营养成分[1]。水产品在运输过程中,微生物的作用以及自身的酶解反应使得产品的形态和色泽发生改变,并产生一些有害物质如组胺、三甲胺、硫化氢等,从而影响水产品的销售[2]。
溶菌酶是一种专门作用于微生物细胞壁的葡萄糖苷酶,又称胞壁质酶或N-乙酰胞壁质聚糖水解酶[3]。溶菌酶能够水解细菌细胞壁中的N-乙酰胞壁酸和N-乙酰葡萄糖胺之间的β-1,4糖苷键[4],破坏细菌细胞壁结构并导致内容物溢出,从而起到杀菌的作用。由于人和动物的细胞不具有细胞壁结构以及肽聚糖,因此溶菌酶对人体细胞无毒。溶菌酶作为一种全新的生物保鲜剂已经广泛应用于食品工业、畜牧业、医学等领域[5]。Hikima等[6]研究发现溶菌酶对鱼类病原菌有一定的抑制作用。蓝蔚青等[7]研究发现,带鱼经0.5 g/L的溶菌酶保鲜液浸渍后,其感官品质在第8天仍无显著变化,且其二级鲜度货架期较对照组延长了3~4 d。Takahashi等[8]研究发现,溶菌酶能够抑制冷藏过程中金枪鱼和三文鱼鱼籽中李斯特菌的生长。但目前已经实际应用且已实现商品化生产的是鸡蛋清溶菌酶,且存在抗菌谱窄(只对G+细菌起作用,对G-细菌作用不显著)、热稳定性不足以及脂溶性不足等缺点[9]。金鲳鱼等海产鱼味道鲜美,富含大量不饱和脂肪酸,而溶菌酶在应用中存在脂溶性较差的缺点,因此一定程度限制了溶菌酶功效的发挥。此外,生物体内消化系统相应的消化酶对溶菌酶的酶活力也存在一定的影响[10]。脂质体是1965年由英国科学家Bangham等[11]发现的,它是由两亲性物质磷脂和其他两性化合物如胆固醇等分散在水相中所形成的多层囊泡,每一层均为磷脂双分子层,囊泡内部为水相。脂质体作为一种可生物可降解的、无毒的、能够增强药物稳定性的脂溶性药物载体,近年来得到了较多的关注。蒲传奋等[12]研究发现百里酚经脂质体包埋后具有较好的抑菌和抗氧化能力。Liang Tisong等[13-14]研究发现氯化矢车菊素-3-葡萄糖苷经脂质体包埋后能够提升药物稳定性,增强抗氧化能力和抑制癌细胞的能力。
本实验通过逆向蒸发法制备溶菌酶脂质体,测定金鲳鱼经不同溶液浸渍后,其感官评价得分、pH值、菌落总数、硫代巴比妥酸(thiobarbituric acid,TBA)值、挥发性盐基氮(total volatile basic nitrogen,TVB-N)含量等鲜度指标,探讨不同质量浓度的溶菌酶和溶菌酶脂质体对金鲳鱼的保鲜效果。并通过模拟金鲳鱼体内消化环境,探究脂质体对溶菌酶的保护作用。
1 材料与方法
1.1 材料与试剂
金鲳鱼购于杭州下沙物美超市。选取大小均一的个体,1 h内带冰运回实验室。溶菌酶(鸡蛋白源,白色粉末,活力≥70 000 units/mg) 上海Aladdin公司,大豆卵磷脂(纯度98%)、胆固醇(纯度98%) 北京双旋微生物培养基制品厂;平板计数琼脂(纯度98%) 杭州百思生物技术有限公司。其他试剂均为分析纯。
1.2 仪器与设备
ZEN1690粒径仪 英国马尔文仪器有限公司;KQ2200DE超声清洗器 昆山市超声仪器有限公司;RV10型旋转蒸发仪 德国IKA公司;6HB-ⅢA循环水式多用真空泵 上海豫康科教仪器设备有限公司;DHG-9146A鼓风干燥箱 上海精宏实验设备有限公司、UV-1200紫外分光光度计 日本岛津公司;BJ-1CD超净工作台 上海博迅实业有限公司。
1.3 方法
1.3.1 溶菌酶脂质体的制备
参照Wu Zhipan等[15]的逆向蒸发法制备溶菌酶脂质体。准确称取48 mg卵磷脂和12 mg胆固醇,溶于6 mL氯仿和9 mL乙醚的混合溶剂中,加入质量浓度为2 mg/mL的溶菌酶磷酸盐缓冲液(pH 6.8),磁力搅拌40 min,超声处理15 min,形成稳定的乳液,静置10 min不分层。将装有W/O型乳液的茄型瓶置于旋转蒸发仪上,减压至0.08 MPa后,37 ℃下蒸发除去有机溶剂至瓶壁上形成一层均匀的淡黄色的膜。加入磷酸盐缓冲液,洗脱20 min,将膜洗下后再次超声15 min即可得到淡乳黄色脂质体混悬液。过滤除去大颗粒杂质后,置于4℃冰箱保存备用。
所得溶菌酶脂质体粒径为(245.6±5.2)nm,结构呈现较为规则的球形;同时溶菌酶脂质体包封率可达(75.36±3.20)%,多分散性指数为0.174,具备较好的承载能力和较为均匀的粒径分布[15]。
1.3.2 样品处理
将购买的新鲜金鲳鱼,去头、尾、内脏后用冰蒸馏水洗净,将躯干部位鱼肉分为约60 g的鱼块,备用。室温条件下将上述鱼块分别浸渍于灭菌磷酸盐缓冲液、一系列质量浓度梯度溶菌酶脂质体以及溶菌酶溶液中。根据GB 2760—2014《食品安全国家标准 食品添加剂使用标准》[16],将溶菌酶和溶菌酶质体的质量浓度梯度均设置为0.125、0.250、0.500 mg/mL。室温条件下浸渍1 h后将鱼块捞出,沥干后置于无菌PE保鲜袋,并将其放置于4 ℃冰箱保存。每隔2 d测定相关指标。
1.3.3 感官评定
参照SC/T 3103—2010《鲜、冻鲳鱼》[17]的感官要求并结合雷志方等[18]的评价方法对金鲳鱼感官进行评价,感官评定小组由20 名受过专业训练的人员组成,分别从金鲳鱼的色泽、气味、组织形态、弹性4 个方面进行打分,各项总分为10 分。各项指标打分标准见表1,感官综合得分=(色泽得分+气味得分+组织形态得分+弹性得分)/4。

表1 金鲳鱼感官得分评分标准Table 1 Criteria for sensory evaluation of Trachinotus ovatus
1.3.4 pH值的测定
参考谢晶等[19]对带鱼pH值的测定方法,稍作修改。称取 5 g 切碎的金鲳鱼肉于锥形瓶中,加入45 mL新煮沸后冷却的蒸馏水,搅拌均匀后静置30 min,过滤。用精密pH计直接测定滤液的pH值。
1.3.5 菌落总数的测定
参考GB 4789.2—2010《食品安全国家标准 食品微生物学检验 菌落总数测定》[20]的方法测定菌落总数。1.3.6 TBA值的测定
TBA值的测定参考Salih等[21]的方法,称取5 g备用金鲳鱼肉,加入25 mL、体积分数5%的三氯乙酸,再加入20 mL无菌水,均质后静置1 h,过滤。将滤液用双蒸水定容至50 mL。取5 mL该混合液,加入5 mL 0.02 mol/L TBA溶液。将混合液置于沸水浴中反应20 min,显色,取出后置于流动水下冲洗5 min,测定其在532 nm波长处的吸光度。以蒸馏水取代滤液为空白样。按式(1)计算TBA值。
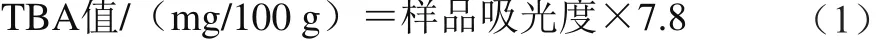
1.3.7 TVB-N含量的测定
TVB-N含量的测定参考GB 5009.228—2016《食品安全国家标准 食品中挥发性盐基氮的测定》[22]的方法。
1.3.8 溶菌酶脂质体脂溶性的测定
室温条件下,通过向菜籽色拉油中添加一定量的溶菌酶脂质体,磁力搅拌混合均匀后,充分静置,观察体系溶解情况。
1.3.9 模拟金鲳鱼消化道内环境实验
模拟金鲳鱼消化道内环境实验参照邢思华等[10]的方法略有改动。取金鲳鱼肝胰脏、肠道、胃,用pH 6.8的磷酸盐缓冲液漂洗后,吸干水分,备用。用pH 6.8的磷酸盐缓冲液分别将肝胰脏、肠道、胃匀浆后(1∶10,m/V),3 000 r/min离心5 min,取上清液,即粗酶液。将粗酶液稀释10 倍后分别与溶菌酶溶液和溶菌酶脂质体(溶菌酶质量浓度为0.5 mg/mL)37 ℃预热后按照体积比1∶9混合,再将其置于37 ℃条件下反应2 h后,置于冰水浴,终止反应,测定抑菌效果。
以单增李斯特菌为实验菌株,隔夜培养后,3 000 r/min离心分离菌株,弃上清液,再以磷酸盐缓冲液混匀菌体并调节OD570nm为0.4左右,加入上述反应后的溶菌酶和溶菌酶脂质体。通过反应前后OD值的减小情况,按照式(2)计算抑菌率。
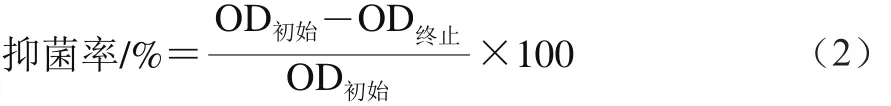
1.4 数据处理
每组实验重复3 次,每次至少3 个平行,利用Origin 9.0软件绘制曲线,用SPSS 19.0软件的LDS方法进行方差分析和多重比较。P<0.05表示差异显著。
2 结果与分析
2.1 不同处理对金鲳鱼贮藏过程中感官得分的影响
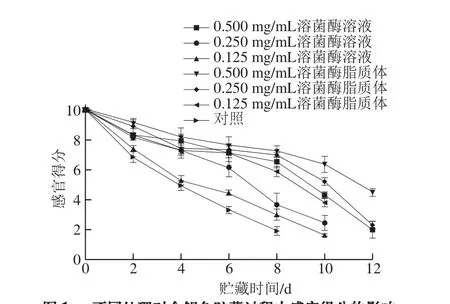
图1 不同处理对金鲳鱼贮藏过程中感官得分的影响Fig. 1 Effects of different treatments on sensory evaluation of Trachinotus ovatus during storage
如图1所示,金鲳鱼感官得分随着贮藏时间的延长而下降,贮藏时间仅为2 d时,对照组的感官得分已经显著低于溶菌酶脂质体处理组和溶菌酶溶液处理组(P<0.05)。贮藏至第4天,对照组感官得分为开始低于6 分,为4.959±0.343,此时鱼肉已经发生了严重的糜烂并且腥臭味明显;此时0.125 mg/mL溶菌酶溶液处理组鱼肉感官得分为5.292±0.316,也产生了较为严重糜烂以及腥臭味;0.125 mg/mL溶菌酶脂质体处理组鱼肉的感官得分为7.215±0.440,仍保持着较好的形态以及气味。当贮藏时间为8 d时,0.250 mg/mL溶菌酶溶液处理组的鱼肉感官得分明显低于6 分,为3.667±0.776,而此时0.250 mg/mL溶菌酶脂质体处理组的鱼肉感官得分为7.000±0.140,仍大于6 分。当贮藏时间为10 d时,0.500 mg/mL溶菌酶溶液处理组鱼肉感官得分开始小于6 分,为4.317±0.220,而此时0.500 mg/mL溶菌酶脂质体处理组的鱼肉感官得分仍大于6 分,为6.350±0.550。由此可知,溶菌酶脂质体和溶菌酶相比,能够有效减缓金鲳鱼肉的感官得分下降的速率。
2.2 不同处理对金鲳鱼贮藏过程中pH值的影响
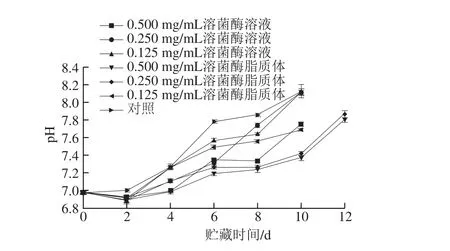
图2 不同处理对金鲳鱼贮藏过程中pH值的影响Fig. 2 Effects of different treatments on pH of Trachinotus ovatus during storage
由图2可知,6组样品的pH值基本呈现先下降后上升的“V”型趋势,与相关海产品的pH值变化规律保持一致[23]。新鲜鱼肉在贮藏初期pH值下降,是糖酵解产生的丙酮酸在无氧条件下由烟酰胺腺嘌呤二核苷酸还原为乳酸造成的,而随后细菌的繁殖以及肌肉中蛋白质的分解所产生的胺类等碱性物质可导致pH值上升[24]。
金鲳鱼肉的初始pH值为6.980±0.020,结合感官得分的实验结果,当贮藏时间为4 d时,对照组鱼肉已经发生了较为明显的糜烂与腥臭味,pH值为7.255±0.023,与0.125 mg/mL溶菌酶溶液和溶菌酶脂质体处理组无显著差异(P>0.05),显著高于0.250 mg/mL的溶菌酶溶液和0.500 mg/mL的溶菌酶脂质体处理组(P<0.05),但相同质量浓度的溶菌酶溶液和溶菌酶脂质体处理组之间相比,没有显著性差异(P>0.05)。当贮藏时间为6 d时,3组相同质量浓度的溶菌酶溶液处理组的pH值均显著高于溶菌酶脂质体处理组(P<0.05),由此可说明溶菌酶脂质体和溶菌酶相比,能够有效减缓金鲳鱼肉pH值的上升。
2.3 不同处理对金鲳鱼贮藏过程中TBA值的影响
金鲳鱼富含多种不饱和脂肪酸,TBA值可作为脂质被氧化程度的参考指标之一[25]。由图5可知,对照组鱼肉的TBA值在第2天就达到了(0.620±0.020)mg/100 g,而此时0.125 mg/mL溶菌酶溶液处理组和溶菌酶脂质体处理组分别为(0.541±0.035)mg/100 g和(0.498±0.022)mg/100 g,显著低于对照组(P<0.05)。当贮存时间为10 d时,0.250 mg/mL和0.500 mg/mL溶菌酶溶液处理组鱼肉的TBA值均已经超过1 mg/100 g,而此时0.250 mg/mL和0.500 mg/mL溶菌酶脂质体处理组鱼肉的TBA值分别为(0.785±0.038)mg/100 g和(0.712±0.026)mg/100 g。结果表明,溶菌酶脂质体在保鲜的前期和后期均能有效防止金鲳鱼肉中脂质的氧化。

图3 不同处理对金鲳鱼贮藏过程中TBA值的影响Fig. 3 Effects of different treatments on TBA values of Trachinotus ovatus during storage
2.4 不同处理对金鲳鱼贮藏过程中菌落总数的影响
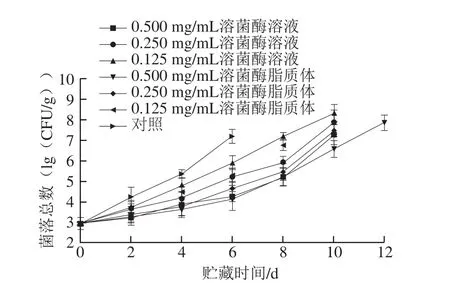
图4 不同处理对金鲳鱼贮藏过程中菌落总数的影响Fig. 4 Effects of different treatments on total bacterial count of Trachinotus ovatus during storage
由图4可知,金鲳鱼肉细菌总数呈上升趋势,初始菌落总数为(2.91±0.31)(lg(CFU/g))。这与金鲳鱼本身所携带的微生物以及实验环境和实验器材可能接触到的微生物有关。对照组鱼肉的菌落总数上升迅速,在第2天就已经达到了(4.22±0.48)(lg(CFU/g)),显著高于其他处理组(P<0.05)。当贮藏时间为8 d时,0.125 mg/mL溶菌酶溶液处理组鱼肉的菌落总数为(7.20±0.19)(lg(CFU/g)),而此时0.125 mg/mL溶菌酶脂质体处理组鱼肉的菌落总数为(6.78±0.29)(lg(CFU/g))。当贮藏时间为10 d时,0.250 mg/mL溶菌酶溶液处理组和溶菌酶脂质体处理组鱼肉的菌落总数均已超过了7(lg(CFU/g)),但前者(7.89±0.25)(lg(CFU/g))要高于后者(7.45±0.29)(lg(CFU/g));0.500 mg/mL溶菌酶溶液处理组鱼肉的菌落总数已经超过了7(lg(CFU/g)),为(7.27±0.49)(lg(CFU/g)),而0.500 mg/mL溶菌酶脂质体鱼肉的菌落总数为(6.58±0.41)(lg(CFU/g))。这与宋益娟等[26]的实验结果类似,说明溶菌酶脂质体的使用能够抑制贮藏后期菌落总数的升高。结果说明溶菌酶脂质体能够有效抑制金鲳鱼肉中微生物的繁殖,延长保鲜期。
2.5 不同处理对金鲳鱼贮藏过程中TVB-N含量的影响
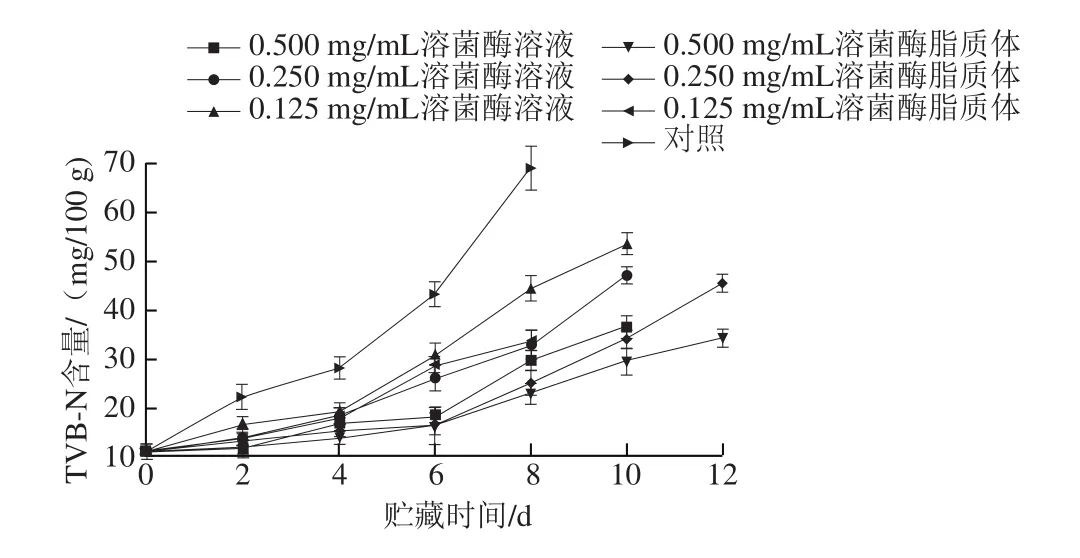
图5 贮藏过程中金鲳鱼TVB-N含量的变化情况Fig. 5 Effects of different treatments on TVB-N content of Trachinotus ovatus during storage
TVB-N含量作为一种保鲜评价指标被国内外许多学者所采用,TVB-N含量越高,说明肉类的腐败程度越高,尤其是对于蛋白质含量高的水产品而言。根据我国GB 2733—2015《食品安全国家标准 鲜、冻动物性水产品》,海水鱼虾中TVB-N含量不得超过30 mg/100 g[27]。由图5可知,溶菌酶脂质体处理组、溶菌酶溶液处理组、对照组货架期分别为6~10、6~8、4~5 d。随着贮藏时间的延长,对照组的鱼肉TVB-N含量上升速率明显快于其他处理组,在第4天时,就已经接近30 mg/100 g,而0.250 mg/mL溶菌酶脂质体处理组仅为(15.33±2.31)mg/100 g。到第8天时,0.125、0.250、0.500 mg/mL溶菌酶脂质体处理组的TVB-N含量分别为(33.8±2.2)、(25.2±2.4)、(23.2±2.2)mg/100 g;0.125、0.250、0.500 mg/mL溶菌酶溶液处理组分别为(44.6±2.6)、(32.8±3.1)、(29.8±1.9)mg/100 g,显著高于相同质量浓度溶菌酶脂质体处理组(P<0.05)。说明溶菌酶脂质体的使用同单一的溶菌酶的使用相比,更能够抑制金鲳鱼块TVB-N的产生。在贮藏时间为10 d时,0.500 mg/mL溶菌酶脂质体处理TVB-N含量仍低于30 mg/100 g,而0.500 mg/mL 溶菌酶处理组在第8天已不可食用,和溶菌酶溶液处理组以及对照组相比,溶菌酶脂质体处理可分别将货架期延长2~3 d 和5~6 d。
2.6 溶菌酶脂质体脂溶性情况
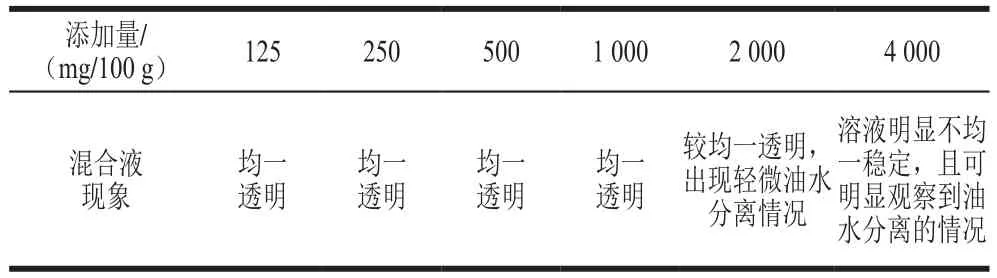
表2 溶菌酶脂质体脂溶性情况Table 2 Fat solubility of lysozyme liposomes
由表2可知,溶菌酶纳米脂质体在菜籽色拉油中的溶解度为1~2 g/100 g,体现了较好的脂溶性。
2.7 模拟金鲳鱼消化道内环境实验结果
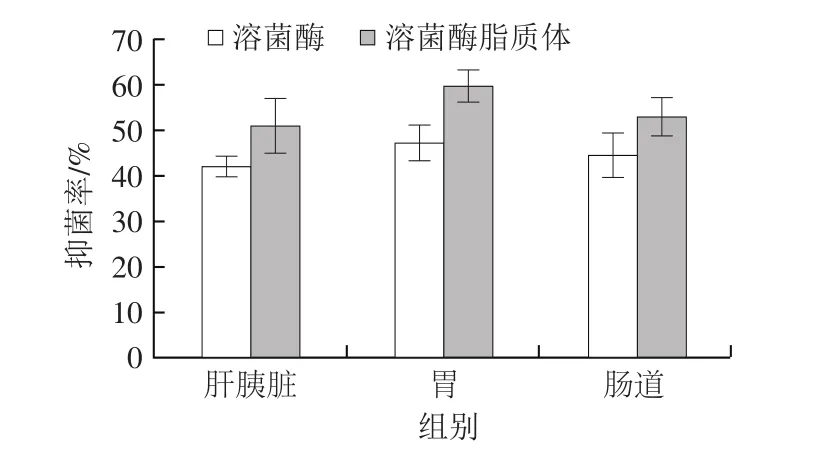
图6 消化酶对溶菌酶和溶菌酶脂质体酶活力的影响Fig. 6 Impact of digestive enzymes on activity of lysozyme and lysozyme liposomes
生物体内的消化系统含有各种各样丰富的酶,溶菌酶可能会被生物体内相应的消化酶所降解,从而影响其生物活性,而脂质体结构能够有效保护物质的活性[28]。由图6可知,从单一溶菌酶使用的结果可以看出,肝胰脏酶液对溶菌酶活性影响最大(抑菌率42.0%),肠道酶液影响次之(抑菌率44.6%),胃酶液对溶菌酶活性影响最小(抑菌率47.3%)。溶菌酶经脂质体包封后,其抑菌能力得到了显著的提升,说明脂质体能够较好地保护溶菌酶免遭相应消化酶的降解。
3 讨 论
金鲳鱼块经溶菌酶脂质体处理后,和对照组以及溶菌酶溶液处理组相比,分别能将货架期延长5~6 d和2~3 d。溶菌酶脂质体处理能明显抑制金鲳鱼块TBA值的上升,抑制微生物的生长,提升感官品质,并减缓pH值、TVB-N含量的升高,延长金鲳鱼的保鲜期。
脂质体是一种极具开发潜力的载体系统,其粒径接近纳米级范围;因此具有较强的穿透生理组织屏障的能力,并且包封物质经过纳米化后,能够增加所包封物质与细胞接触的面积,从而达到更好的使用效果。此外,脂质体结构适合体内降解,且无毒性和免疫原性[29],而且天然卵磷脂脂质体本身还具有清除血管胆固醇、软化血管、提升免疫力等保健功能。将溶菌酶包封于脂质体内使其接近纳米级后,一方面使其具有一定纳米化物质的特性,还一定程度上弥补了溶菌酶脂溶性差且能被生物体内相应消化酶所降解[10,27]的缺点;因此溶菌酶可通过脂质体所具备的亲脂性基团渗透至生物膜内部[30],一定程度上能够提升杀菌效果。此外脂质体具有明显的缓释效应,可较长时间地发挥抑菌作用[31-32]。溶菌酶作为一种天然安全的生物防腐剂,目前已经广泛应用于水产品的防腐贮运过程中,目前采用较多的是复合保鲜法,既将溶菌酶与海藻糖、茶多酚、Nisin等保鲜剂按照一定比例混合使用[9],从而达到更好的保鲜效果。而将溶菌酶与别的技术结合并应用于水产品保鲜的研究较少。本研究将溶菌酶包封于脂质体,增强溶菌酶脂溶性以及耐受水产品消化系统的能力,为溶菌酶进一步的扩大应用提供了一定的理论依据。但本研究中脂质体的粒径还未达到纳米级别(100 nm),今后还将就减小脂质体粒径、增强脂质体稳定性以及提升包封率做进一步的深入研究。
[1] 戴梓茹, 钟秋平, 林美芳, 等. 金鲳鱼营养成分分析与评价[J]. 食品工业科技, 2013, 34(1): 347-350. DOI:10.13386/j.issn1002-0306.2013.01.014.
[2] CAKLI S, KILINC B, CADUN A, et al. Effects of gutting and ungutting on microbiological, chemical, and sensory properties of aquacultured sea bream (Sparus aurata) and sea bass (Dicentrarchus labrax) stored in ice[J]. Critical Reviews in Food Science and Nutrition, 2006, 46(7): 519-527. DOI:10.1080/10408390500343209.
[3] MINE Y, MA F, LAURIAU S. Antimicrobial peptides released by enzymatic hydrolysis of hen egg white lysozyme[J]. Journal of Agricultural and Food Chemistry, 2004, 52(5): 1088-1094.DOI:10.1021/jf0345752.
[4] JOLLÈS P. Lysozymes: a chapter of molecular biology[J]. Angewandte Chemie International Edition, 1969, 8(4): 227-239. DOI:10.1002/anie.196902271.
[5] 任西营, 胡亚芹, 胡庆兰, 等. 溶菌酶在水产品防腐保鲜中的应用[J].食品工业科技, 2013, 34(8): 390-394; 399. DOI:10.13386/j.issn1002-0306.2013.08.084.
[6] HIKIMA S, HIKIMA J, ROJTINNAKORN J, et al. Characterization and function of kuruma shrimp lysozyme possessing lytic activity against Vibrio specices[J]. Gene, 2003, 316: 187-195. DOI:10.1016/S0378-1119(03)00761-3.
[7] 蓝蔚青, 谢晶. 酸性电解水与溶菌酶对冷藏带鱼品质变化的影响[J]. 福建农林大学学报(自然科学版), 2013, 42(1): 100-105.DOI:10.13323/j.cnki.j.fafu(nat.sci.).2013.01.021.
[8] TAKAHASHI H, KURAMOTO S, MIYA S, et al. Use of commercially available antimicrobial compounds for prevention of Listeria monocytogenes growth in ready-to-eat minced tuna and salmonroe during shelf-life[J]. Journal of Food Protection, 2011, 74(6): 994-998.DOI:10.4315/0362-028X.JFP-10-406.
[9] 冯棋琴, 周立梅, 高文功, 等. 溶菌酶在食品工业中的研究进展[J]. 食品研究与开发, 2015, 36(5): 134-136. DOI:10.3969/j.issn.1005-6521.2015.05.032.
[10] 邢思华, 华雪铭, 朱站英, 等. 渔用溶菌酶制品的稳定性研究[J]. 饲料工业, 2014, 35(22): 20-23. DOI:10.13302/j.cnki.fi.2014.22.005.
[11] BANGHAM A D, STANDISH M M, WATKINS J C. Diffusion of univalent ions across the lamellae of swollen phospholipids[J]. Journal of Molecular Biology, 1965, 13(1): 238-252. DOI:10.1016/ S0022-2836(65)80093-6.
[12] 蒲传奋, 王海姑, 姜春伟, 等. 百里香酚脂质体的制备及其性能的研究[J]. 中国食品添加剂, 2017(1): 141-145. DOI:10.3969/j.issn.1006-2513.2017.01.015.
[13] LIANG Tisong, GUAN Rongfa, SHEN Haitao, et al. Optimization of conditions for cyanidin-3-O-glucoside (C3G) nanoliposome production by response surface methodology and cellular uptake studies in Caco-2 cells[J]. Molecules, 2017, 22(3): 457. DOI:10.3390/molecules22030457.
[14] LIANG Tisong, GUAN Rongfa, WANG Zhe, et al. Comparison of anticancer activity and antioxidant activity between cyanidin-3-O-glucoside liposomes and cyanidin-3-O-glucoside in Caco-2 cells in vitro[J]. RSC Advances, 2017, 7(59): 37359-37368. DOI:10.1039/c7ra06387c.
[15] WU Zhipan, GUAN Rongfa, LÜ Fei, et al. Optimization of preparation conditions for lysozyme nanoliposomes using response surface methodology and evaluation of their stability[J]. Molecules, 2016,21(6): 741-753. DOI:10.3390/molecules21060741.
[16] 国家卫生和计划生育委员会. 食品安全国家标准 食品添加剂使用标准: GB 2760—2014[S]. 北京: 中国标准出版社, 2014: 70.
[17] 农业部. 鲜、冻鲳鱼: SC/T 3103—2010[S]. 北京: 中国标准出版社,2014: 4.
[18] 雷志方, 谢晶, 高磊, 等. 不同冷藏温度条件下金枪鱼保鲜效果的分析比较[J]. 食品工业科技, 2015, 36(19): 312-317. DOI:10.13386/j.issn1002-0306.2015.19.055.
[19] 谢晶, 杨胜平. 生物保鲜剂结合气调包装对带鱼冷藏货架期的影响[J]. 农业工程学报, 2011, 27(1): 376-382. DOI:10.3969/j.issn.1002-6819.2011.01.061.
[20] 卫生部. GB 4789.2—2010: 食品安全国家标准 食品微生物学检验.菌落总数测定[S]. 北京: 中国标准出版社, 2010: 3-6.
[21] SALIH A M, SMITH D M, PRICE J F, et al. Modified extraction 2-thiobarbituric acid method for measuring lipid oxidation in poultry[J]. Poultry Science, 1987, 66(9): 1483-1488. DOI:10.3382/ps.0661483.
[22] 国家卫生和计划生育委员. 会食品安全国家标准 食品中挥发性盐基氮的测定: GB 5009.228—2016[S]. 北京: 中国标准出版社, 2017: 7-9.
[23] SENA C, BELLO R A. Preparation of a spread from shrimp by-catch fish[J]. Archivos Latinoamericanos de Nutricion, 1988, 38(4): 865-882.
[24] MASNIYOM P, BENJAKUL S, VISESSANGUAN W. Shelf-life extension of refrigerated seabass slices under modified atmosphere packaging[J]. Journal of the Science of Food and Agriculture, 2002,82(8): 873-880. DOI:10.1002/jsfa.1108.
[25] 范文教, 孙俊秀, 陈云川, 等. 茶多酚对鲢鱼微冻冷藏保鲜的影响[J].农业工程学报, 2009, 25(2): 294-297.
[26] 宋益娟, 蒋晗, 关荣发, 等. 儿茶素纳米脂质体对酱鸭贮藏品质的影响[J]. 中国食品学报, 2013, 13(10): 109-114. DOI:10.16429/j.1009-7848.2013.10.028.
[27] 国家卫生和计划生育委员会. 食品安全国家标准 鲜、冻动物性水产品: GB 2733—2015[S]. 北京: 中国标准出版社, 2016: 3.
[28] HUANG W J, LI X, XUE Y, et al. Antibacterial multilayer films fabricated by LBL immobilizing lysozyme and HTCC on nanofibrous mats[J]. International Journal of Biological Macromolecules, 2013, 53:26-31. DOI:10.1016/j.ijbiomac.2012.10.024.
[29] LIU W L, YE A Q, LIU W, et al. Stability during in vitro digestion of lactoferrin-loaded liposomes prepared from milk fat globule membrane-derived phospholipids[J]. Journal of Dairy Science, 2013,96(4): 2061. DOI:10.3168/jds.2012-6072.
[30] DUBEY V, MISHRA D, JAIN N K. Melatonin loaded ethanolic liposomes: physicochemical characterization and enhanced transdermal delivery[J]. European Journal of Pharmaceutics and Biopharmaceutics,2007, 67(2): 398-405. DOI:10.1016/j.ejpb.2007.03.007.
[31] 蒲传奋, 唐文婷. 抗菌肽G-K脂质体的制备工艺优化及其抑菌性质[J].食品科学, 2017, 38(6): 229-235. DOI:10.7506/spkx1002-6630-201706036.
[32] 蒲传奋, 唐文婷. 鳀鱼抗菌肽脂质体的制备与抗单增李斯特菌生物被膜活性研究[J]. 现代食品科技, 2017, 33(1): 54-61. DOI:10.13982/j.mfst.1673-9078.2017.1.009.
