魔芋粉对急性酒精中毒小鼠脑损伤的保护作用
2018-06-19帅天罡
帅天罡,王 敏,钟 耕*
(西南大学食品科学学院,重庆 400715)
随着社会的进步和经济水平的快速发展,我国人民的生活水平得到了显著改善,对于酒精消费的需求越来越多,嗜酒人群比例也随之上升,据统计已超过5亿 人[1]。大量饮酒会造成中毒,并对肝脏、心脏、胰腺和神经系统等造成损伤[2]。目前,国内外对急慢性酒精中毒对肝脏的损害及其可能的发生机制都进行了大量的报道[3-4],并且研制出了众多有效保护肝脏的解酒制品[5];但酒精对脑带来的损伤和对脑起到保护作用的解酒制品却研究较少,由于酒精引起的脑疾病发生率持续增高,酒精对脑的毒性作用日益受到人们的关注。因此,找到一种有效的对酒后脑损伤起到保护作用的解酒制品同样应得到社会的重视。
急性酒精中毒条件下,乙醇在10 min内就可迅速通过血脑屏障到达脑组织。当乙醇诱导脑中产生的活性氧超过脑组织自身清除能力时,就会引发氧化应激,导致细胞蛋白质、脂质和DNA的氧化损伤,但抗氧化物酶如超氧化物歧化酶(superoxide dismutase,SOD)、过氧化氢酶和谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)作为自由基的清除剂,能够降低脑组织的氧化损伤[6]。同时,急性酒精中毒条件下血脑屏障通透性增加,引起中枢神经系统呈现先兴奋后抑制的状态,激发垂体前叶释放β-内啡肽(β-endorplhin,β-EP)[7]。并且,乙醇经乙醇脱氢酶(alcohol dehydrogenase,ADH)代谢产生的乙醛(acetaldehyde,AcH)可与脑中多巴胺(dopamine,DA)结合形成阿片肽类物质,能够作用于阿片肽受体[8],也有学者研究指出,AcH的产生与酒后宿醉效应有关[9]。
魔芋,作为普通食材,是我国西南地区主要特色经济作物之一[10]。魔芋中的主要成分为魔芋葡甘聚糖(konjac glucomannan,KGM)。作为一种优质的可溶性膳食纤维和具有药疗价值的原料[11],KGM具有降低餐后血糖[12]、血脂[13]、调节肠道菌群[14]、润肠通便[15]等保健功能,越来越多地受到人们的关注,其中部分研究人员对它的解酒功能做了实验性研究,梁娜等[16]通过解酒、防醉、攀附及检测小鼠全血乙醇含量等实验,认为KGM可显著延长小鼠对酒精的耐受时间,缩短醉酒时间。郑连姬等[17]发现KGM可使小鼠胃黏膜和血清中丙二醛(malondialdehyde,MDA)含量降低,并通过使SOD活力、一氧化氮(nitric oxide,NO)和前列腺素E含量的升高来减轻酒精对胃黏膜的损伤并提高肝脏中ADH、乙醛脱氢酶、细胞色素P450含量,通过ADH和乙醇氧化酶系统加速酒精代谢发挥防醉解酒作用。目前对魔芋解酒功效的研究还不完善,仅仅是从缩短醉酒时间、降低血醇浓度以及保护肝损伤方面进行研究[18],但魔芋粉对急性酒精中毒导致的脑损伤影响的研究鲜见报道。
本研究通过动物实验,给小鼠进行酒精灌胃建立小鼠急性酒精中毒模型,旨在探究给予魔芋粉对小鼠脑组织中SOD的活力及MDA、谷胱甘肽(glutathione,GSH)、NO含量的影响,并观察酒后脑组织病理切片,从抗氧化损伤的角度探究魔芋粉对急性酒精中毒小鼠脑组织的保护作用。另一方面,测定魔芋粉对急性酒精中毒小鼠脑中单胺类神经递质DA、5-羟基色胺(5-hydroxytryptamine,5-HT)和阿片肽类物质β-EP以及乙醇代谢产物AcH的影响,探究魔芋粉能否通过调节脑组织神经递质的释放以及降低AcH的含量来减轻急性酒精中毒小鼠脑组织中枢神经系统损伤。
1 材料与方法
1.1 动物、材料与试剂
昆明种小鼠,雄性,体质量(20±2)g,由重庆中药研究院提供,实验动物质量合格证号:SCXK-(军)2012-0011。
魔芋粉(160~200 目),食品级,由重庆康家客食品有限公司提供,经严格研磨过筛,质量满足NY/T 494—2010《魔芋粉》要求,葡甘聚糖含量达93%。
乙醇体积分数56%二锅头酒(食品级) 北京红星股份有限公司;氯化钠、无水乙醇、甲醇、乙腈(均为分析纯) 成都市科龙化工试剂厂;SOD试剂盒、MDA试剂盒、NO试剂盒、还原型GSH试剂盒、考马斯亮蓝蛋白测定试剂盒 南京建成生物工程研究所;AcH-二硝基苯腙(2,4-dinitrophenylhydrazine,DNPH)标准品、DNPH高纯试剂 天津一方科技有限公司;β-EP、DA、5-HT酶联免疫吸附测定试剂盒 上海酶远生物科技有限公司。
1.2 仪器与设备
HH-6数显恒温水浴锅 金坛市富华仪器有限公司;721可见分光光度计 上海菁华仪器有限公司;5810型台式高速离心机 德国Eppendorf公司;JTI0001电子天平 上海精天电子仪器有限公司;100~1 000 µL型移液枪 广州市典锐化玻试验仪器公司;HIMG酶标仪 基因有限公司;A1130440数码显微镜 德国Leica公司;H550L高分辨率数码照相机 日本尼康公司;F6/10匀浆机 德国弗鲁克公司;LC-20高效液相色谱仪日本岛津公司。
1.3 方法
1.3.1 动物实验
1.3.1.1 实验动物分组及处理
将70 只昆明小鼠适应性饲养1 周后随机分为5 组,即正常对照组(空白组)、模型组和KGM低、中、高剂量组,每组14 只。在正式实验前将每组小鼠进行染色标记、称质量并记录。自第2周起,每天早上9点,对KGM低、中、高剂量组小鼠分别以魔芋粉人体推荐摄入量的5、10、15 倍[19],按166、332、500 mg/kg的剂量进行灌胃,连续灌胃10 d,空白组和模型组灌胃相同剂量的生理盐水。
1.3.1.2 急性酒精中毒小鼠模型的建立
第10天各组灌胃完成后禁食不禁水12 h,于第11天对KGM低、中、高剂量组小鼠按照上述KGM剂量进行灌胃,模型组和空白组灌胃同剂量生理盐水,30 min后模型组和KGM组小鼠均以14 mL/kg的剂量灌入乙醇体积分数56%二锅头白酒[20]。
1.3.1.3 小鼠血清提取
小鼠灌入酒后1 h进行摘眼球取血,将血置于1.5 mL离心管中,室温下放置2 h,4 000 r/min离心15 min后将上清液分离出来,保存至4 ℃冰箱内,待用。
1.3.1.4 脑组织匀浆的提取与制备
在各组小鼠中随机抽取4 只小鼠,脱臼法处死小鼠后用剪刀沿小鼠头颅中心缓慢剪开,用镊子迅速取出小鼠脑组织放入体积分数4%甲醛溶液中固定,待进行脑组织形态学检测;其余各组小鼠脱臼处死后迅速取脑组织,用0.86%(质量分数,下同)的生理盐水冲洗干净,滤纸吸干水分,放到锡箔纸上称质量,记录。将称质量后的脑组织放入10 mL的小烧杯中,用移液管取0.86%冰生理盐水,总量为脑组织质量的9 倍。将其总量的2/3移入小烧杯中,小烧杯置于冰上,用眼科小剪将脑组织在冰浴条件下快速剪碎。使用匀浆机将组织充分研碎,使其匀浆化。将匀浆完成的组织液倒入离心管中,再将剩余的1/3冰生理盐水冲洗烧杯,将冲洗液一并倒入离心管中,整个过程在冰上进行。将制备好的10%组织匀浆经3 000 r/min离心15 min,取上清液于4 ℃贮存备用[21]。
1.3.2 组织切片观察
从固定液中取出脑组织,梯度乙醇脱水,二甲苯/无水乙醇(1∶1,V/V)浸泡至组织块透明,制作石蜡切片,苏木精-伊红染色,中性树胶封片,显微镜观察。
1.3.3 AcH质量浓度的测定
1.3.3.1 标准溶液的配制
精确配制1 000 mg/L的AcH-DNPH标准储备液,用移液枪从标准储备液中分别移取500、300、100、50、20 μL于10 mL容量瓶中,用乙腈分别稀释定容至刻度,振荡摇匀,即得质量浓度梯度为50.0、30.0、10.0、5.0、2.0 mg/L的标准溶液。
1.3.3.2 DNPH衍生试剂储备液配制
准确称取DNPH高纯试剂39.63 mg于100 mL棕色容量瓶中,用乙腈定容至100 mL,振荡摇匀,即得质量浓度为2 mmol/L的DNPH-乙腈溶液。
1.3.3.3 样品测定
色谱条件:ODS-C18分离柱(150 mm×4.6 mm,5 μm);流动相:甲醇-水(60∶40,V/V);流速:1.0 mL/min;进样量:20 μL;检测波长:360 nm。
分别取血清、脑组织匀浆样品200 μL,加入100 μL 2 mmol DNPH-乙腈溶液,振荡混匀后在60 ℃水浴中衍生15 min,流水冷却,以3 000 r/min离心15 min,取上清液过0.22 μm微孔滤膜至棕色液相进样瓶中,进样量为20 μL[22-23]。
1.3.4 其他生化指标的测定
脑组织匀浆的SOD活力,MDA、GSH、NO含量和β-EP、DA、5-HT质量浓度的测定均按照试剂盒说明书的方法进行。
1.4 数据处理
2 结果与分析
2.1 小鼠脑组织病理学观察

图1 KGM对各实验组小鼠脑组织病理的影响(200×)Fig. 1 Effect of KGM on pathological changes of brain tissue in mice (200 ×)
如图1所示,空白组小鼠脑海马区锥体细胞数目多,细胞间排列紧密,细胞核大,染色浅,细胞质丰富;与空白组相比,模型组小鼠脑海马区锥体细胞排列不规则,细胞间呈松散状态,层次混乱,且锥体细胞数目大幅减少,部分位置呈现缺失状态,部分细胞出现变性、萎缩,证明急性酒精中毒所导致的脑损伤造模成功[24];与模型组相比,KGM组小鼠脑海马区损伤较轻,其中KGM高剂量组锥体细胞与空白组相比差异较小,KGM中剂量组部分区域锥体细胞数目减少,出现排列松散的情况,但基本排列紧密;KGM低剂量组锥体细胞数目减少,排列较松散。所以KGM对急性酒精中毒脑组织具有保护作用,且中、高剂量组效果优于低剂量组。
2.2 KGM对AcH质量浓度的影响
急性酒精中毒情况下,进入体内的乙醇会随着血液循环到达脑组织中,若乙醇不能够及时地分解,则其代谢产物AcH会在脑中聚集,造成酒后头晕、呕吐,严重者会引起第2天的宿醉[25]。除此之外,AcH还能够与体内DA结合生成内源性吗啡类衍生物,抑制呼吸、血管运动中枢,使脑血管急剧扩张,引起颅内压迅速升高[26]。

表1 KGM对急性酒精中毒小鼠血、脑中AcH质量浓度的影响Table 1 Effect of KGM on AcH contents in blood and brain of mice with acute alcoholism mg/mL
由表1可知,与模型组相比,KGM低、中、高剂量组小鼠血、脑中AcH质量浓度呈下降趋势。与模型组相比:KGM低、中、高剂量组血中AcH质量浓度降低且有显著性差异(P<0.05);KGM低、中剂量组脑中AcH质量浓度降低但差异不显著,KGM高剂量组脑中AcH质量浓度显著降低(P<0.05)。说明KGM能够降低脑中AcH质量浓度,减轻AcH对脑组织损伤,改善醉酒后所引起的宿醉症状。
2.3 KGM对SOD活力及MDA含量的影响
据报道,酒精中毒所造成的脑损伤与自由基有关[27],脑组织中SOD活力的高低可间接表明脑部清除氧自由基的能力,MDA含量可以间接表明体内自由基对脑的损伤程度。从图2中可以看出:与空白组相比,模型组小鼠脑组织中SOD活力明显降低且有显著性差异(P<0.05);与模型组相比,KGM低、中、高剂量组脑组织中SOD活力呈现上升趋势,其中KGM高剂量组与模型组差异显著(P<0.05)。由图3可知,与空白组相比,模型组小鼠脑组织中MDA含量显著升高(P<0.05),与模型组相比,KGM低、中、高剂量组小鼠脑组织中MDA含量呈下降趋势,且KGM中、高剂量组与模型组有显著性差异(P<0.05),说明KGM可以提高脑中SOD活力和降低MDA含量,且高剂量组效果要优于低、中剂量组。郑连姬等[17]的研究表明,KGM可能通过降低小鼠血清中MDA含量和提高SOD活力来预防小鼠胃黏膜损伤,结合本研究结果可以推断出KGM在脑中也有类似功能,一定程度上抑制了乙醇在短时间内进入脑组织后所造成的氧化应激损伤,对脑具有保护作用。

图2 KGM对急性酒精脑损伤各实验组小鼠脑中SOD活力的影响Fig. 2 Effect of KGM on SOD activity in brain of mice with acute alcohol-induced injury
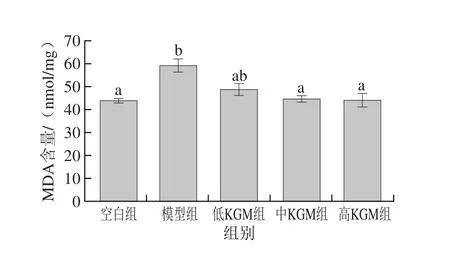
图3 KGM对急性酒精脑损伤各实验组小鼠脑中MDA含量的影响Fig. 3 Effect of KGM on MDA level in brain tissues of mice with acute alcohol-induced injury
2.4 KGM对GSH含量的影响
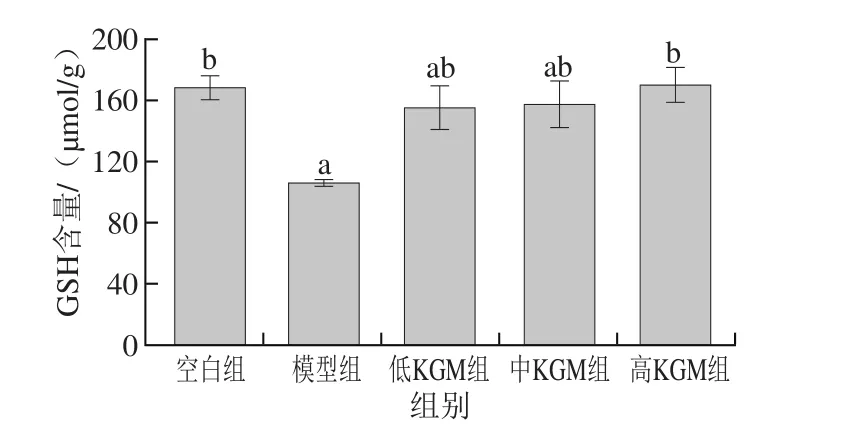
图4 KGM对急性酒精脑损伤各实验组小鼠脑中GSH含量的影响Fig. 4 Effect of KGM on GSH contents in brain tissues from mice with acute alcohol-induced injury
由图4可知,与空白组相比,模型组小鼠脑组织中GSH含量明显降低且有显著性差异(P<0.05);与模型组相比,KGM低、中、高剂量组脑组织中GSH含量呈上升趋势,其中KGM低、中剂量组GSH含量虽有降低但差异不显著,KGM高剂量组GSH含量显著降低(P<0.05)。依据杨芳等[28]的研究,乙醇在体内代谢过程中,产生了过多的氧应激产物,这些物质可激活磷脂酶及脂质过氧化反应,抑制SOD、GSH-Px的活力,消耗自由基清除剂GSH,KGM可以提高SOD、GSH-Px的活力来减少GSH的消耗。因此可以证明KGM能作为抗氧化剂切断过氧化链式反应,抑制自由基对脑组织造成的损伤,使脑内GSH的消耗减少,对酒精所引起的氧化应激有明显缓解作用。
2.5 KGM对NO含量的影响
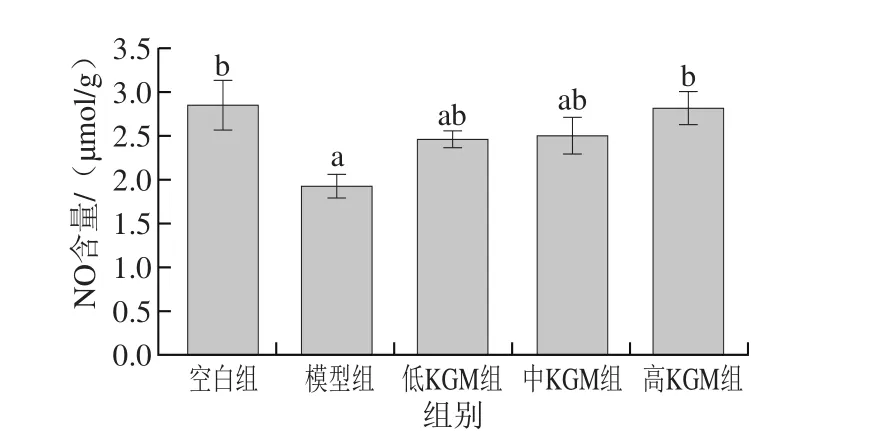
图5 KGM对急性酒精脑损伤各实验组小鼠脑中NO含量的影响Fig. 5 Effect of KGM on NO contents in brain tissues of mice with acute alcohol-induced injury
如图5所示,模型组小鼠脑组织中NO含量与空白组相比明显降低且有显著性差异(P<0.05);与模型组相比,KGM低、中剂量组NO含量虽有上升趋势但差异不显著;KGM高剂量组与模型组相比脑组织中NO含量显著升高(P<0.05)。虽然过量的NO可能会加重脑损伤[29],但在正常范围内NO可以对抗酒精的神经毒性[30],KGM可能在正常范围内通过升高NO的含量来阻断谷氨酸的N-甲基-D-天冬氨酸受体过度兴奋及调节其他神经递质的释放,减少神经元胞浆内游离Ca2+水平[31],从而起到对神经的保护作用。
2.6 KGM对β-EP质量浓度的影响
早期文献指出,机体处于应激状态下如急性酒精中毒时,β-EP分泌明显增加[32]。β-EP质量浓度上升对中枢神经有直接的抑制作用,能加深酒精中毒时的昏迷;同时,β-EP会通过抑制前列腺素生成和腺苷酸环化酶,引起脑组织缺血性损伤,抑制ATP代谢作用,促进氧自由基生成,导致脑组织细胞损伤[33]。如图6所示,模型组小鼠在急性酒精中毒状态下脑组织中β-EP质量浓度明显上升,且与空白组相比有显著性差异(P<0.05);而经KGM灌胃后的各组小鼠脑组织中β-EP质量浓度与模型组相比均显著降低(P<0.05),说明KGM可以有效减少大量饮酒后机体处于应激状态下时储存在垂体中的β-EP的释放,降低脑中β-EP的质量浓度,从而减轻阿片肽类物质对脑的损伤作用。
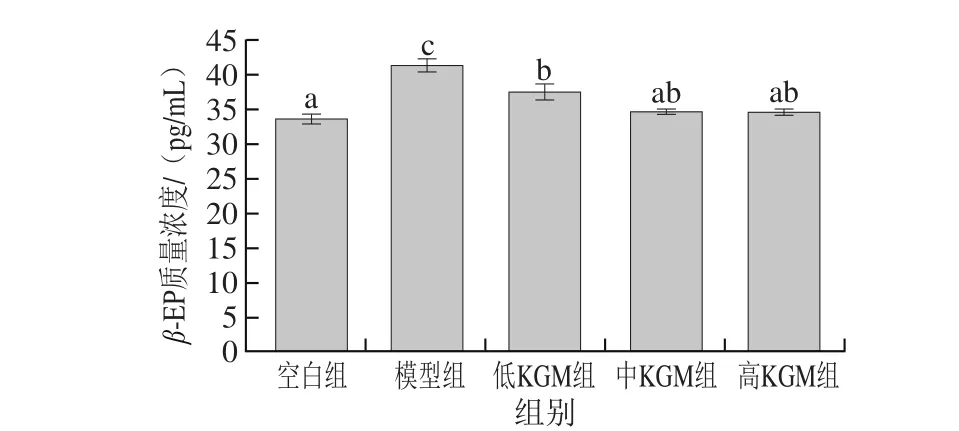
图6 KGM对急性酒精脑损伤各实验组小鼠脑中β-EP质量浓度的影响Fig. 6 Effect of KGM on β-EP contents in brain tissues of mice with acute alcohol-induced injury
2.7 KGM对DA质量浓度的影响
DA存在于中枢神经系统中,在中枢神经系统神经递质中扮演着重要角色,它可以影响激素分泌、自主运动及情绪控制等行为或生理调控机制[34],并且可以与AcH缩合而成的阿片肽类物质直接作用于阿片受体,使运动中枢和呼吸中枢受到抑制。目前已有大量文献研究指出酒精依赖和戒断也与脑内DA及其受体有重要关联[35]。
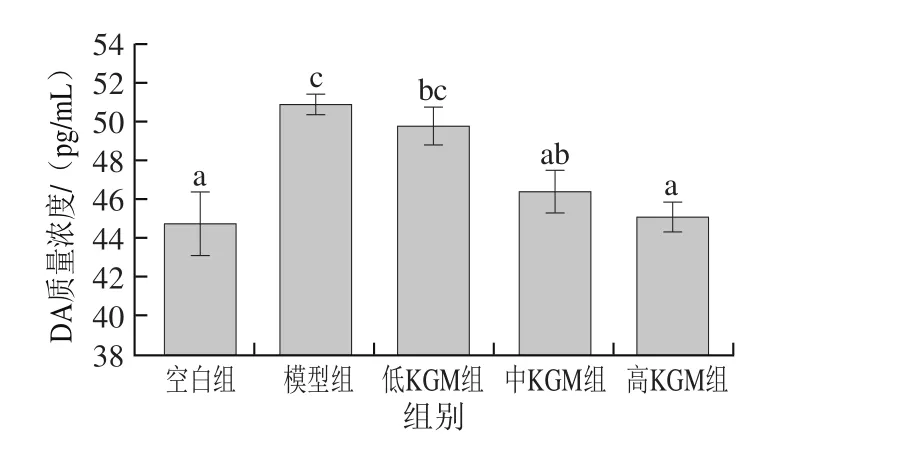
图7 KGM对急性酒精脑损伤各实验组小鼠脑中DA质量浓度的影响Fig. 7 Effect of KGM on DA content in brain tissues of mice with acute alcohol-induced injury
根据项翠琴等[36]的研究,一次性乙醇灌胃会使体内DA质量浓度显著增加,且与灌胃乙醇剂量呈量效关系。由图7可知,小鼠在经过灌胃1 h后,模型组DA质量浓度升高最明显,与空白组相比有显著性差异(P<0.05),本研究与项翠琴等[36]的结果一致。与模型组相比,KGM中、高剂量组均可显著降低DA质量浓度(P<0.05);KGM低剂量组较模型组DA质量浓度虽有所降低,但差异不显著。乙醇是亲神经兴奋性毒物,可通过DA转运蛋白进入神经元,会导致脑内DA的区域神经元兴奋性增强,DA的释放量增加,分解量减少[37],并且当血脑屏障被破坏时,外周血中的DA会大量进入脑内,所以DA质量浓度能侧面反映出乙醇对神经系统的影响及脑损伤的程度。脑组织中过多的DA等单胺类神经递质会导致神经元兴奋过度,能量消耗增加,使维持脑细胞代谢的酶活性降低。而中、高剂量组的KGM能有效降低脑内DA质量浓度,说明KGM能减轻酒精对神经系统的损伤作用。
2.8 KGM对5-HT质量浓度的影响
5-HT属于抑制性神经递质,与机体睡眠、情绪及精神状态的维持有关[38]。乙醇代谢产物AcH可抑制醛脱氢酶的活力,进而影响5-HT在在中枢神经系统中的代谢降解,导致5-HT质量浓度升高,这是乙醇中毒后促进睡眠的原因[39]。

图8 KGM对急性酒精脑损伤各实验组小鼠脑中5-HT质量浓度的影响Fig. 8 Effect of KGM on 5-HT content in brain of mice with acute alcohol-induced injury
如图8所示,与空白组相比,模型组小鼠脑组织5-HT质量浓度显著升高(P<0.05),因脑损伤后脑干5-HT受损害性刺激导致其释放量增加,且脑损伤时神经元Ca2+通道的开放使钙调素活力增高,5-HT合成量增加[40];与模型组相比,KGM低、中、高剂量组小鼠脑中5-HT质量浓度呈下降趋势,KGM低剂量组5-HT质量浓度虽降低但无显著性差异,KGM中、高剂量组显著降低(P<0.05)。据柯以铨等[40]的报道,5-HT对脑的继发性损害是与其相应的受体结合,引起脑血管舒缩功能紊乱及内皮细胞强烈收缩,使内皮细胞间的紧密连接开放,增加血脑屏障的通透性,加剧血管源性脑水肿的发生与发展。因此可以推断出KGM能减轻酒精对脑的损害作用,且能减少5-HT质量浓度,以此来降低其对脑的继发性损害,对脑具有重要的保护作用。
3 结 论
本研究一方面探究KGM对急性酒精中毒小鼠脑损伤的抗氧化保护作用,主要包括脑组织匀浆中SOD活力、MDA、NO、GSH含量的测定以及脑组织海马区病理切片的观察。另一方面探究KGM对急性酒精中毒小鼠脑中AcH及神经递质的调节作用,包括小鼠脑组织匀浆、血清中AcH质量浓度,以及单胺类神经递质DA、5-HT和阿片肽类物质β-EP的影响。结果显示:与模型组相比,KGM高剂量组脑组织匀浆中SOD活力及GSH、NO含量上升,且有显著性差异(P<0.05);KGM中、高剂量组脑组织匀浆中MDA含量显著降低(P<0.05);KGM各剂量组可有效降低血、脑中AcH质量浓度;KGM各剂量组脑组织匀浆中β-EP质量浓度均显著下降(P<0.05);KGM中、高剂量组脑组织匀浆中DA、5-HT质量浓度显著降低(P<0.05)。总体来看:KGM可以降低血、脑中AcH质量浓度,且KGM高剂量组对脑损伤的抗氧化能力优于低、中剂量组,在一定程度上可以调节酒后脑组织中自由基代谢,避免氧化损伤;KGM中、高剂量组能显著调节脑中神经递质含量,证明了KGM在一定程度上具有保护急性酒精中毒小鼠脑组织的作用。在具体作用机理方面,据相关文献可以推断出KGM能通过物理吸附减少乙醇的吸收[17],但具体量效关系等尚不明确,其他作用机理还需要进一步的深入研究。
[1] 解傲, 赵恕. 国内解酒制品研究进展[J]. 中国微生态学杂志, 2012,24(12): 1146-1149. DOI:10.13381/j.cnki.cjm.2012.12.009.
[2] VONGHIA L, LEGGIO L, FERRULLI A, et al. Acute alcohol intoxication[J]. European Journal of Internal Medicine, 2008, 19(8):561-567. DOI:10.1016/j.ejim.2007.06.033.
[3] BRANDON-WARNER E, SCHRUM L W, SCHMIDT C M, et al.Rodent models of alcoholic liver disease: of mice and men[J]. Alcohol,2012, 46(8): 715-725. DOI:10.1016/j.alcohol.2012.08.004.
[4] 钱明雪, 李胜立, 李凡, 等. 6 种石斛多糖抗亚急性酒精性肝损伤作用的比较[J]. 中国药学杂志, 2015, 50(24): 2117-2123.
[5] 洪金艳, 李洪军, 贺稚非, 等. 解酒保肝活菌饮料的发酵工艺[J]. 食品与发酵工业, 2015, 41(7): 86-92. DOI:10.13995/j.cnki.11-1802/ts.201507016.
[6] CHEN X, CAI F, GUO S, et al. Protective effect of flos puerariae extract following acute alcohol intoxication in mice[J]. Alcoholism-Clinical and Experimental Research, 2014, 38(7): 1839-1846.DOI:10.1111/acer.12437.
[7] DOKUR M, CHEN C P, ADVIS J P, et al. β-Endorphin modulation of interferon-gamma, perforin and granzyme B levels in splenic NK cells:effects of ethanol[J]. Journal of Neuroimmunology, 2005, 166(1/2):29-38. DOI:10.1016/j.jneuroim.2005.03.015.
[8] THIRUCHSELVAM T, WILSON A A, BOILEAU I, et al. A preliminary investigation of the effect of acute alcohol on dopamine transmission as assessed by [11C]-(+)-PHNO[J]. Alcoholism-Clinical and Experimental Research, 2017, 41(6): 1112-1119. DOI:10.1111/acer.13403.
[9] KARADAYIAN A G, CUTRERA R A. Alcohol hangover: type and time-extension of motor function impairments[J]. Behavioural Brain Research, 2013, 247: 165-173. DOI:10.1016/j.bbr.2013.03.037.
[10] 郑殿升, 杨庆文. 中国作物野生近缘植物资源[J]. 植物遗传资源学报, 2014, 15(1): 1-11. DOI:10.13430/j.cnki.jpgr.2014.01.001.
[11] 惠伯棣, 张旭, 宫平. 食品原料在我国功能性食品中的应用研究进展[J]. 食品科学, 2016, 37(17): 296-302. DOI:10.7506/spkx1002-6630-201617049.
[12] VUKSAN V, SIEVENPIPER J L, XU Z, et al. Konjac-mannan and american ginsing: emerging alternative therapies for type 2 diabetes mellitus[J]. Journal of the American College of Nutrition, 2001, 20(5):370-380. DOI:10.1080/02726340590915566.
[13] 张茂玉, 黄承钰, 洪君蓉, 等. 魔芋食品对人体脂质代谢影响的研究[J]. 营养学报, 1989(1): 25-30. DOI:10.3321/j.issn:0512-7955.1989.01.010.
[14] 王敏, 帅天罡, 秦清娟, 等. 魔芋葡甘低聚糖对大鼠肠道环境的影响[J].食品科学, 2016, 37(7): 197-203. DOI:10.7506/spkx1002-6630-201607036.
[15] 黄明发, 张盛林. 魔芋膳食纤维保健作用研究进展[J]. 中国食物与营养, 2010(5): 75-77. DOI:10.3969/j.issn.1006-9577.2010.05.021.
[16] 梁娜, 秦清娟, 邹勇, 等. 魔芋葡甘聚糖对小鼠的防醉解酒作用[J]. 食品工业科技, 2015, 36(14): 366-369. DOI:10.13386/j.issn1002-0306.2015.14.067.
[17] 郑连姬, 邓利玲, 罗嘉妮, 等. 魔芋葡甘聚糖抗醉解酒作用机理研究[J]. 食品与机械, 2017, 33(5): 156-161. DOI:10.13652/j.issn.1003-5788.2017.05.032.
[18] 杜茂波, 巩桥. 魔芋精粉对大鼠酒精性肝损伤保护作用的研究[J].中国当代医药, 2014, 21(17): 18-20.
[19] 赵勤. 氧化魔芋葡甘聚糖的免疫功能评价[D]. 雅安: 四川农业大学,2010: 16-17.
[20] 杨牧祥, 于文涛, 胡金宽. 酒速愈对急性酒精中毒小鼠海马AchE和纹状体单胺神经递质含量的影响[J]. 北京中医药大学学报,2007(2): 112-114. DOI:10.3321/j.issn:1006-2157.2007.02.011.
[21] 梁桂宁. 紫菜多糖保护小鼠胃黏膜免受酒精急性损伤的机制研究[D].南宁: 广西医科大学, 2009: 8-11. DOI:10.7666/d.y1462814.
[22] 毛健, 徐妍, 邓玉林, 等. 急性酒精中毒的鼠脑内乙醛及其单胺神经递质缩合物的测定[J]. 分析化学, 2010, 38(12): 1789-1792.DOI:10.3724/SP.J.1096.2010.01789.
[23] 孙玉军, 江昌俊, 任四海. 秀珍菇多糖对D-半乳糖致衰老小鼠的保护作用[J]. 食品科学, 2017, 38(5): 251-256. DOI:10.7506/spkx1002-6630-201705041.
[24] 姜翠霞. L-NNA对酒精中毒家兔脑组织NOS活性及NOS阳性神经元的影响[D]. 泰安: 山东农业大学, 2015: 11-35.
[25] 黄锟. 人乙醛脱氢酶2的表达及其在缓解小鼠急性酒精中毒中的研究[D]. 武汉: 武汉工程大学, 2010: 8-11.
[26] 赵丽. 酒精中毒大鼠脑血管病变及相应脑组织损伤的病理观察研究[D]. 长春: 吉林大学, 2004: 9-25.
[27] 蓝贤俊, 邓彩霞, 陈永兰, 等. 白茅根对酒精中毒小鼠肝及脑损伤的保护作用研究[J]. 医学理论与实践, 2012, 25(2): 125-126; 128.DOI:10.3969/j.issn.1001-7585.2012.02.001.
[28] 杨芳, 禹强, 韩玉翠, 等. 魔芋葡甘聚糖对饮酒大鼠血清硒及脂质过氧化的影响[J]. 西北农林科技大学学报(自然科学版), 2013, 41(5):14-18. DOI:10.13207/j.cnki.jnwafu.2013.05.013.
[29] 杜爱林, 徐春阳, 李爽, 等. 急性酒精中毒对老龄大鼠纹状体NO和nNOS及学习记忆的影响[J]. 医学信息(手术学分册), 2007(8): 708-710. DOI:10.3969/j.issn.1006-1959-C.2007.08.017.
[30] DAVIS R L, SYAPIN P J. Interactions of alcohol and nitric-oxide synthase in the brain[J]. Brain Research Reviews, 2005, 49(3): 494-504. DOI:10.1016/j.brainresrev.2005.01.008.
[31] 曹士奇, 陈锁成, 孙斌, 等. NO在体外循环中脑损伤作用机制的研究进展[J]. 医学综述, 2007(16): 1208-1210. DOI:10.3969/j.issn.1006-2084.2007.16.004.
[32] DALAYEUN J F, NORÈS J M, BERGAL S. Physiology of β-endorphins: a close-up view and a review of the literature[J].Biomedicine & Pharmacotherapy, 1993, 47(8): 311-320.DOI:10.1016/0753-3322(93)90080-5.
[33] 荆晓明, 董芸, 宋文忠, 等. 急性酒精中毒患者血清β-内啡肽水平及意义[J]. 中华急诊医学杂志, 2001(4): 257-258. DOI:10.3969/j.issn.1672-3511.2002.01.014.
[34] 杨晓华, 张华峰, 赖江华. 中枢单胺类神经递质在酒精依赖中的分子作用机制[J]. 遗传, 2014, 36(1): 11-20. DOI:10.3724/SP.J.1005.2014.0021.
[35] 武晓华, 景强. 酒精依赖与多巴胺系统基因多态性研究进展[J].医学研究杂志, 2009, 38(1): 88-90. DOI:10.3969/j.issn.1673-548X.2009.01.033.
[36] 项翠琴, 汪根盛, 傅慰祖, 等. 乙醇对大鼠脑纹状体和海马神经递质的影响[J]. 环境与职业医学, 2004(2): 121-123. DOI:10.3969/j.issn.1006-3617.2004.02.012.
[37] JIAO X, PARÈ W P, TEJANI-BUTT S M. Alcohol consumption alters dopamine transporter sites in Wistar-Kyoto rat brain[J]. Brain Research, 2006, 1073: 175-182. DOI:10.1016/j.brainres.2005.12.009.
[38] 杨岑, 冉明梓, 欧阳鹏荣, 等. 五羟色胺在睡眠-觉醒中作用[J].现代生物医学进展, 2015(11): 2191-2194. DOI:10.13241/j.cnki.pmb.2015.11.053.
[39] OATES P J, HAKKINEN J P. Studies on the mechanism of ethanolinduced gastric damage in rats[J]. Gastroenterology, 1988, 94(1): 10-21. DOI:10.1016/0016-5085(88)90604-X.
[40] 柯以铨, 徐如祥, 陈长才. 脑微血管5-羟色胺多巴胺变化在鼠脑损伤中的意义[J]. 中华神经外科杂志, 1997(5): 66. DOI:10.3760/j.issn:1001-2346.1997.05.024.
